研究交流
成体肝前駆細胞を制御するニッチシグナル
伊藤 暢
東京大学分子細胞生物学研究所 発生・再生研究分野
はじめに:肝再生に関わる幹/前駆細胞
「成体肝臓に幹/前駆細胞が存在するのか、肝組織(肝細胞および胆管上皮細胞)の維持や再生に寄与しているのか」という点については未だに議論の続くところである。そもそも、肝幹/前駆細胞を如何様に定義するのか自体が問題であり、それによって見解も異なってくるであろう[文献1]。少なくとも、様々な障害時に肝臓で特殊な(幹/前駆細胞様の)細胞の出現・増幅が観察される点、それらが病態および再生に何らかの関わりを持つと考えられるという点においては、コンセンサスが得られていると思われる。そのような細胞の典型はラット肝障害モデルにおける「オーバル細胞」であり、古くから解析が行われてきた(西川祐司先生の稿、参照)。
近年、遺伝学的解析に有利なマウスモデルの利用が進み、類似の性質を示す細胞をマウスでも同様に「オーバル細胞」と呼ぶことが多い。しかしながら、ラット肝障害モデルとは病因・病態が異なっており、出現した細胞の性状についてもどの程度まで一致しているのか不明である。混乱を避けるため、ここでは ① マウスの肝障害モデルにおいて誘導される細胞で、② サイトケラチン(CK)19やEpCAM(epithelial cell adhesion molecule)[文献2]、CD133[文献3,4]等の胆管上皮細胞と共通のマーカーを発現しており、③ 門脈付近に出現して障害の進行と共に実質領域中に広がっていく、という特徴を有するものを指して「成体肝前駆細胞(adult liver progenitor cell, 以下LPC)」と呼ぶことにする。
肝再生メカニズムについての研究は、長きに亘り、もっぱら部分肝切除後の「代償性再生」モデルを中心に行われてきた。近年、「肝幹/前駆細胞依存性の再生」はヒトの病態をより反映するものとして注目を集め、研究が加速している。我々も、その起源や性状、制御メカニズムについて、種々のマウス肝障害モデルを用いた解析を進めている(図1)。本稿では、最近明らかにしたFGFシグナルによるLPC制御機構[文献5]について紹介させていただく。
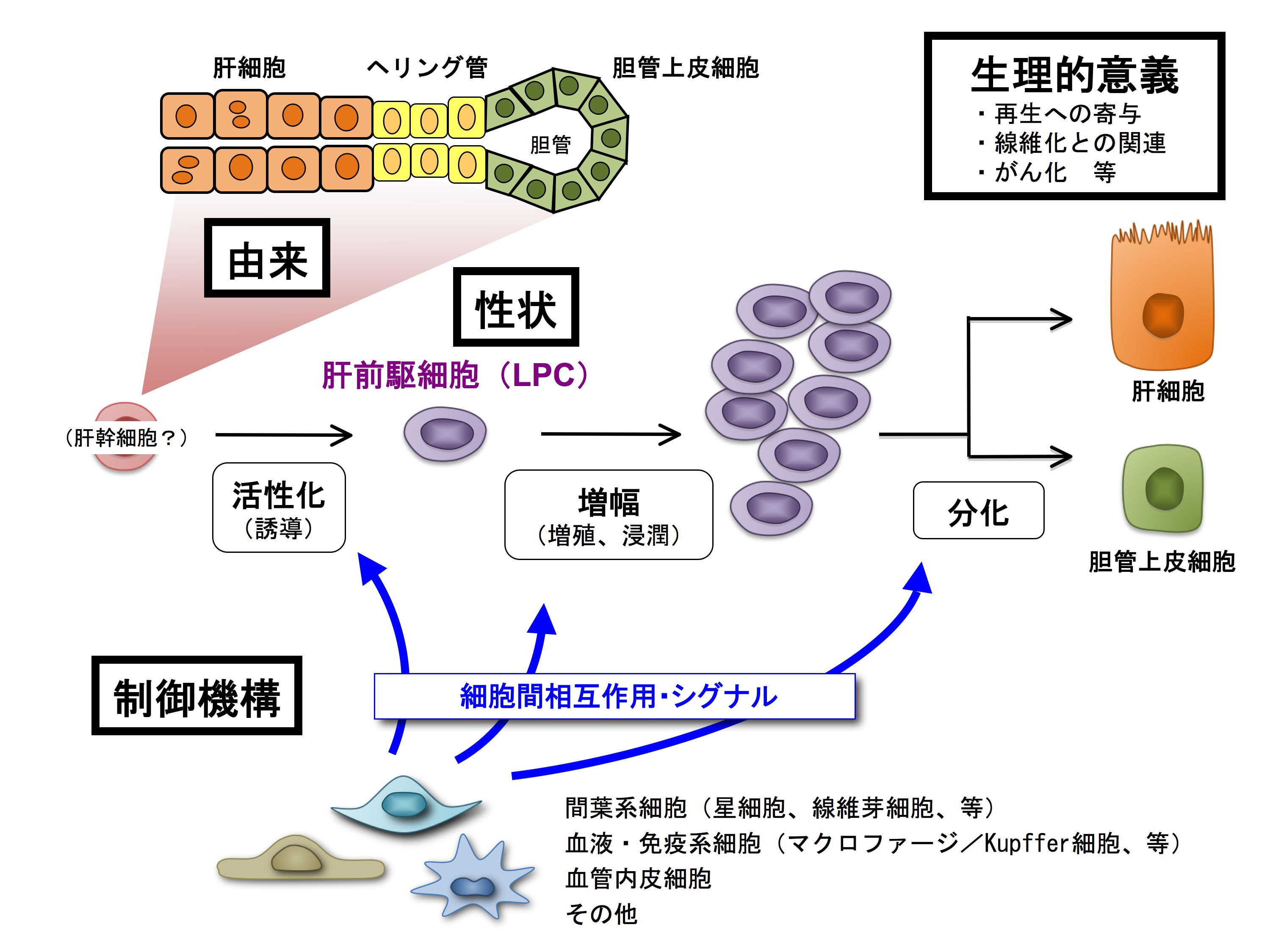
図1.肝前駆細胞の研究における課題.
肝前駆細胞は障害時に門脈域で出現・増幅するが、その正確な由来は不明である。一般にはヘリング管付近に由来とすると言われているものの、ヘリング管の構成細胞を特異的に標識・同定可能なマーカーは見つかっていない。正常な肝臓中に、障害時に活性化される肝前駆細胞の元となるべき特殊な「肝幹細胞」が存在するという考え方がある一方で、成熟した肝細胞あるいは胆管上皮細胞が障害時に変化する可能性も示唆されている。活性化された肝前駆細胞は増殖しながら実質組織中へと浸潤し、肝細胞および胆管上皮細胞へと分化することで再生に寄与すると考えられている。ただし、単一の(clonalな)肝前駆細胞が生体組織中(in vivo)において実際に二方向への分化能を示すという厳密な証明は、未だなされていない。
肝前駆細胞の制御に関わるニッチの同定
一般に組織幹/前駆細胞は、その周囲をとりまく細胞や細胞外基質といった微小環境、いわゆる「ニッチ(niche)」により、未分化性の維持や増殖・分化の制御を受けることが知られている。我々は、LPCに対しても、その活性を制御する何らかのニッチが存在するとの仮説を立て、これを同定することから研究を開始した。具体的には、マウス障害肝においてLPCに隣接して存在する細胞で発現するマーカー分子の探索を行った。この時、マーカー発現を指標に細胞をセルソーターで分離・解析することを想定して、特に細胞表面マーカーに注目した(宮島篤先生および田中稔先生の稿、参照)。LPC誘導性肝障害モデルとして一般的に用いられるDDC(3,5-diethoxycarbonyl-1,4-dihydrocollidine)投与系[文献6,7]において、種々の間葉系細胞マーカーや血液細胞マーカーと、LPCマーカーとの共免疫染色を行った結果、Thy1(Thymus cell antigen-1、別名CD90)陽性の細胞が、LPCに隣接して存在することを見出した(図2. A)。Thy1は元々、T細胞のマーカーとして知られている。LPCに隣接して存在するものは血液細胞マーカーCD45陰性であり、遺伝子発現解析等の結果から、間葉系の性質を持つ細胞だと考えられた(以下、単に「Thy1陽性細胞」と記す)。DDCモデルのみならず、胆汁鬱体性の肝障害(総胆管結紮)や慢性肝炎(肝特異的Tak1 KOマウス)[文献8,9]など、LPC誘導を伴う種々の肝障害モデルにおいてThy1陽性細胞がLPCに隣接して増幅する様子が観察された。
Thy1陽性細胞を「LPCに対するニッチ」として機能的に位置づけるためには、これが何らかのシグナルを介してLPCに直接的に作用し、その活性制御に関わることを明確に示す必要がある。Thy1陽性細胞は間葉系の性質を持ち、一方で、肝細胞や胆管上皮細胞に分化する(と想定される)LPCは上皮系の細胞だと考えられる。そこで、「間葉 – 上皮相互作用」に関わる種々の細胞間シグナル伝達分子について、肝障害時の発現パターンの検討を行った結果、線維芽細胞増殖因子(fibroblast growth factor; FGF)ファミリー分子[文献10,11]のFGF7(別名keratinocyte growth factor; KGF)を見出した。FGF7の発現は正常肝ではほとんど認められないのに対して、DDCモデルをはじめ、総胆管結紮や肝特異的Tak1 KOマウスにおいても顕著に誘導され、LPCの周囲で観察された。セルソーターで単離した細胞分画での遺伝子発現解析から、Thy1陽性細胞がFGF7の主な産生細胞であることが示された。一方、FGF7の特異的な受容体FGFR2bは、LPCにおいて強く発現していた。すなわち、LPC活性化を伴う様々な肝障害時に共通して、Thy1陽性細胞がFGF7を産生・分泌し、LPCに直接作用を及ぼすことが強く示唆された。岩手医科大学・滝川康裕先生らとの共同研究により、ヒトの急性肝炎や劇症肝炎の患者の血清中でFGF7濃度が増大することも確認された。
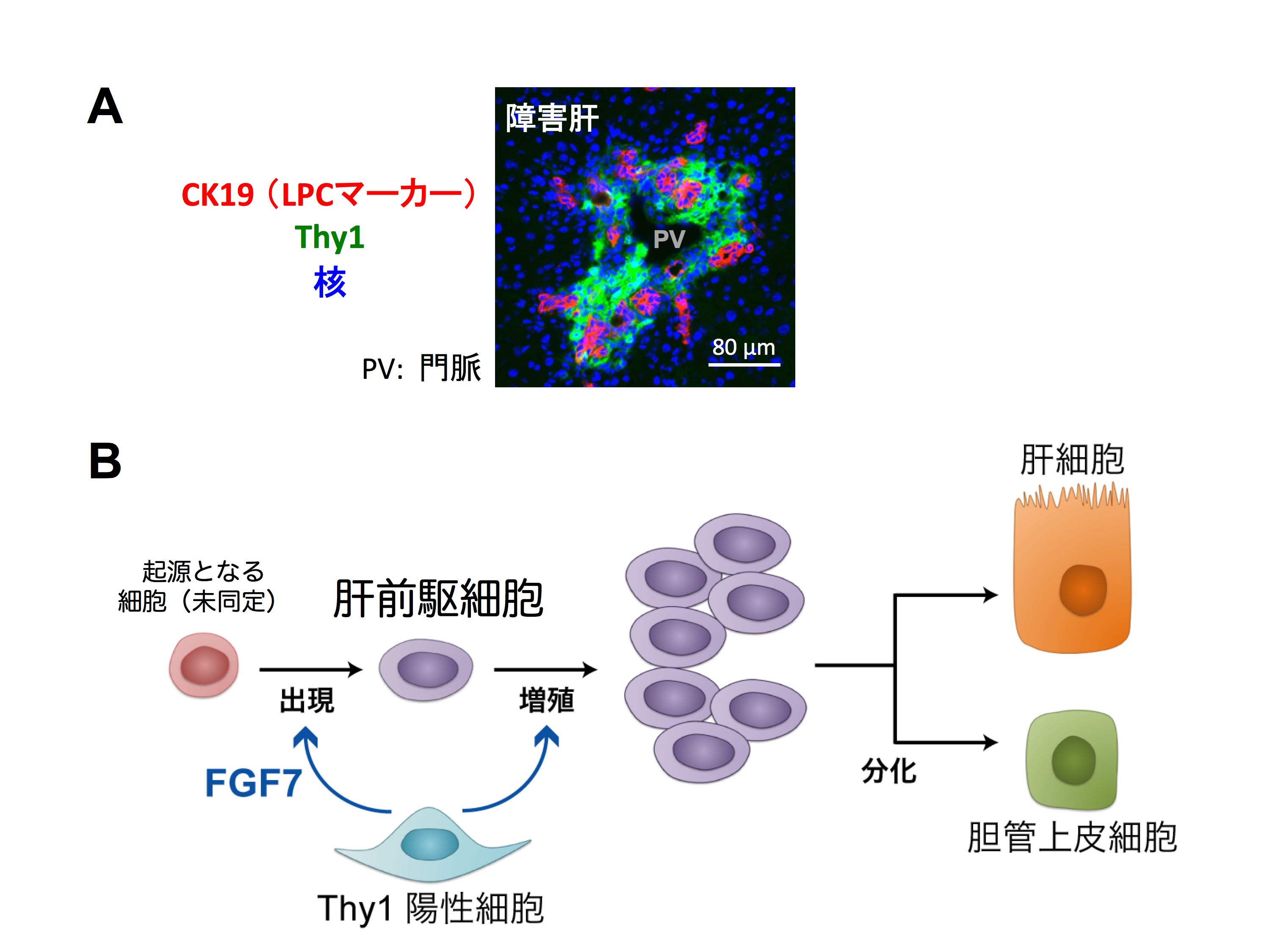
図2.Thy1陽性細胞/FGF7シグナルによる肝前駆細胞活性化の誘導.
パネルA:マウス肝障害モデル(DDC投与モデル)の肝臓組織切片における免疫染色像.門脈(PV)付近で、CK19陽性の肝前駆細胞(LPC;赤色)が出現・増幅し、実質域に向かって広がっていく。このとき、Thy1陽性細胞(緑色)が肝前駆細胞に隣接して存在する。
パネルB:肝障害時におけるThy1陽性細胞は、FGF7を産生・分泌することで肝前駆細胞の活性化(出現)および増幅を誘導する「ニッチ」として機能する。
肝前駆細胞ニッチシグナルとしてのFGF7
FGF7の機能を明らかにするために、遺伝子改変マウスを用いた解析を行った。FGF7ノックアウト(KO)マウスでの解析(loss-of-function)では、DDC投与や胆管結紮による肝障害時にLPC誘導がほぼ完全に抑制されていることが明らかとなった。DDC投与モデルを用いて詳細な検討を行ったところ、KOマウスでは肝障害が顕著に増悪化し、個体の致死率が有意に上昇した。一方で、肝臓特異的かつ誘導性にFGF7を強制発現可能なトランスジェニック(Tg)マウスを作製して解析(gain-of-function)を行ったところ、肝障害が無い状態でもFGF7の過剰発現のみでLPCの活性化を人為的に誘導可能であった。さらに、DDCによる肝障害モデルにおいてFGF7を過剰に発現させることで、再生を誘導・促進し、障害の程度を軽減させる効果があることが示された。以上の結果から、肝障害時におけるThy1陽性の「ニッチ細胞」とのFGF7を介した相互作用が、LPCの活性化に重要であることが初めて明らかとなった(図2. B)。将来的には、FGF7あるいは関連する分子を用いることで、種々のヒトの肝疾患に対する新規治療法の開発への応用も期待される。
まとめと展望
LPCの誘導や分化の制御に関わるニッチシグナルとして、FGF7の他にもTWEAK[文献12,13]、HGF[文献14,15]、EGF[文献15]Notch[文献15,16]、Wnt[文献16]等が相次いで報告されている。それらのシグナルとThy1陽性細胞/FGF7との関係・相互作用の様態を明らかにすることで、LPC制御機構の全体像が明らかとなるであろう。FGF7の機能欠損(KO)あるいは過剰発現(Tg)によりLPCの誘導レベルをそれぞれ抑制あるいは増加させた場合に、肝障害の程度がこれと相関して増悪化あるいは改善したことは、LPCが実際に肝臓の再生に積極的に寄与する可能性を強く示唆している。同様の相関性は、HGFの受容体c-MetのKOマウスを用いた解析からも示されている[文献14]。今後は、LPC特異的なマーカーを用いて障害肝でLPCを選択的に除去(cell ablation)する実験等により、より直接的にLPCの寄与を証明する必要がある。
一方で、Cre-loxPシステムを用いたマウスでの細胞系譜解析(ホットトピックス・川口義弥先生の稿、参照)の結果から、少なくともDDC障害モデルにおいては、LPCから肝細胞への分化は殆ど/全く起こらないとする見解が有力となってきた[文献17,18,19]。種々の肝障害モデルにおけるLPCの性状の相違も含めて、マウスで誘導されるLPCが「オーバル細胞」や「肝幹/前駆細胞」で想定されるような「二分化能」を必ずしも示さない可能性については、昨年の肝細胞研究会(2013年9月、大阪)でも海外招聘演者らも交えてホットな議論が交わされたところである。仮にLPCから肝細胞への分化が起こらない場合、CK19やEpCAMの発現で定義される標準的(authentic)なLPCとは別に、真の「肝幹/前駆細胞」が存在して新たな肝細胞を生み出しているのだろうか? そのような細胞に対して、FGF7シグナルや、FGF7により活性化されるLPCはどのような作用を及ぼしているのか? 今後の更なる解析により明らかにしていきたい。
謝辞
本稿執筆の機会をご提供くださった静岡大学の塩尻信義先生に感謝申し上げます。本稿で紹介した研究は、東京大学分子細胞生物学研究所 発生・再生研究分野において、宮島篤教授のご指導・支援のもとに高瀬比菜子博士・猪野清太朗氏らと行ったものです。岩手医科大学・滝川康裕先生をはじめ、共同研究者である諸先生方に、この場を借りて改めて御礼申し上げます。
参考文献
- Itoh, T. and Miyajima, A.(2013) Liver regeneration by stem/progenitor cells. Hepatology, in press. doi: 10.1002/hep.26753.
- Okabe, M., Tsukahara, Y., Tanaka, M. et al. (2009) Potential hepatic stem cells reside in EpCAM+ cells of normal and injured mouse liver. Development, 136:1951-1960.
- Rountree, C. B., Barsky, L., Ge, S.et al. (2007) A CD133-expressing murine liver oval cell population with bilineage potential. Stem Cells, 25:2419-2429.
- Suzuki, A., Sekiya, S., Onishi, M. et al. (2008) Flow cytometric isolation and clonal identification of self-renewing bipotent hepatic progenitor cells in adult mouse liver. Hepatology, 48:1964-1978.
- Takase, H. M., Itoh, T., Ino, S. et al. (2012) FGF7 is a functional niche signal required for stimulation of adult liver progenitor cells that support liver regeneration. Genes Dev., 27:169-181.
- Preisegger, K. H., Factor, V. M., Fuchsbichler, A. et al. (1999) Atypical ductular proliferation and its inhibition by transforming growth factor b1 in the 3,5-diethoxycarbonyl-1,4-dihydrocollidine mouse model for chronic alcoholic liver disease. Lab. Invest., 79:103–109.
- Fickert, P., Stöger, U., Fuchsbichler, A. et al. (2007) A new xenobiotic-induced mouse model of sclerosing cholangitis and biliary fibrosis. Am. J. Pathol., 171:525-536.
- Bettermann, K., Vucur, M., Haybaeck, J. et al. (2010) TAK1 suppresses a NEMO-dependent but NFkB-independent pathway to liver cancer. Cancer Cell, 17:481–496.
- Inokuchi, S., Aoyama, T., Miura, K. et al. (2010) Disruption of TAK1 in hepatocytes causes hepatic injury, inflammation, fibrosis, and carcinogenesis. Proc. Natl. Acad. Sci. U.S.A., 107:844–849.
- Itoh, N. and Ornitz, D. M. (2008) Functional evolutionary history of the mouse Fgf gene family. Dev. Dyn., 237:18–27.
- Turner, N. and Grose, R. (2010) Fibroblast growth factor signalling: From development to cancer. Nat. Rev. Cancer, 10:116–129.
- Jakubowski, A., Ambrose, C., Parr, M. et al. (2005) TWEAK induces liver progenitor cell proliferation. J. Clin. Invest., 115:2330-2340.
- Tirnitz-Parker, J. E., Viebahn, C. S., Jakubowski, A. et al. (2010) Tumor necrosis factor-like weak inducer of apoptosis is a mitogen for liver progenitor cells. Hepatology, 52:291-302.
- Ishikawa, T., Factor, V. M., Marquardt, J. U. et al. (2012) Hepatocyte growth factor/c-met signaling is required for stem-cell-mediated liver regeneration in mice. Hepatology, 55:1215-1226.
- Kitade, M., Factor, V. M., Andersen, J. B. et al. (2013) Specific fate decisions in adult hepatic progenitor cells driven by MET and EGFR signaling. Genes Dev., 27:1706-1717.
- Boulter, L., Govaere, O., Bird, T. G. et al. (2012) Macrophage-derived Wnt opposes Notch signaling to specify hepatic progenitor cell fate in chronic liver disease. Nat. Med., 18, 572-579.
- Malato, Y., Naqvi, S., Schürmann, N. et al. (2011) Fate tracing of mature hepatocytes in mouse liver homeostasis and regeneration. J. Clin. Invest., 121:4850-4860.
- Español-Suñer, R., Carpentier, R., Van Hul, N. et al. (2012) Liver progenitor cells yield functional hepatocytes in response to chronic liver injury in mice. Gastroenterology, 143:1564-1575.
- Yanger, K., Zong, Y., Maggs, L. R. et al. (2013) Robust cellular reprogramming occurs spontaneously during liver regeneration. Genes Dev., 27:719-724.










