研究交流
肝障害と幹細胞 ― 肝修復における幹細胞の役割
西川祐司
秋田大学医学部 病理病態医学講座 分子病態学分野
- はじめに
- 肝幹細胞研究の現在
- 肝幹細胞の候補とされている細胞
- 肝実質置換能力と肝障害治療効果
- 肝障害に伴う細胆管の増生(細胆管反応)‐肝幹細胞の活性化?
- 成熟肝細胞の可塑性‐胆管上皮細胞への分化転換
- おわりに
- 引用文献
1.はじめに
肝幹細胞は少なくとも肝細胞と胆管上皮細胞へ分化しうる両能性(bipotentiality)をもつ細胞であり,成熟肝内に少数存在するが,肝障害時に活性化され,肝修復を促していると考えられている.また,肝外の幹細胞が肝構成細胞に分化しうることも示されており,これらを肝障害の治療に応用する試みがなされている.しかし,幹細胞が肝修復において実際にどのような役割を担っているかについては不明な点が多い.本稿では最初に,幹細胞に関する最新の知見を整理するとともに,肝障害からの回復には,肝内または肝外のどのタイプの細胞が有効なのか,さらに,幹細胞の増殖および分化にはどのような肝内微小環境が必要なのかなどについて考察したい.また,後半では成熟肝細胞の可塑性,特に胆管上皮への化生に関する我々のデータを紹介したい.
2.肝幹細胞研究の現在
(1)肝幹細胞の候補とされている細胞
これまで肝幹細胞の性質を示す細胞がラット,マウスをはじめとする実験動物およびヒトにおいて多数同定されてきた(図1).いずれが真の幹細胞なのか,複数の細胞タイプが肝幹細胞の性質を示しうるのかは,興味深い問題であるが,現時点ではまだ結論は出ていない.
肝幹細胞の問題を考える前に,発生学的な知見を整理しておきたい.肝臓は前腸内胚葉の肝憩室として発生し,その頭側において横中隔結合織内に向いα-フェトプロテイン(α-fetoprotein, AFP)陽性の肝芽細胞が進入する.これらはその後増殖し,肝実質を構成するとともに,アルブミンを産生するようになる.門脈周囲結合織の発達に伴い,これに接するアルブミン陽性肝芽細胞がサイトケラチン19(cytokeratin
19, CK19)やEpCAM陽性の小葉間胆管を形成する(図2)1).このように肝細胞だけでなく,肝内胆管の上皮細胞もアルブミンを産生する段階にまで分化した肝芽細胞に由来することを確認しておきたい.また,肝芽細胞は初期から表面にdelta-like (Dlk)を発現する2).
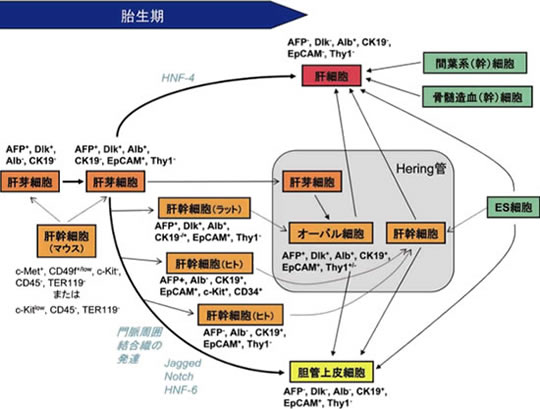
図1 肝上皮系細胞の発生からみた肝幹細胞の位置づけ
肝細胞と胆管上皮細胞(肝内胆管)はいずれも肝芽細胞に由来する.肝芽細胞は胆管上皮細胞に分化する時点で,すでにアルブミンを発現する.これまで肝幹細胞の候補が多数あげられてきたが,これらの分化状態は肝芽細胞から胆管上皮細胞に至る種々の段階に相当すると考えられる.肝芽細胞または肝幹細胞は成熟肝においても少数存在しており,肝傷害に伴い活性化され,肝修復に重要な意義をもつとされている.図には示していないが,中内胚葉起源が疑われる幼若な幹細胞がヒト胎児肝に存在することも示唆されている.また,肝細胞に分化しうる肝外(幹)細胞が見出されており,治療への応用が試みられている.
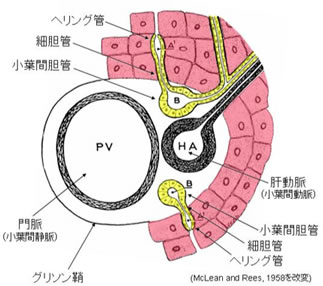
図2 グリソン鞘とその周囲の解剖学的構造
グリソン鞘内の小葉間胆管(B)は細胆管を介して肝細胞と連絡するが,その境界部(A1)には管腔が胆管上皮および肝細胞両方からなるへリング管(Hering duct)と呼ばれる構造が存在する.肝幹細胞は成熟肝においては,これらのへリング管付近に局在していると想定されている.PVは門脈,HAは肝動脈を示す.
| [1] オーバル細胞 | 肝幹細胞のプロトタイプとして,オーバル細胞(oval cell)があげられる3).本来,これはラットにおいて,2-アセチルアミノフルオレン(2-acetylaminofluorene, 2-AAF)により肝細胞の増殖を抑制した状態で部分肝切除または四塩化炭素投与を行った場合に門脈域周囲に出現する,核/細胞質比の高い卵円形細胞として記載されたものである(図3A).この細胞は肝細胞と胆管上皮細胞の両方の形質をあわせもち(アルブミン,CK19陽性),AFP陽性であり,一部にDlkの発現がみられることから4, 5),肝芽細胞に類似した性格をもつと考えられる.同様の形態を示す細胞はマウスでも異なった方法で誘導でき(図3B),ヒト肝疾患でも,まれにグリソン周囲にオーバル細胞が観察されることがある.以上より,成熟肝において,肝芽細胞に近い幹細胞が,肝細胞と小葉間胆管の接点(へリング管,Hering duct)付近に存在し,これらが肝障害時に活性化されてオーバル細胞となり,肝再生を行うとの仮説が立てられている(図2)3).しかし,最近,マウスのオーバル細胞ではAFPやDlkの発現は乏しいなど,動物種の間に大きい違い(heterogeneity)が存在することも指摘されており6),病態生理学的な意義についてまだ不明の点が多く残されている. |
| [2] 胎仔(児)肝に存在する幹細胞 | フローサイトメトリーを用いた研究で,肝幹細胞がマウス胎仔肝内に存在することが示されている.マウス胎仔肝の非造血細胞分画の中に,増殖能が高く,肝細胞,胆管上皮細胞だけでなく膵細胞や腸粘膜上皮細胞に分化しうる幹細胞(H-CFU-C)が,c-Met,a6-integrin (CD49f) 陽性,c-Kit陰性を指標として分離されている(c-Met+ CD49f+/low c-Kit- CD45- TER119-)7).しかし,肝幹細胞はc-Kitを表面マーカーとして用いても分離することが可能であり(c-Kitlow CD45- TER119-)8),マウス肝幹細胞が単一の細胞集団ではないことも示唆される.また最近,マウス胎仔肝幹細胞の新たな表面マーカーとしてNope (neighbor of Punc E11) が同定された9).これらのマウス胎仔肝幹細胞と肝芽細胞やオーバル細胞との関連性は明瞭ではないが,H-CFU-Cの少なくとも一部はin vitroでオーバル細胞様に分化することが示されている7). ラット胎仔肝内の幹細胞は,肝芽細胞の表面マーカーであるDlkに対する抗体を用いた磁気ビーズ法により分離されている(fetal liver stem/progenitor cells, FLSPC)10).これらはCK19陽性,陰性いずれでもありうるが,AFP陽性であり,肝芽細胞またはオーバル細胞に近い細胞と考えられる. ヒト胎児肝からは,HEA-125抗体を用いた磁気ビーズ法によりEpCAM陽性細胞として幹細胞が分離されている11).これらはAFP陰性,アルブミン陰性,CK19陽性であり,胆管上皮細胞方向に分化した形質を示しているが,in vitro,in vivoで肝細胞,胆管上皮細胞の両方に分化誘導することが可能とされている.また,肝細胞,胆管上皮細胞だけでなく,脂肪,骨,軟骨,内皮細胞へと分化する能力をもつ単クローン細胞(human fetal liver multipotent progenitor cells, hFLMPC)も分離されており(CD34+ CD90+ Thy+ c-Kit+ EpCAM+ cMet+, SSEA-4+ CK18+ CK19+ Alb- ALP- CD44h+ Vimentin+),おそらく肝芽細胞に分化する前の中内胚葉由来の幼若な細胞であると推定されている12).さらに,磁気ビーズ法によりc-Kit+ CD34+ Lin- の肝幹細胞も分離されている13). |
| [3] 肝細胞, 小型肝細胞 |
肝細胞は一旦成熟した後も,ES細胞と同等レベルの増殖能力,自己複製能力を保持していることが証明されている14).この意味で肝細胞は以前より“単能性幹細胞(unipotential stem cell)”であると認められてきたが,後述するように肝細胞は胆管上皮細胞へ分化する能力もあわせもつことが次第に明らかとなっており15, 16),事実上,肝幹細胞の基準を満たしていると言える17).また,ラットでは成熟肝細胞より増殖性が高い小型肝細胞が存在することが知られており18, 19),最近これらが門脈周囲に局在することが示された20). |
| [4] 肝外性肝幹細胞 | 肝外にも肝幹細胞の性格を示す,もしくは肝細胞への分化が可能な細胞が存在する.マウスES細胞はin
vivoで成熟肝細胞に分化するとともに,FGF1,FGF4,HGF,OSMなどのサイトカインを組み合わせた単層培養系において直接的に肝細胞に分化させうることが示されている21, 22).また,ヒト脂肪細胞由来間葉系幹細胞23),ラット骨髄間葉系(幹)細胞24, 25),ヒト臍帯間質細胞26)などを成熟肝細胞に分化させることも可能である.また,骨髄から採取した細胞を四塩化炭素投与ラットに静注すると門脈周囲で効率良く肝細胞に分化するとともに,MMP-9を発現し,肝障害,肝線維化を緩和すると報告されている27, 28). オーバル細胞はThy1,CD34などの骨髄造血幹細胞のマーカーを発現し,実際にオーバル細胞が骨髄細胞に由来することを示唆するデータが報告されたが29),現在は骨髄造血幹細胞細胞から肝細胞への分化はほとんどおこらないとみなされている30, 31).しかし最近,ヒト臍帯血からの肝細胞分化がin vivoで証明されており,幼若な造血細胞は肝細胞のソースとして有用である可能性がある32). |
(2)肝実質置換能力と肝障害治療効果
上記の肝幹細胞は肝障害の治療への応用が期待されている.しかし,実際に治療効果を発揮するためには,肝に生着した後に増殖し,肝実質の相当部分を置換する(repopulation)能力が必要である.ヒトのウィルソン(Wilson)病モデルのLECラットから分離したオーバル細胞が無処置肝に生着,分化した顕著な例があるが33),多くの場合,オーバル細胞を含めた肝幹細胞の移植による肝実質置換はホスト肝に強い肝傷害が加わってなければ効率良くおこらない.遺伝子改変マウス(fumarylacetoacetate hydrolase欠損)を用いた持続的肝傷害では,移植されたオーバル細胞の肝実質置換能力は成熟肝細胞とほぼ同程度であると報告されている30).マウスES細胞もしくはこれらから誘導した肝細胞の障害肝内移植では,導入した細胞の約5分の1程度(106個)が生着し,四塩化炭素やジメチルニトロソアミン(dimethylnitrosamine)による肝障害を有意に軽減する21, 22).
一方,胎児肝幹細胞の一部(FLSPC)は,正常肝を実質置換する能力が高いとされている(移植後6ヶ月で約15%を置換)10).そのメカニズムとして,移植幹細胞の高い増殖能力と低いアポトーシス頻度とともに隣接するホスト肝細胞に対するアポトーシスの誘導が推定されている(細胞競合,cell competition)34).このような実質置換能力をもつ胎児幹細胞が肝障害の治療に実際に有効であるかは,今後検討されるべき課題である.
ホスト肝内の微小環境も,幹細胞の生着,増殖,分化に影響を与える重要な因子である.四塩化炭素傷害肝においてES細胞が効率的に肝細胞へ分化する現象は,障害肝におけるFGF1,FGF4,HGFなどのサイトカインの上昇と密接な関係があると考えられている22).また最近,小胞体ストレスに関連するとされるXBP1, GRP78が四塩化炭素肝傷害で上昇することが,骨髄細胞の生着に必要であるとのデータが報告されている35).
3.肝障害に伴う細胆管の増生(細胆管反応)-肝幹細胞の活性化?
種々の肝疾患や肝障害において,グリソン鞘周囲(ゾーン1)に胆管構造の異常な増加がおこる.この現象は,小葉間胆管と肝細胞の間を結ぶ細い管腔構造である細胆管に類似した胆管の増生であることから,細胆管反応と呼ばれている.細胆管反応はオーバル細胞増殖,定型的細胆管反応,非定型的細胆管反応に分類されている36).オーバル細胞については前述したが,これらは不完全な管腔構造を形成することがある.定型的細胆管反応は,明瞭な管腔をもつ比較的形のそろった細胆管の増加で,通常は急激な胆道閉鎖に伴って生ずる(図3C).一方,非定型的細胆管反応は不規則な形態を示す細胆管増生であり,多くは炎症と線維化を伴い,肝硬変,アルコール性肝障害,劇症肝炎などさまざな病態で認められる(図3D-F).
定型的細胆管反応は,既存の胆管上皮細胞の増生によることが証明されているが,非定型的細胆管反応の成因はまだ不明である.多くの研究者はこれをオーバル細胞増生と同様,障害により活性化した幹細胞の増生と考えている(図4).一方で,in vivoにおける明確な実験的証明は乏しいものの,病理学的な観察から,成熟肝細胞の胆管上皮化生(細胆管化生)の可能性も以前から指摘されてきた(図4).
細胆管反応はほとんど常に肝線維化を合併する.最近,非アルコール性脂肪(性)肝炎(non-alcoholic steatohepatitis,NASH)において,細胆管増生が線維化を誘導する可能性が示唆されている37).しかし,発生過程とのアナロジーからは,肝障害に伴う線維化が細胆管形成反応を誘導すると解釈することもできるように思われる.
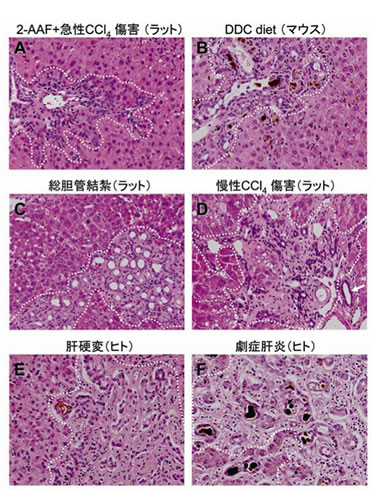
図3 肝障害における細胆管反応
グリソン鞘を中心とした領域(点線で囲んだ範囲)に細胆管反応が認められる.
A,B:オーバル細胞増殖.A(ラット)は2-acetylaminofluorene (2-AAF)と四塩化炭素の投与により(四塩化炭素投与後3日),B(マウス)は4週間の3,5-diethoxycarbonyl-1,4-dihydrocollidine (DDC)含有食により誘導した.小型で核/細胞質比の高い卵円形細胞がグリソン鞘周囲に増生している.C:定型的細胆管反応(ラット).総胆管結紮によるもので,規則正しく,管腔構造の明瞭な細胆管が増加している(結紮後7日).D:非定型的細胆管反応(ラット).四塩化炭素の反復投与(8週間).不規則な形状の細胆管が増加し,一部では肝細胞と移行的しているように見える.矢印は既存の小葉間胆管.E,F:ヒト肝疾患にみられる細胆管反応.Eは肝硬変,Fは劇症肝炎例で,いずれにも非定型的細胆管反応(いわゆる偽胆管)が認められる. (西川祐司,榎本克彦 [2007]:細胆管反応と細胆管化生,肝胆膵 55:73-81より,一部改変)
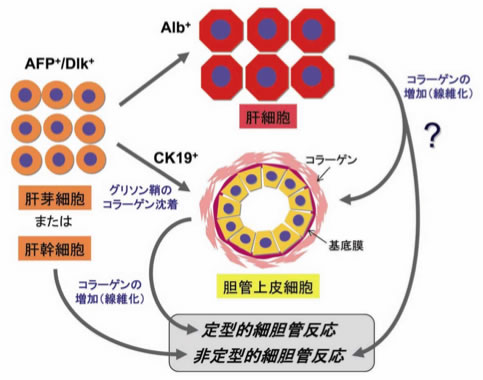
図4 細胆管反応のメカニズム
定型的細胆管反応は主として既存の胆管上皮の増生によることが証明されている.一方,非定型的細胆管反応やオーバル細胞増殖は,一般的に,成熟肝に少数存在する肝幹細胞(または肝芽細胞)の活性化および増殖によると考えられている.しかし,肝細胞形質は以前考えられていたほど固定されたものではなく,成熟肝細胞の胆管上皮化生の可能性も念頭に置き,この現象を再検討する必要があると思われる.
4.成熟肝細胞の可塑性-胆管上皮細胞への分化転換
肝細胞は最終分化すると,その分化形質は固定され,胆管上皮細胞を含めた他の細胞に分化することはないとみなされてきた.しかし我々は,本来,細胞外基質に乏しい独特の環境で分化形質を維持している肝細胞が,線維化に伴うコラーゲンの豊富な環境に置かれた場合に胆管上皮細胞方向に変化する可能性を考えた.この作業仮説を検証するために,我々はラット肝細胞凝集塊(スフェロイド)をI型コラーゲンゲル内に包埋する三次元培養系を考案した(図5A)38).肝細胞はEGF(またはHGF)とインスリンが存在する場合,樹枝状の細胞突起を伸ばし(図5B),長期間培養すると,基底膜を伴う管腔構造を形成する15).肝細胞は培養後,CK19などの胆管上皮マーカーを発現するが,AFPやDlkなどの肝幹細胞マーカーを発現せず,脱分化というよりは分化転換(細胆管化生)が生じていると推測される(図6).また我々は,発生期の幼若な胆管やオーバル細胞で特異的に発現する細胞間接着分子SgIGSF
(Necl-2) が,分化転換した肝細胞でも発現することを明らかにした39).また我々は最近,肝細胞の胆管上皮細胞への分化転換は,種々の肝疾患で上昇するTNF-αにより促進されることを見出し(図7),その細胞内メカニズムとしてJNK-c-Jun経路が関与していることを示唆している(Nishikawaら,投稿中).これらのデータは,肝細胞形質は固定したものではなく,特にコラーゲン基質の増加やTNF-αなどのサイトカインなどの微小環境の変化に応じ,可変的であることを示している.
成熟肝細胞による胆管上皮様の形質転換は,総胆管結紮後による肝傷害において,特に4-4’-diaminodiphenylmethane
(DAPM)による胆管傷害を加えた場合に,in vivoでも起こることが示唆されている16).また,ラット小型肝細胞18, 19)やマウス成熟肝細胞40)も培養により胆管上皮細胞の形質を発現することが報告されている.
マウス胎仔肝の間質には上皮-間葉転換(epithelial-to-mesenchymal transition,EMT)を示す細胞が存在し41),マウス肝幹細胞の一部は逆に間葉-上皮転換(mesenchymal-to-epithelial
transition,MET)を起こしうると推測されている12).さらに,成熟肝細胞がin vitroおよびin vivoにおいて線維芽細胞に変化することも報告されており42),肝構成細胞の上皮細胞間,上皮-間葉細胞間の可塑性とその病態生理学的意義について今後さらに検討していく必要がある.
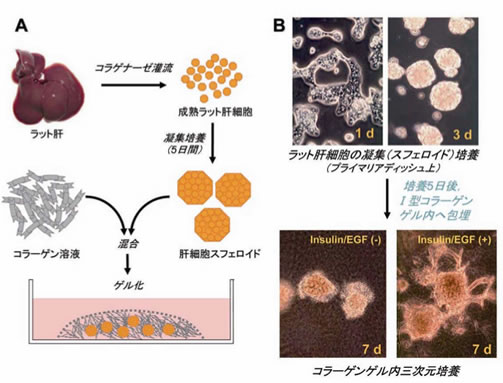
図5 成熟肝細胞スフェロイドのコラーゲンゲル内三次元培養
A:我々の培養モデルの模式図.成熟ラット肝から肝細胞を採取し,プライマリアディッシュ上で培養すると,数日後には凝集塊(スフェロイド)が形成される.B:位相差顕微鏡像.肝細胞は培養1日(1d)後にはディッシュに付着しているが,3日後には大部分がスフェロイド化する.これらをI型コラーゲンゲル内に包埋し,培養すると,EGF,インスリンが存在する場合に樹枝状の突起が進展する(7日後).これらの突起の一部は3週間以上培養することで,(細)胆管と類似した基底膜を伴う管腔構造を形成することが確認されている.(Bは文献15より,一部改変)
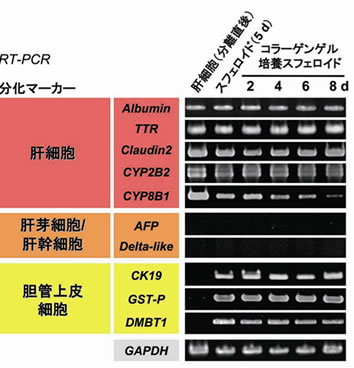
図6 培養肝細胞における胆管細胞マーカーの発現
成熟ラット肝細胞を培養すると,肝細胞の分化マーカーの一部の発現が低下する一方,サイトケラチン19 (CK19)などの胆管上皮細胞マーカーが発現するようになる.しかし,AFPやdelta-like(Dlk)などの肝芽細胞のマーカーは発現しない.この結果は,培養による肝細胞の胆管上皮細胞様分化は脱分化(dedifferentiation)ではなく形質転換(transdifferentiation)の可能性が高いことを示唆している.図中のdは培養日数を示している。(文献15より,一部改変)
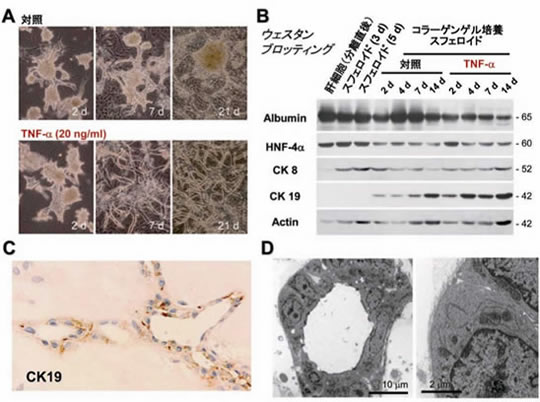 図7 TNF-αによる培養ラット肝細胞の胆管上皮化生の促進
図7 TNF-αによる培養ラット肝細胞の胆管上皮化生の促進
A:位相差顕微鏡像.TNF-αはコラーゲンゲル内での肝細胞の樹枝状形態形成を促進する.B:ウェスタンブロッティング.TNF-αは培養肝細胞のアルブミンの発現を抑制し,CK19の発現を亢進させる.C:CK19免疫染色.3週間以上培養すると,CK19陽性の胆管様管腔構造が形成される.D:電子顕微鏡像.管腔周囲には基底膜が観察される.図中のdは培養日数を示している。(Nishikawaら,未発表データ)
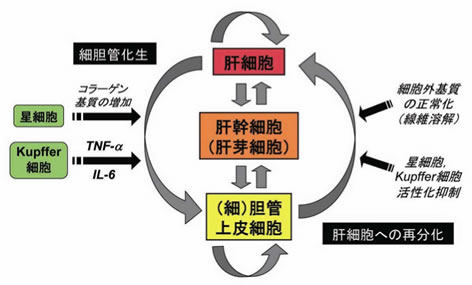
図8 肝細胞,胆管上皮細胞,肝幹細胞の相互関係(仮説)
傷害を受けた肝細胞と胆管上皮細胞(肝内胆管)はいずれも,成熟肝に少数存在する幹細胞から再生しうる.しかし,肝細胞はコラーゲン基質の増加やTNF-αなどのサイトカインの影響により,(細)胆管上皮に化生する可塑性を保持している.したがって,肝疾患の再生治療には,増殖能力の高い幹細胞の使用だけでなく,肝細胞や胆管上皮細胞の分化を維持するための微小環境の正常化も重要な課題となる.
5.おわりに
我々は現在,肝細胞,胆管上皮細胞,肝幹細胞の相互関連を図8のようにとらえ,これらの分化メカニズムの検討を進めている.肝障害を治療する上で,増殖能力の高い肝幹細胞を肝内で活性化させたり,肝外から導入するアプローチが重要であることは論をまたない.しかし,肝細胞形質の可塑性を念頭に置いた場合,肝細胞の分化状態を維持する,もしくは肝細胞に再分化させるための方策が重要であることも明らかである.このためには肝細胞の分化を規定する肝微小環境の正常化(特にクッパー細胞や星細胞の活性化の抑制)が欠かせない.また,門脈血中のLPSはクッパー細胞を活性化するだけでなく,TLR4を介して胆管上皮細胞からのIL6などのサイトカイン放出を促すことが報告されており43),肝を取り巻く複雑な環境を考慮に入れる必要がある.
肝幹細胞の研究はこれまで予想外の展開を繰り返してきたが,今後もしばらくその状況が続きそうである.最近,肝幹細胞に関する詳細で優れた総説が発表されているので,興味を持たれた方は参照していただきたい17, 44, 45).本拙稿が本年6月27日,28日に静岡市で開催される第15回肝細胞研究会でのシンポジウム「肝障害と幹細胞-肝修復における幹細胞の役割」での議論のたたき台となれば幸いである.
最後になりましたが,このような研究紹介の機会を与えてくださいました肝細胞研究会世話人代表 吉里勝利先生および第15回肝細胞研究会会長 塩尻信義先生に心より感謝いたします.なお,後半紹介した研究は,秋田大学医学部 病理病態医学講座 分子病態学分野(榎本克彦教授)の方々の協力を得て行ったものであり,SgIGSFの発現に関しては神戸大学大学院医学系研究科 外科病理学 伊藤彰彦先生他との共同研究です.
引用文献
- Shiojiri N (1997) Development and differentiation of bile ducts in the mammalian liver. Microsc Res Tech 39:328-335.
- Tanimizu N, Nishikawa M, Saito H et al (2003) Isolation of hepatoblasts based on the expression of Dlk/Pref-1. J Cell Sci 116:1775-1786.
- Fausto N, Campbell JS (2003) The role of hepatocytes and oval cells in liver regeneration and repopulation. Mech Dev 120:117-130.
- Jensen CH, Jauho EI, Santoni-Rugiu E et al (2004) Transit-amplifying ductular (oval) cells and their hepatocytic progeny are characterized by a novel and distinctive expression of delta-like protein/preadipocyte factor 1/fetal antigen 1. Am J Pathol 164:1347-1359.
- Tanimizu N, Tsujimura T, Takahide K et al (2004) Expression of Dlk/Pref-1 defines a subpopulation in the oval cell compartment of rat liver. Gene Expr Patterns 5:209-218.
- Jelnes P, Santoni-Rugiu E, Rasmussen M et al (2007) Remarkable heterogeneity displayed by oval cells in rat and mouse models of stem cell-mediated liver regeneration. Hepatology 45:1462-1470.
- Suzuki A, Zheng YW, Kaneko S et al (2002) Clonal identification and characterization of self-renewing pluripotent stem cells in the developing liver. J Cell Biol 156:173-184.
- Minguet S, Cortegano I, Gonzalo P et al (2003) A population of c-Kit(low)(CD45/TER119)- hepatic cell progenitors of 11-day postcoitus mouse embryo liver reconstitutes cell-depleted liver organoids. J Clin Invest 112:1152-1163.
- Nierhoff D, Levoci L, Schulte S et al (2007) New cell surface markers for murine fetal hepatic stem cells identified through high density complementary DNA microarrays. Hepatology 46:535-547.
- Oertel M, Menthena A, Chen YQ et al (2008) Purification of fetal liver stem/progenitor cells containing all the repopulation potential for normal adult rat liver. Gastroenterology 134:823-832.
- Schmelzer E, Zhang L, Bruce A et al (2007) Human hepatic stem cells from fetal and postnatal donors. J Exp Med 204:1973-1987.
- Dan YY, Riehle KJ, Lazaro C et al (2006) Isolation of multipotent progenitor cells from human fetal liver capable of differentiating into liver and mesenchymal lineages. Proc Natl Acad Sci U S A 103:9912-9917.
- Nowak G, Ericzon BG, Nava S et al (2005) Identification of expandable human hepatic progenitors which differentiate into mature hepatic cells in vivo. Gut 54:972-979.
- Overturf K, al-Dhalimy M, Ou CN et al (1997) Serial transplantation reveals the stem-cell-like regenerative potential of adult mouse hepatocytes. Am J Pathol 151:1273-1280.
- Nishikawa Y, Doi Y, Watanabe H et al (2005) Transdifferentiation of mature rat hepatocytes into bile duct-like cells in vitro. Am J Pathol 166:1077-1088.
- Michalopoulos GK, Barua L, Bowen WC (2005) Transdifferentiation of rat hepatocytes into biliary cells after bile duct ligation and toxic biliary injury. Hepatology 41:535-544.
- Oertel M, Shafritz DA (2008) Stem cells, cell transplantation and liver repopulation. Biochim Biophys Acta 1782:61-74.
- Mitaka T, Sato F, Mizuguchi T et al (1999) Reconstruction of hepatic organoid by rat small hepatocytes and hepatic nonparenchymal cells. Hepatology 29:111-125.
- Tateno C, Yoshizato K (1996) Growth and differentiation in culture of clonogenic hepatocytes that express both phenotypes of hepatocytes and biliary epithelial cells. Am J Pathol 149:1593-1605.
- Asahina K, Shiokawa M, Ueki T et al (2006) Multiplicative mononuclear small hepatocytes in adult rat liver: their isolation as a homogeneous population and localization to periportal zone. Biochem Biophys Res Commun 342:1160-1167.
- Yamamoto H, Quinn G, Asari A et al (2003) Differentiation of embryonic stem cells into hepatocytes: biological functions and therapeutic application. Hepatology 37:983-993.
- Teratani T, Yamamoto H, Aoyagi K et al (2005) Direct hepatic fate specification from mouse embryonic stem cells. Hepatology 41:836-846.
- Banas A, Teratani T, Yamamoto Y et al (2007) Adipose tissue-derived mesenchymal stem cells as a source of human hepatocytes. Hepatology 46:219-228.
- Oyagi S, Hirose M, Kojima M et al (2006) Therapeutic effect of transplanting HGF-treated bone marrow mesenchymal cells into CCl4-injured rats. J Hepatol 44:742-748.
- Sato Y, Araki H, Kato J et al (2005) Human mesenchymal stem cells xenografted directly to rat liver are differentiated into human hepatocytes without fusion. Blood 106:756-763.
- Campard D, Lysy PA, Najimi M et al (2008) Native umbilical cord matrix stem cells express hepatic markers and differentiate into hepatocyte-like cells. Gastroenterology 134:833-848.
- Terai S, Sakaida I, Yamamoto N et al (2003) An in vivo model for monitoring trans-differentiation of bone marrow cells into functional hepatocytes. J Biochem 134:551-558.
- Sakaida I, Terai S, Yamamoto N et al (2004) Transplantation of bone marrow cells reduces CCl4-induced liver fibrosis in mice. Hepatology 40:1304-1311.
- Petersen BE, Bowen WC, Patrene KD et al (1999) Bone marrow as a potential source of hepatic oval cells. Science 284:1168-1170.
- Wang X, Foster M, Al-Dhalimy M et al (2003) The origin and liver repopulating capacity of murine oval cells. Proc Natl Acad Sci U S A 100 Suppl 1:11881-11888.
- Thorgeirsson SS, Grisham JW (2006) Hematopoietic cells as hepatocyte stem cells: a critical review of the evidence. Hepatology 43:2-8.
- Kakinuma S, Asahina K, Okamura K et al (2007) Human cord blood cells transplanted into chronically damaged liver exhibit similar characteristics to functional hepatocytes. Transplant Proc 39:240-243.
- Yasui O, Miura N, Terada K et al (1997) Isolation of oval cells from Long-Evans Cinnamon rats and their transformation into hepatocytes in vivo in the rat liver. Hepatology 25:329-334.
- Oertel M, Menthena A, Dabeva MD et al (2006) Cell competition leads to a high level of normal liver reconstitution by transplanted fetal liver stem/progenitor cells. Gastroenterology 130:507-520; quiz 590.
- Marumoto Y, Terai S, Urata Y et al (2008) Continuous high expression of XBP1 and GRP78 is important for the survival of bone marrow cells in CCl4-treated cirrhotic liver. Biochem Biophys Res Commun 367:546-552.
- Alvaro D, Mancino MG, Glaser S et al (2007) Proliferating cholangiocytes: a neuroendocrine compartment in the diseased liver. Gastroenterology 132:415-431.
- Richardson MM, Jonsson JR, Powell EE et al (2007) Progressive fibrosis in nonalcoholic steatohepatitis: association with altered regeneration and a ductular reaction. Gastroenterology 133:80-90.
- Nishikawa Y, Tokusashi Y, Kadohama T et al (1996) Hepatocytic cells form bile duct-like structures within a three-dimensional collagen gel matrix. Exp Cell Res 223:357-371.
- Ito A, Nishikawa Y, Ohnuma K et al (2007) SgIGSF is a novel biliary-epithelial cell adhesion molecule mediating duct/ductule development. Hepatology 45:684-694.
- Fougere-Deschatrette C, Imaizumi-Scherrer T, Strick-Marchand H et al (2006) Plasticity of hepatic cell differentiation: bipotential adult mouse liver clonal cell lines competent to differentiate in vitro and in vivo. Stem Cells 24:2098-2109.
- Chagraoui J, Lepage-Noll A, Anjo A et al (2003) Fetal liver stroma consists of cells in epithelial-to-mesenchymal transition. Blood 101:2973-2982.
- Zeisberg M, Yang C, Martino M et al (2007) Fibroblasts derive from hepatocytes in liver fibrosis via epithelial to mesenchymal transition. J Biol Chem 282:23337-23347.
- Yokoyama T, Komori A, Nakamura M et al (2006) Human intrahepatic biliary epithelial cells function in innate immunity by producing IL-6 and IL-8 via the TLR4-NF-kappaB and -MAPK signaling pathways. Liver Int 26:467-476.
- Alison MR, Choong C, Lim S (2007) Application of liver stem cells for cell therapy. Semin Cell Dev Biol 18:819-826.
- Banas A, Yamamoto Y, Teratani T et al (2007) Stem cell plasticity: learning from hepatogenic differentiation strategies. Dev Dyn 236:3228-3241.










