研究交流
肝発生過程における肝中皮細胞の性状と役割
田中 稔
東京大学分子細胞生物学研究所・幹細胞制御研究分野
1. はじめに
肝臓を構成する細胞は?と聞かれると、まず実質細胞である肝細胞、線維化に関わる肝星細胞、肝常在マクロファージであるクッパー細胞などを思い浮かべるのではないだろうか。最近では、肝幹/前駆細胞の研究から胆管細胞なども注目されているが、中皮細胞という人はまずいないであろう。中皮(mesothelium)とは胸腔、心嚢、腹腔などの体腔表面を覆う膜様組織のことであり、中皮細胞はその最表面を被覆する単層細胞を指す。臓器の表面を覆う臓側中皮としては、心外膜(epicardium)の発生がよく研究されているが、肝臓の中皮はこれまでほとんど研究されていなかった。ここでは、我々が見出した肝臓の中皮に関する知見について、その研究の経緯とともに紹介したい。
2. 未分化肝中皮細胞のマーカー分子:PCLP1とDLK1
我々はこれまでにマウス胎仔肝臓の構成細胞に対するマーカー分子を同定し、その抗体を用いた細胞分離(セルソート)による性状解析を通じて、肝発生過程における細胞間相互作用を明らかにしてきた(宮島篤先生の稿参照)。このようなセルソーターを用いた細胞レベルでの解析手法は血液学の分野で先行しており、これに倣って、肝発生期の未分化な肝細胞(肝芽細胞)、星細胞、類洞内皮細胞、血液幹細胞を対象とした解析を行なってきたが(1-5)、我々も最初から中皮細胞に注目していた訳ではなかった。
以前、我々は血液細胞と血管内皮細胞の共通前駆細胞であるヘマンジオブラストの研究を行う過程で、成体型造血が発生する場として知られたAGM(大動脈-生殖隆起-中腎)領域からヘマンジオブラストの性質を有する細胞株としてLO細胞株を樹立し、その細胞に対する抗体を多数樹立していた。そのうちの一つにシアロムチンファミリーに属するPodocalyxin-like protein-1(PCLP1)と呼ばれる分子が含まれていた(6)。胎仔期の肝臓は造血器としても機能することから、胎仔肝にもヘマンジオブラストのような細胞がいるのではないかと考え、抗PCLP1抗体を用いて胎仔肝臓細胞のフローサイトメトリー(FCM)解析を行なったのが研究の始まりである。その結果、胎仔肝臓にPCLP1強陽性細胞が存在することが明らかとなったが、胎仔肝臓の免疫組織化学染色のパターンからPCLP1陽性細胞は期待していた細胞ではないことがすぐに分かった。図1Aに示すように、肝発生過程ではPCLP1を強く発現する細胞が肝原基の周囲をぐるりと囲んでいることが分かる。興味深いことに、その肝臓周囲での発現は出生後消失していき、成体の肝臓表面では全く発現しなくなっていた。このようにPCLP1は発生過程の中皮細胞では、その分化段階に応じて発現が制御されている分子であると考えられた。一方、我々は胎仔期の肝芽細胞マーカー分子としてDLK1を報告しているが(1)、胎仔期の肝臓にはDLK1強陽性細胞の他に弱陽性細胞が存在することに気付いていた(図1B)。この弱陽性細胞分画を分離して遺伝子発現解析を行なうと、アルブミンはほとんど検出されず、強いCytokeratin 19 (CK19)の発現が認められた。肝臓ではCK19は胆管上皮細胞のマーカーとしてよく知られる分子であったことから、当初DLK1弱陽性細胞は胆管上皮細胞へ分化しつつある肝芽細胞の集団であると考えた。しかし、in vitroで特徴的な扁平状の形態をとること、胎仔期の中皮細胞はCK19を強く発現していることなどが分かり(図1C,D)、未分化中皮細胞もDLK1を発現することが明らかとなっている(2)。
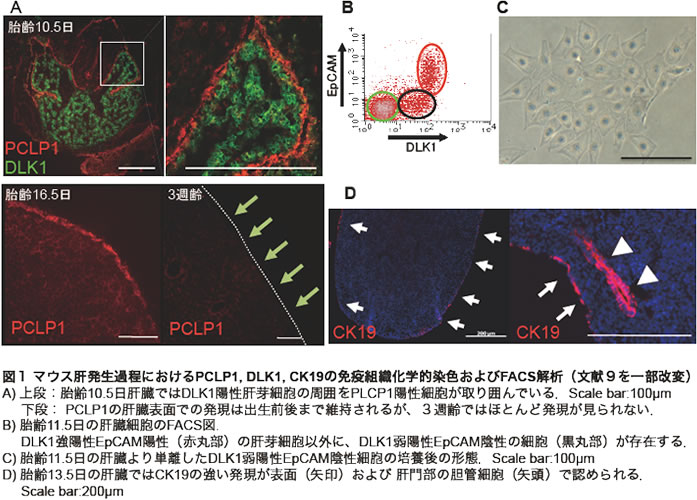
3. 肝発生過程における中皮細胞のMesothelinとPCLP1の発現様式
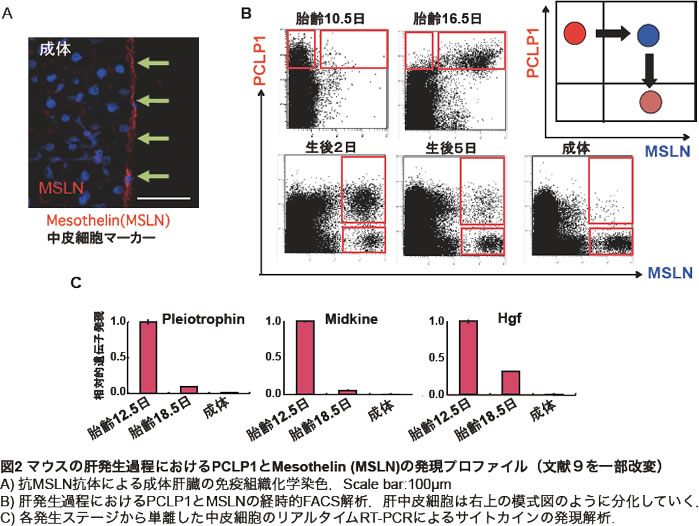
Mesothelin (MSLN)はその名が示す通り、中皮で発現する膜タンパク質であり、一般的な中皮細胞マーカーとして知られる(7)。この分子に対する抗体も前述したLO細胞に対する抗体群の中に含まれていたことから、肝発生過程における中皮細胞の性状解析を一気に進めることができた。実際にこの抗体を用いると成体肝臓表面の中皮細胞は染色された(図2A)。余談ではあるが、我々は卵巣がんの腫瘍マーカーとして知られるCA125/MUC16がMSLNと特異的に結合することを報告している(8)。これらの抗体を用いてPCLP1とMSLNの発現プロファイルを肝発生過程で調べた結果、肝中皮細胞は分化段階に応じて大きくその発現様式を変化させていることが明らかとなった(図2B)。これらの抗体を用いれば、最も未分化な肝中皮前駆細胞と分化を終えた成体の肝中皮細胞をそれぞれ純化することが可能である。我々はそれぞれの中皮細胞からRNAを調製し、マイクロアレイ解析を行なった結果、胎仔期の中皮細胞は実に多くのサイトカインを産生していることを見出した。その中でも、HGF、Pleiotrophin, Midkineといった肝細胞の増殖に関わるサイトカインが未分化中皮細胞によって産生されており、成体肝臓の分化した中皮細胞ではほとんど発現されていないことが明らかとなった(図2C)。特にPleiotrophinとMidkineはPCLP1陽性の未分化中皮細胞で強く発現していた。これら結果から、胎仔期の中皮細胞は肝臓の成長に貢献している可能性が考えられた。
4. 肝芽細胞に対する中皮細胞の役割
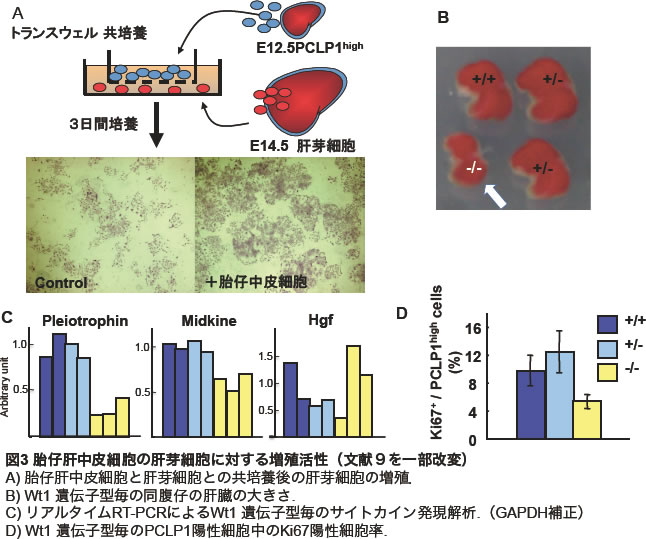
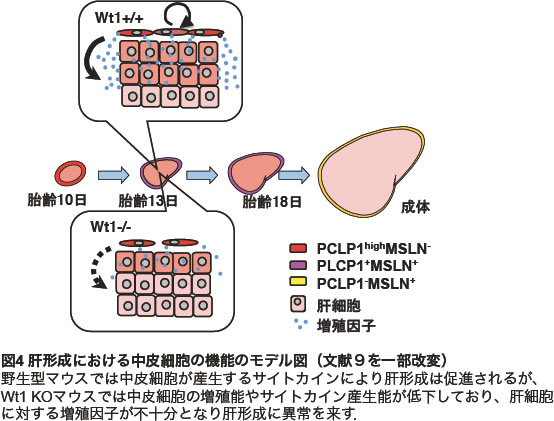
胎仔期の未分化中皮細胞が実際に肝芽細胞の増殖を支持しているのかを明らかにするために、中皮細胞と肝芽細胞の共培養系を構築した。その結果、中皮細胞が産生する液性因子が肝芽細胞の増殖に寄与することが示された(図3A)。一方、中皮の発生異常を示す遺伝子改変マウスとしてWilms tumor 1 homolog (Wt1)のKOマウスが知られており、胎仔期の肝臓では発育不全や分葉異常、造血能の低下が報告されていた。野生型マウスの肝臓から細胞を分散し、PCLP1やMSLNのマーカーを用いて中皮細胞とそれ以外の細胞に分離してみると、Wt1は主に中皮細胞で発現していた。実際に、野生型マウスとWt1 KOマウスの肝臓を比べてみると、KOマウスの肝臓は明らかに小さく、各遺伝子型のマウスから中皮細胞を単離して解析した結果、KOマウス由来の中皮細胞では増殖能が低下しているとともに、Pleiotrophinと Midkineの発現も低下していることが明らかとなった(図3B,C,D)。そのため、Wt1 KOマウスでは肝芽細胞に対する増殖因子の供給が不十分であり、肝臓の形成不全が引き起こされたものと結論づけた(図4)(9)。
5. おわりに
我々の研究から、胎仔期の肝中皮細胞は単なる保護膜としてだけではなく、積極的に臓器形成に寄与していることが明らかとなった。肝発生の制御メカニズムを細胞レベルで解明しようとしてきた我々が、中皮細胞という一見脇役的な細胞に偶然にも最後に行き着いたのは、ある意味必然だったのかもしれない。肝中皮に関しては、研究対象としてまだまだ明らかにするべき点が残っている。一つはその由来や分化能に関する点である。心外膜前駆細胞は心筋層内に潜り込み、間質線維芽細胞や冠動脈平滑筋細胞、外膜周囲線維芽細胞などに分化することが知られている(10-12)。朝比奈欣治先生らは発生過程の肝臓では中皮下細胞 (submesothelial cell)が肝臓内に潜り込み、肝星細胞や門脈域線維芽細胞に分化することを報告している(朝比奈先生の稿参照)(13) 。中皮下細胞もPCLP1陽性の中皮前駆細胞に由来する可能性が考えられる。我々はPCLP1陽性中皮前駆細胞の未分化性を維持しながらin vitroで無限に増殖させる培養法を構築していることから、今後、中皮前駆細胞の分化能についても検討したいと考えている。また、未分化中皮細胞によるサイトカインの供給は胎仔期に限ったことであるのか、成体肝臓の再生や疾患には寄与していないのか、肝臓以外の中皮細胞もサイトカインを産生し、同様に分化するのか、など興味は尽きない。さらに最近、中皮細胞や中皮下細胞が胎仔肝造血にも寄与していることが明らかとなって来ており、また機会をいただけるのであれば改めて紹介したい。このように、中皮を取りまく研究はまだまだ続きそうである。最後に、ここで紹介した研究成果は東大分生研、宮島篤教授の研究室で鬼塚和泉博士(現NIH)が中心となって得られたものです。
参考文献
- Tanimizu N, Nishikawa M, Saito H, Tsujimura T and Miyajiam A. Isolation of hepatoblasts based on the expression of Dlk/Pref-1. J Cell Sci. 116:1775-86. (2003)
- Tanaka M, Okabe M, Suzuki K, Kamiya Y, Tsukahara Y, Saito S and Miyajima A. Mouse hepatoblasts at distinct developmental stages are characterized by expression of EpCAM and DLK1: Drastic change of EpCAM expression during liver development. Mech. of Dev. 126:665-76. (2009)
- Suzuki K, Tanaka M, Watanabe N, Saito S, Nonaka H, and Miyajima A. p75 Neurotrophin receptor is a marker for precursors of stellate cells and portal fibroblasts in mouse fetal liver. Gastroenterology. 135:270-81. (2008)
- Nonaka H, Tanaka M, Suzuki K and Miyajima A. Development of murine hepatic sinusoidal endothelial cells characterized by the expression of hyaluronan receptors. Dev. Dyn. 236:2258-67. (2007)
- Sugano Y, Takeuchi M, Hirata A, Matsushita H, Kitamura T, Tanaka M and Miyajima A. Junctional adhesion molecule-1, JAM-A, is a novel cell-surface marker for long-term repopulating hematopoietic stem cells. Blood. 111:1167-72. (2008)
- Hara T, Nakano Y, Tanaka M, Tamura K, Sekiguchi T, Minehata K, Copeland NG, Jenkins NA, Okabe M, Kogo H, Mukouyama Y and Miyajima A. Identification of podocalyxin-like protein 1 as a novel cell surface marker for hemangioblasts in the murine aorta-gonad-mesonephros region. Immunity. 11:567-78. (1999)
- Chang K, Pastan I. Molecular cloning of mesothelin, a differentiation antigen present on mesothelium, mesotheliomas, and ovarian cancers. Proc. Natl. Acad. Sci. USA. 93:136-40. (1996)
- Rump A, Morikawa Y, Tanaka M, Minami S, Umesaki N, Takeuchi M and Miyajima A. Binding of ovarian cancer antigen CA125/MUC16 to mesothelin mediates cell adhesion. J Biol Chem. 279:9190-8. (2004)
- Onitsuka I, Tanaka M and Miyajima A. Characterization and functional analyses of hepatic mesothelial cells in mouse liver development. Gastroenterology.138:1525-35. (2010)
- Dettman RW, Denetclaw W Jr, Ordahl CP and Bristow J. Common epicardial origin of coronary vascular smooth muscle, perivascular fibroblasts, and intermyocardial fibroblasts in the avian heart. Dev Biol. 193:169-81. (1998)
- Cai CL, Martin JC, Sun Y, Cui L, Wang L, Ouyang K, Yang L, Bu L, Liang X, Zhang X, Stallcup WB, Denton CP, McCulloch A, Chen J and Evans SM. A myocardial lineage derives from Tbx18 epicardial cells. Nature. 454:104-8. (2008)
- Zhou B, Ma Q, Rajagopal S, Wu SM, Domian I, Rivera-Feliciano J, Jiang D, von Gise A, Ikeda S, Chien KR and Pu WT. Epicardial progenitors contribute to the cardiomyocyte lineage in the developing heart. Nature. 454:109-13. (2008)
- Asahina K, Tsai SY, Li P, Ishii M, Maxson RE Jr, Sucov HM and Tsukamoto H. Mesenchymal origin of hepatic stellate cells, submesothelial cells, and perivascular mesenchymal cells during mouse liver development. Hepatology. 49:998-1011. (2009)










