ホットトピックス
肝臓/膵臓におけるStreaming Theoryのゆくえ
川口義弥
京都大学iPS細胞研究所 臨床応用研究部門 臓器形成誘導分野
はじめに
成体臓器の中に臓器特異的幹・前駆細胞が存在して、一定の速度で分化細胞を供給しつつ組織構築を維持する事によってorgan homeostasisが図られる事は、腸管や皮膚などで証明されている。では、肝臓や膵臓はどうだろう? 1980年代には、Zajicekらが放射性ラベルしたチミジンを取り込んだ細胞を追跡する実験手法を用いて、肝細胞が門脈周囲から中心静脈方向へと移動している事を示し、いわゆる”streaming theory”が提唱された1。その後、そうした細胞の置き換わりに対する疑問が生じ、論争の的となっていた。最近のinducible Creを用いたgenetic lineage tracing手法から多くの情報がられる中、我々が再度”streaming theory”を支持する結果を発表したのを契機に、この論争に再度火がついた様相を呈している。現時点での私見を述べさせて頂き、会員諸氏の批評を請う。
genetic lineage tracingの原理
Zajicekらのstreaming theory(1985年)は魅力的な説とされたが、様々な議論の末、1994年にBraletらがレトロウイルスを使って肝細胞にbeta-galactosidase遺伝子を導入して運命追跡を行う実験で再現されず、疑問が呈される事になる2。現在の主流になっている手法はinducible Cre/loxPを用いたgenetic lineage tracingである。図1に示す通り、細胞系譜解析(lineage tracing)の原理は「注目した(“目印をつけた”)細胞種が、いくら細胞分裂を繰り返しても、どのように細胞の性質が変わろうとも(分化しようとも)、その子孫にあたる細胞を同定する」という事であり、これによって目的細胞の運命追跡が可能となる。ここでは、一度付けた“目印”が消えないことが重要であり、この目的達成には細胞分裂の際に忠実に複製されるgenomic DNAに目印を付ける事が一番確実であり、genetic lineage tracingと呼ぶ。Cre recombinaseは特異的塩基配列(2つのloxP 配列)を認識してDNA組み換えを起こす酵素であり、2種類のマウス(細胞種特異的Cre発現マウスと2つのloxP配列を備えたレポーターマウス)を準備し、交配によってその両方を持つ個体を得る事によってin vivoで細胞の運命追跡(系譜解析)が可能となる。この原理を用いて成体臓器維持機構の解明を行う場合、Cre蛋白と変異型Estrogen受容体融合蛋白(CreER, CreERTM, CreERTIIなど)を用いてタモキシフェン誘導性にCre recombinase活性を導く方法が有用であり、臓器の幹細胞候補を標識して成熟細胞へと分化するかどうかを直接解析する事ができる(図2)。
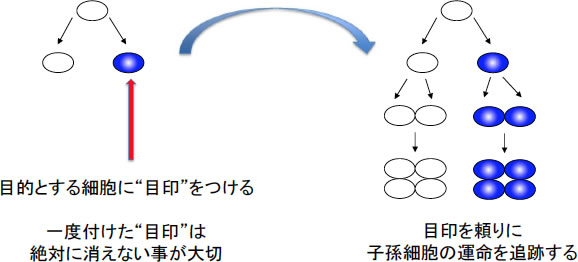
図1:Lineage tracing(細胞系譜解析法)の原理
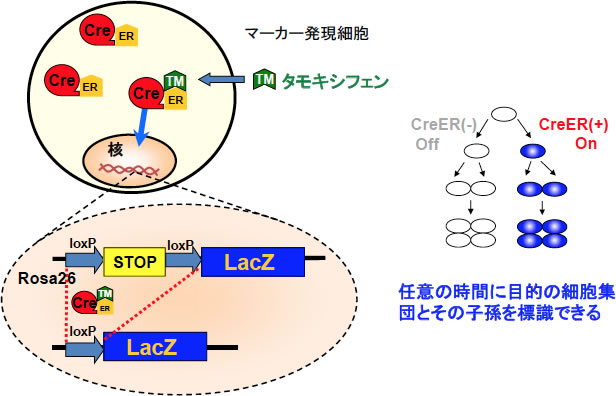
図2:タモキシフェン誘導性Creによる細胞系譜解析法
Sox9-IRES-CreERT2ノックインマウスでみられたCell Streaming
我々は成体臓器幹・前駆細胞の同定に向けて、個々の臓器の各論としてではなく、「幹細胞に共通した特性を担うシステム」に着目し、多くの臓器形成時に細胞を未分化状態に保つ働きをもつ転写因子SRY-box 9 (Sox9) を候補とした。その結果、成体臓器では樹状にひろがる胆管/膵管、肝外胆管から十二指腸Vater乳頭を経て腸管陰窩に到る一連の構造がSox9発現領域を形成しており、Sox9-IRES-CreERT2ノックインマウスを作成してgenetic lineage tracingを行ったところ、腸管、肝臓、膵外分泌組織においてSox9発現領域からの持続的な細胞供給がなされている事が観察され3、これらの臓器では、陰窩、胆管、膵管から細胞が”streaming”して維持されていると考えられた。
Streaming?or Not streaming?
最近の胆管および膵管上皮細胞を対象としたgenetic lineage tracingの報告一覧をご覧頂きたい(表1、2)。大雑把に言うと胎生期膵管細胞は内分泌/外分泌細胞に分化可能であるが、一定の時期までに分化能力を喪失するという報告が多く、胆管細胞の肝細胞分化能力に関してはperiportal領域の極一部の肝細胞にしか分化しないという報告が多い。特にSox9陽性細胞を対象とした2種類のCreマウスのlineage tracingの報告の矛盾が大きな議論を引き起こしている3-5。
Inducible Cre/loxPによるgenetic lineage tracingを用いた実験結果が異なる場合には、2つの原因が考えられる。第一に、もともと“目印をつけた細胞集団の違い”が結果の違いに至る事は明白である。そもそも、“胆管/膵管上皮細胞”が均一な細胞集団である保証は全くなく、それぞれのマーカー発現細胞を標的としたCre誘導の結果が同じである根拠はない。さらに同一マーカーを標的とした場合においても、Cre発現誘導方法の違いによっては結果が異なる可能性があり、論理的にはノックインによる方法が最も正確なCre発現誘導を可能にする系であると考えられる。もう一つの原因は、“目印を付けた細胞の性質の違い“である。Cre発現誘導の為に加えた遺伝子改変の為に細胞の性質が変化する可能性がある。具体的には、Creトランスジーン挿入部位近傍の遺伝子機能が変化する事や、Creノックインの為に遺伝子発現量が変化する事が潜在的原因となり得る。
2種類のSox9-Creマウスを用いたlineage tracingの結果を詳しく見てみると、胎生期から出生直後までの膵臓細胞の挙動は同じであるが、成体における胆管/膵管細胞の分化能力に大きな違いがある。Sox9-IRES-CreERT2ノックインマウスでは胆管細胞は肝細胞に分化し、門脈周囲から中心静脈方向へstreamingしているが3、BAC-Sox9-CreERT2トランスジェニックマウスでは、門脈周囲の肝細胞にしか分化せず、明らかなstreamingは観察されない4。膵臓においてはSox9-IRES-CreERT2ノックインマウスは膵管細胞が腺房細胞へと分化していたが3、BAC-Sox9-CreERT2トランスジェニックマウスでは分化していなかった5。
この2つの実験結果の矛盾を上記2つの観点から考察すると、CreER蛋白の発現誘導には論理的にはノックインが勝るが、我々のマウスはIRESを介したノックインを行ったにもかかわらず、Sox9発現量が少なくなっている可能性を考えた。予備的実験の結果、Sox9-IRES-CreERT2ノックインマウス肝臓、膵臓におけるSox9発現量が成体において低下している事、出生直後はワイルドタイプマウスとほぼ同等である事が分かって来た。さらに、成体Sox9-IRES-CreERT2ノックインマウスではPHH3陽性細胞が著増しており、cell turnoverが早まっている事も観察された。
| マーカー遺伝子 | Cre導入法 | 報告者の主張 | 報告 | |||
|---|---|---|---|---|---|---|
| 成体期の分化能 | 胎生期の分化能 | |||||
| 外分泌細胞 | 内分泌細胞 | 外分泌細胞 | 内分泌細胞 | |||
| Sox9 | IRES-K.I. | 〇 | X | 〇 | 〇 (~P7) |
Furuyama, 2011 |
| Sox9 | BAC Tg. | X | X | 〇 (~P5) |
〇 (~P5) |
Kopp, 2011 |
| Hes1 | K.I. | X | X | 〇 (~E15.5) |
〇 (~E13.5) |
Kopinke, 2011 |
| Hnf1β | BAC Tg. | X | X | 〇 (~E13.5) |
〇 (~E16.5) |
Solar, 2009 |
| CAⅡ | ヒトプロモーターを用いたTg. | 〇 | 〇 | N/D | N/D | Inada, 2008 |
| CK19 | K.I. | X (<1%) |
X (<1%) |
N/D | N/D | Means, 2008 |
表2:胆管細胞をターゲットとしたlineage tracing
| マーカー遺伝子 | Cre導入法 | 報告者の主張 | 報告 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 成体期の肝細胞分化 | 胎生期の肝細胞分化 | |||||||||
| 生理的条件 | 障害後再生条件 | |||||||||
| DDC | BDL | CCl4 | コリン欠乏食 | 肝切除 | アセトアミノフェン | |||||
| Sox9 | IRES-K.I. | 〇 | △ (少数) |
〇 | 〇 (急性障害) |
〇 (MCDE) |
△ (少数) |
△ (少数) |
〇 | Furuyama, 2011 |
| Sox9 | BAC Tg. | 〇(periportal) | △ -0.92% |
N/D | N/D | N/D | N/D | N/D | N/D | Dorrell, 2011 |
| Sox9 | BAC Tg. | N/D | ? (oval cellへ分化) |
N/D | N/D | ?(CDE) (oval cellへ分化) |
N/D | N/D | 〇(periportal) | Carpentier, 2011 |
| Hes1 | K.I. | N/D | N/D | N/D | N/D | N/D | N/D | N/D | X | Kopinke, 2011 |
| CK19 | K.I. | X (観察1週間) |
N/D | N/D | N/D | N/D | N/D | N/D | N/D | Means, 2008 |
おわりに
ある一つの仮説が生まれ、それが否定されるのはScienceの常である。ある時点で真実と考えられていた事が、実験手法の進歩に連れて新たな事実が示され、どうやら違うらしいと考えられ、より真実へと近づこうという営み全てがScienceといえる。しかしながら、一つの現象を取り上げて、「それはあり得ない。起こりえない」と言い切る事は極めて困難であり、本トピックに関する私の現時点の結論も「まだ、分からない。」というのが本音である。Sox9発現量そのものによる細胞挙動の変化は極めて注目すべきポイントであり、今後も研究を積み重ねてゆきたい。
文献
- Zajicek, G. et al. : The streaming liver. Liver, 6, 293-300, 1985
- Bralet, M. P. et al. : Cell lineage study in the liver using retroviral mediated gene transfer. Evidence against the streaming of hepatocytes in normal liver. Am J Pathol, 144, 896-905, 1994
- Furuyama, K. et al. : Continuous cell supply from a Sox9-expressing progenitor zone in adult liver, exocrine pancreas and intestine. Nat Genet, 43, 34-41, 2011
- Dorrell, C. et al. Prospective isolation of a bipotential clonogenic liver progenitor cell in adult mice. Genes Dev, 25, 1193-203, 2011
- Kopp, J. L. et al. : Sox9+ ductal cells are mulipotent progenitors throughout development but do not produce new endocrine cells in the normal or injured adult pancreas. Development, 138, 653-65, 2011










