研究交流
細胞膜抗原の発現を指標とした肝構成細胞の分離と肝発生機構の解析
宮島 篤
東京大学分子細胞生物学研究所
はじめに
肝臓は代謝、解毒、胆汁産生、血清タンパク質産生など様々な機能を担う生命活動の維持に必須の臓器であるが、胎児期には主要な造血組織であり、出生前後で劇的な機能的変貌を遂げる。肝臓は巨大な臓器であるが、血液を除けば、肝臓を構成する細胞種は肝細胞、胆管上皮細胞、肝類洞内皮細胞、肝星細胞、線維芽細胞など比較的少ない。しかし、肝臓研究では依然として実質細胞と非実質細胞という表現が使われているように、個々の細胞の性状は必ずしも十分に解明されてはいない。すでに300以上の細胞膜抗原が同定され、それらに対するモノクローナル抗体を使って細胞の同定・分離が日常的に行われている血液・免疫学とは対照的である。血液学においては、1960年代に始まったコロニー形成法により血液前駆細胞が詳細に解析されてきた。さらに、放射線照射したマウスへの移植により幹細胞活性の測定が可能となった。こうしたアッセイ系に加えて、細胞膜抗原の発現を指標にセルソーターで細胞を同定・分離する技術の進歩により、造血幹細胞から分化した血球に至る細胞系譜が詳細に解析されている。われわれは、肝臓の分子細胞生物学においても、肝臓構成細胞を細胞膜抗原の発現により厳密に識別・分離して性状を解析することが重要であると考えて、肝臓細胞の分離と初代培養系の開発を手がけてきた。以下、肝臓の構成細胞の分離と培養により明らかになった肝分化機構について概要を述べる。
肝幹細胞
肝幹細胞は肝臓の上皮系細胞である肝細胞と胆管上皮細胞に分化する能力をもった増殖性の細胞と考えられている。胎児期の肝幹細胞とみなされている肝芽細胞は前腸上皮細胞から心臓由来のFGFおよび横中隔間充織由来のBMPの作用により発生して、内皮細胞の助けを借りて増殖し肝芽を形成する(1)。肝芽が形成されると、そこに造血幹細胞が流入し造血を行う。我々は、初期の肝芽に発現する細胞膜タンパク質としてdelta-like 1 homolog (DLK1)を同定した(2)。DLK1はEGFリピートを持つ細胞膜タンパク質でノックアウトマウスでも肝臓は形成されることから肝臓における機能は依然として不明である。DLK1はマウスの胎齢9.5日の肝臓に強く発現しており、肝臓での発現は分化に伴い減少し出生後には検出されない。モノクローナル抗体を用いて分離したDLK1陽性細胞にはin vitroで高い増殖と肝細胞と胆管上皮細胞への分化能を併せ持つ細胞が含まれており、継代培養可能な幹細胞様の細胞株を樹立することも可能である(図1)(3)。
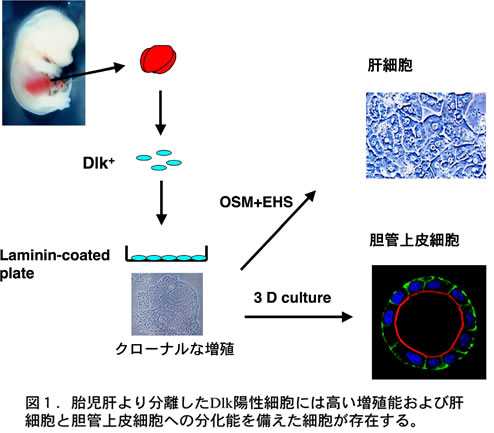
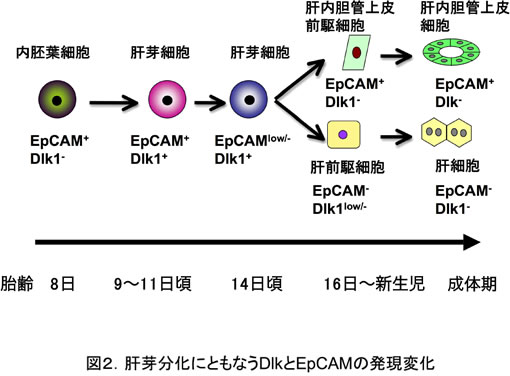
最近、我々はEpCAMが発生直後の肝芽細胞に発現しており、発生が進むに連れてその発現が激減し、胆管になると再び発現することを見いだした。すなわち、肝芽細胞はEpCAM陽性DLK1陽性細胞からEpCAM陰性DLK1陽性細胞を経て、EpCAM陰性DLK1陰性の肝細胞とEpCAM陽性DLK1陰性の胆管上皮細胞へと分化する(4)。一方、成体肝臓の胆管はEpCAMを発現しており、EpCAM陽性細胞集団には幹細胞活性を示す細胞が存在することが明らかになった(図2)(5)。また、成体肝臓において障害によりオーバル細胞とも呼ばれる幹細胞様の細胞が出現することが知られている。マウスに3,5-diethoxycarbonyl-1,4-dihydro-collidine (DDC)を投与してオーバル細胞を誘導するとEpCAM陽性細胞が門脈域に劇的に増幅するが、幹細胞活性はそれほど増えないことから大部分のオーバル細胞は幹細胞ではなく一過性に増殖する前駆細胞であると考えられる(5)。
肝細胞分化
IL-6ファミリーのサイトカイン受容体の共通サブユニットであるgp130を欠損したマウスの肝臓はtyrosine aminotransferase (TAT)の発現やグリコーゲンの蓄積が認められないなど機能的には未成熟であることから、IL-6ファミリーサイトカインの機能が肝臓の分化成熟には重要である。我々は、胎児肝臓の初代培養系にIL-6ファミリーのOncostatin M (OSM)を加えると肝分化が強く誘導されることを見いだした(6)。これにより胎児期の未分化肝細胞をTAT, glucose-6-phosphatase (G6Pase)などを発現する出生時期の肝細胞へと分化を誘導することが可能となった。さらに、この培養系にEHSゲルを添加することでtryptophan oxygenase (TO)などを発現する成体肝細胞へと分化誘導することが可能となった(7)。この分化誘導系を使って、肝細胞分化の分子機構の解析が可能となり、STAT3がTATなどの肝酵素の発現促進やD1 cyclinの発現抑制、K-Rasによる細胞接着構造の形成など細胞内シグナル分子の機能解析が進んだ(8, 9, 10)。
また、肝細胞は出生前後で様々な代謝酵素の発現が劇的に誘導される。この過程には転写因子C/EBPαが必須であり、その欠損マウスは出生直後に低血糖と高アンモニア血症を示して死亡する。C/EBPαは胎生肝臓からすでに発現しており、この転写因子の発現制御だけでは出生時における劇的な遺伝子発現誘導は説明できない。我々は、糖新生に必須のphosphoenolpyruvate carboxykinase (PEPCK)などの発現には、C/EBPαとともにFoxo1が協調的に作用することを明らかにした。Foxo1は出生直前に発現が誘導されること、さらにFoxo1はinsulinシグナルにより負に制御されること、insulinレベルも出生時に劇的に減少することから、Foxo1がC/EBPαとともに出生時における糖新生を制御する様子が明らかになった(11)。
アンモニアの除去も肝臓の主要な機能であり、アンモニア除去に必須の酵素であるcarbamoyl phosphate synthetase 1 (CPS1)は尿素サイクルの最初のステップを触媒する。このCPS1の発現もC/EBPαを必要としているが、胎児期の肝細胞には発現が認められない。我々は、胎児期の肝細胞に発現する遺伝子の探索から、肝細胞がんに発現する多機能性転写因子Y-box binding protein-1 (YB-1)が胎生肝細胞に強く発現しており、発生とともに発現が低下することを見いだした。YB-1はCPS1プロモーターに結合してC/EBPαによる転写を負に制御すること、さらにYB-1の発現は成体肝臓では抑制されているが、高アンモニア血症を伴う肝障害により誘導されたことから、YB-1がCPS1の発現を介してアンモニア除去に重要な役割を果たしていることが示された(12)。
胆管への分化
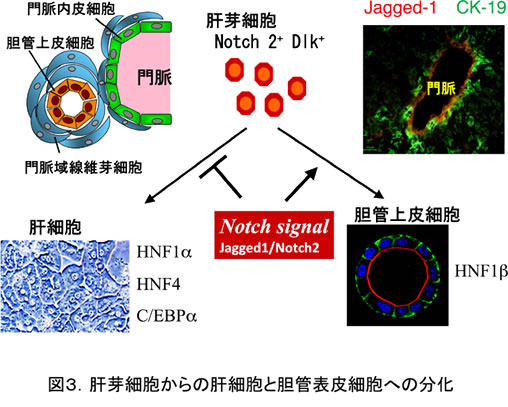
肝芽細胞は増殖して肝細胞と胆管上皮細胞へと分化するが、胆管は門脈周囲にのみ形成される。遺伝性のAlagille syndromeは肝内胆管の形成不全を伴い、その原因遺伝子がJagged1 であることから、胆管形成へのNotchシグナルの関与が示唆されていた。肝芽細胞にはNotch2が発現しており、Jagged1は門脈周囲に発現すること、分離したDLK1陽性細胞にNotchの活性化型であるNotch細胞内ドメインを強制発現すると胆管分化が促進され肝細胞分化が抑制された(13)。一方、門脈域のJagged1 陽性細胞はp75 neurotrophin receptor (p75NTR)陽性の間葉系細胞であることも明らかとなった(14)。従って、Notch2を発現するDLK1陽性の肝芽細胞がJagged1を発現する門脈域の線維芽細胞の作用により、肝細胞への分化が抑制されて胆管上皮への分化が誘導されると考えられる(図3)。
類洞壁細胞
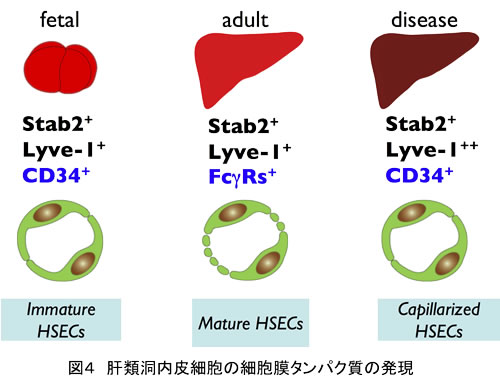
肝類洞壁を構成する内皮細胞は基底膜をもたず有窓構造(fenestrae)を有するユニークな内皮細胞であり、遺伝子発現のプロファイルも他の内皮細胞とは異なる。この細胞には、ヒアルロン酸受容体であるlymphatic vessel endothelial hyaluronan receptor-1 (Lyve-1)とStabilin-2 (Stab2)が発現するが、胎齢9.5日の肝芽でもすでにこれらの発現が認められる。胎齢14日の肝類洞内皮細胞はCD34陽性FcγR陰性であるが、成体ではCD34陰性FcγR陽性となる。肝類洞内皮細胞はリンパ管や血管内皮細胞などに比べて強いendocytosis活性を有する(15)。
一方、成体肝臓の類洞内皮細胞は線維化、肝硬変などの病変時においては基底膜が形成され、fenestraeを有しない毛細血管へと変化することが知られている。Dimethylnitrosamine (DMN)を投与した肝臓では、Stab2の発現量に変化は認められないものの、CD34およびLyve-1の発現は顕著に亢進する。このように、肝類洞内皮細胞は発生ステージや病態により、その表現型が大きく変化する。このように、新たに同定されたマーカーの発現を指標にすることで、発生および病変時における肝特異的内皮細胞の形質発現の変化の解析が可能となった(図4)(15)。
肝星細胞は肝類洞内皮細胞と肝細胞との間に存在する間葉系細胞であり、ビタミンA貯蔵細胞としても知られている。肝臓の線維化とともに肝星細胞は形質転換して線維芽細胞様の形態を呈し、コラーゲンなど細胞外マトリクスの産生を行う。肝臓の線維化が進むと、本来基底膜を有しない類洞に基底膜様構造物が出現し、類洞の毛細血管化が起こる。これにより肝細胞と類洞の間に線維が蓄積し、類洞の血流と肝細胞との間の物質交換が著しく障害される。類洞の血流を左右する肝星細胞は、肝臓の命運を握っている重要な細胞である。しかし、この細胞の起源や肝類洞内皮細胞とともに類洞を形成するプロセスに関する研究は少ない。
NGFの低親和性受容体であるp75NTRが肝星細胞に発現しており、その抗体を使ってマウス胎児から肝星細胞の前駆細胞を同定分離することが可能となった。胎齢14日の肝臓から分離したp75NTR陽性細胞はvimentinやdesminなどの間葉系細胞に特有の遺伝子を発現しており、そのうち10%程度が油滴を溜めていること、さらに分離した細胞を培養すると成体肝臓の星細胞が発現するglial fibrillary acidic protein (GFAP)を発現することから、胎齢14日のp75NTR陽性細胞は肝星細胞の前駆細胞であることが強く示唆された。
さらにp75NTRの発現は胎齢10日ですでに認められ、胎齢12日では肝臓全体に分布し、胎齢14日では実質域と門脈域に発現する。門脈周辺の線維芽細胞は細胞外マトリクス産生を行うことで肝線維化を引き起こしたり、胆管の障害からの再生を促進したりすると考えられている。この間葉系細胞もp75NTRを発現しており、肝星細胞と起源を同じにする可能性が示唆された。さらに、この門脈域のp75NTR陽性細胞はJagged1を発現しており、上記の胆管形成を誘導すると考えられる。一方、実質域のp75NTR陽性細胞は胎齢10日ですでに肝類洞内皮細胞と接しており、この時期にすでに類洞形成が始まっていることが示唆された(14)。
肝中皮細胞
中皮組織は臓器表面の保護、腹腔液の調節、物質の輸送、免疫的監視などに関わると考えられているが、その詳細は十分に理解されていない。我々は胎児肝臓の中皮細胞にシアロムチンのpodocalyxin-like protein 1 (PCLP1)が強く発現しており、その発現が発生に伴い減少し、成体肝臓の中皮には発現が消失することを見いだした。一方、中皮細胞マーカーとして知られているMesothelinは胎児期には発現が見られず、分化とともに発現が増強する。これらの発現を指標に分化段階の異なる中皮細胞を分離することが可能であり、これにより中皮細胞は単なる臓器表面を覆うシートではなく、様々な因子を分泌して、胎生期から新生児の肝細胞の増殖にも積極的に関与することが明らかとなった(投稿中)。
まとめ
以上、細胞膜抗原の同定とそれらに対するモノクローナル抗体を利用した細胞の分離・同定法から明らかとなった、肝発生における肝臓構成細胞の性状変化を概説した。詳細は以下の文献を参照されたい。現時点ではまだ細胞種の性状の記述が中心ではあるが、今後は細胞膜抗原の発現による肝臓の構成細胞種あるいは分化段階の異なる細胞を同定・分離する方法を、様々な遺伝子改変マウスの解析に取り入れることで、肝臓の発生・分化・再生の分子機構の解析を進めたいと考えている。
なお、本稿は厚生労働省「次世代医療機器評価指標作製事業の再生医療」の報告書および最新医学64卷に発表した総説を改編したものである。
文献
- Zaret K. and Grompe M. Generation and regeneration of cells of the liver and pancreas. Science 322, 1490-1494, 2008.
- Tanimizu N., Nishikawa M., Saito H., Tsujimura T. and Miyajima A. Isolation of hepatoblasts based on the expression of Dlk/Pref-1. J.Cell Sci. 116, 1775-1786, 2003.
- Tanimizu N., Saito H., Mostove K. and Miyajima A. Long-term culture of hepatic progenitors derived from mouse Dlk+ hepatoblasts. J. Cell Sci. 117, 6425-6434, 2004.
- Tanaka M., Okabe M., Suzuki K., Kamiya Y., Tsukahara Y., Saito S. and Miyajima A. Mouse hepatoblasts at distinct developmental stages are characterized by expression of EpCAM and DLK1: drastic change of EpCAM expression during liver development. Mech. Dev. in press.
- Okabe M., Tsukahara Y., Tanaka M., Suzuki K., Saito S., Kamiya Y., Tsujimura T., Nakamura K. and Miyajima A. Potential hepatic stem cells reside in EpCAM+ cells of normal and injured mouse livers. Development 136, 1951-1960, 2009.
- Kamiya A., Kinoshita T., Ito Y., Morikawa Y., Senba E., Nakashima K., Taga T., Yoshida K., Kishimoto T. and Miyajima A. Fetal liver development requires a paracrine action of oncostatin M through gp130. EMBO J. 18, 2127-2136, 1999.
- Kamiya A., Kojima N., Kinoshita T., Sakai Y. and Miyajima A. Maturation of fetal hepatocytes in vitro by extracellular matrices and Oncostatin M; Induction of tryptophan oxygenase. Hepatology35, 1351-1359, 2002.
- Ito Y., Matsui T., Kamiya A., Kinoshita T. and Miyajima A. Retroviral gene transfer of signaling molecules into murine fetal hepatocytes defines distinct roles for the STAT3 and Ras pathways during hepatic development. Hepatology 32,1370-1376, 2000
- Matsui T., Kinoshita T., Hirano T., Yokota T. and Miyajima A. STAT3 down-regulates the expression of cyclin D during liver development. J. Biol.Chem. 277, 36167-36173, 2002.
- Matsui T., Kinoshita T., Morikawa Y., Tohya K., Katsuki M., Ito Y., Kamiya A. and Miyajima A. K-Ras mediates cytokine-induced formation of E-cadherin-based adherens junctions during liver development. EMBO J. 21, 1021-1030, 2002.
- Sekine K., Kojima N., Chen Y-R., Fukamizu A. and Miyajima A. Foxo1 links insulin signaling to C/EBPα and regulates gluconeogenesis during liver development. EMBO J. 26, 3607-3615, 2007.
- Chen Y-R., Sekine Ke., Nakamura K., Yanai H., Tanaka M. and Miyajima A. YB-1 downregulates expression of carbamoyl phosphate synthetase 1 by suppressing C/EBPα function, leading to hyperammonemia. Gastroenterology 137, 330-340, 2009.
- Tanimizu N. and Miyajima A. Notch signaling controls hepatoblast differentiation by altering the expression of liver-enriched transcription factors. J.Cell Sci. 117, 3165-3173, 2004.
- Suzuki K., Tanaka M.,Watanabe N., Saito S., Nonaka H. and Miyajima A. The p75 neurotrophin receptor marks precursors of hepatic stellate cells and portal fibroblasts in mouse fetal liver. Gastroenterology 135, 270-281, 2008.
- Nonaka H., Tanaka M., Suzuki K. and Miyajima A. Development of murine hepatic sinusoidal endothelial cells characterized by the expression of hyaluronan receptors. Dev. Dyn. 236, 2258-2267, 2007.










