Master's Perspective
肝臓の分子細胞生物学
東京大学定量生命科学研究所
特任教授 宮島篤
はじめに
肝臓学の講義など聞いたこともない私が肝臓の研究を始めて早くも30年余りになりますが、肝細胞研究会は第5回から欠かさず参加しており大変お世話になりました。この度、代表世話人の三高先生より執筆依頼がありましたので、私の肝臓研究の経緯などまとめてみました。
肝臓研究を始めた経緯
私は1982年に米国DNAX研究所*註に参加して、造血系サイトカインの受容体やシグナル伝達系の研究を行っておりましたが(1)、1994年に東京大学分子細胞生物学研究所に新たな研究室を立ち上げました。その際、造血幹細胞の発生の研究を始めました。当時すでに骨髄移植が行われていましたが、大量の骨髄細胞の採取が必要であり、造血幹細胞の体外増幅系の開発が血液学の主要なテーマでした。しかし、それは大変困難な課題で未だに実用化はできていません。そもそも成体骨髄の造血幹細胞の増殖能は高くないので、体外で増幅することは難しいだろうと思い、造血幹細胞が最も増殖する胎児期の造血について研究を始めました。造血幹細胞は大動脈・生殖器・中腎(AGM: Aorta/Gonad/Mesonephros) 領域で発生し胎児肝臓に移動して増幅すると考えられていましたので、AGMでの造血発生とともに胎児肝臓での造血について研究を始めました(2)。これが私の肝臓研究の始まりです。具体的には、AGMで発生した造血幹細胞を胎児肝臓細胞との共培養系で増やせないかというものです。造血幹細胞は肝臓細胞の支持によりある程度増幅することができたのですが、興味深いことに造血系細胞は肝細胞の分化を誘導することが分かりました(3,4)(図1)。大学院生の紙谷聡英さん(現 東海大医学部)が、私どもがDNAX時代に同定したオンコスタチン(Oncostatin M, OSM)というIL-6ファミリーのサイトカインが未分化肝細胞の成熟肝細胞への分化を強力に促進することを見出しました(5)。このOSMによる肝細胞分化誘導は、標準技術となり現在のiPS/ES細胞からの肝細胞の分化誘導系にも頻繁に利用されています。
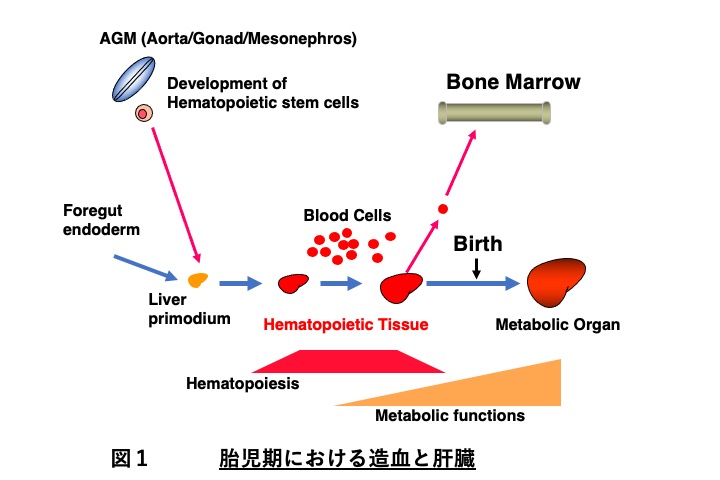
肝臓の発生・分化
肝臓の研究を始めて痛感したことは細胞の同定法が未整備であるということでした。未だに実質細胞と非実質細胞という用語が使われていますが、30年前には、血液学の常套手段であった細胞膜タンパク質に対する抗体を使ってセルソーターにより細胞を同定・分離する方法が肝臓研究ではほとんど行われていませんでした。そこで肝臓の研究を本格的に行うに当たり、田中稔さん(現 国際医療研究センター)は、肝臓構成細胞の細胞膜タンパク質に対するモノクローナル抗体の作製を網羅的に行い、各種細胞の分離・同定法を確立しました。これにより肝臓の構成細胞を厳密に定義して解析することが可能になりました。
肝臓の上皮細胞である肝細胞と胆管上皮細胞は肝幹・前駆細胞から分化すると考えられていましたが、その実態は不明でした。谷水直樹さん(現 東大医科研)は、Dlkという膜タンパク質の発現を指標にマウス胎児肝臓から分離して肝細胞と胆管への分化を解析しました(6,7)。また、非実質細胞として十把一絡に扱われていた中皮細胞、類洞内皮細胞、星細胞などについても細胞膜タンパク質の発現を指標に抗体で分離同定することができるようになりました(8-12)。こうして分離した異種細胞の共培養により細胞間の相互作用をin vitroで解析することが可能になり、それら細胞の分化過程の一端を明らかにすることができました(図2)。
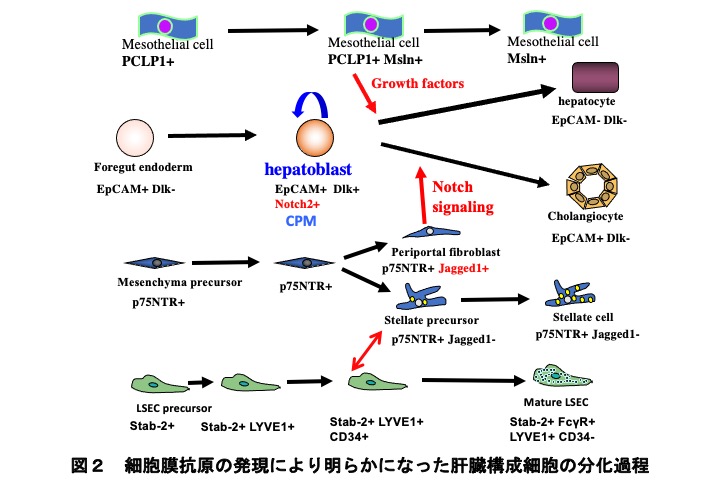
なお、この一連の研究については既に肝細胞研究会ホームページの研究交流「細胞膜抗原の発現を指標とした肝構成細胞の分離と肝発生機構の解析」http://hepato.umin.jp/kouryu/kouryu11.html)で紹介しています。
肝臓の修復・再生
肝臓は古くより再生能の高い臓器として知られており、この能力により生体肝移植が可能となっています。マウスを用いた実験では、肝臓の約70%相当を切除しても、残存した肝臓が増殖し1週間から10日程度で元の肝重量に回復することが知られていました。この場合の肝再生は、分化した肝細胞が単純に分裂すると考えられていました。しかし、大学院生の宮岡祐一郎さん(現 東京都医学研)は肝細胞のサイズ、分裂回数を可視化して厳密に解析する方法を開発して再解析したところ、肝細胞はまず肥大し、その後に分裂増殖する様子が明らかになりました(13)(図3)。
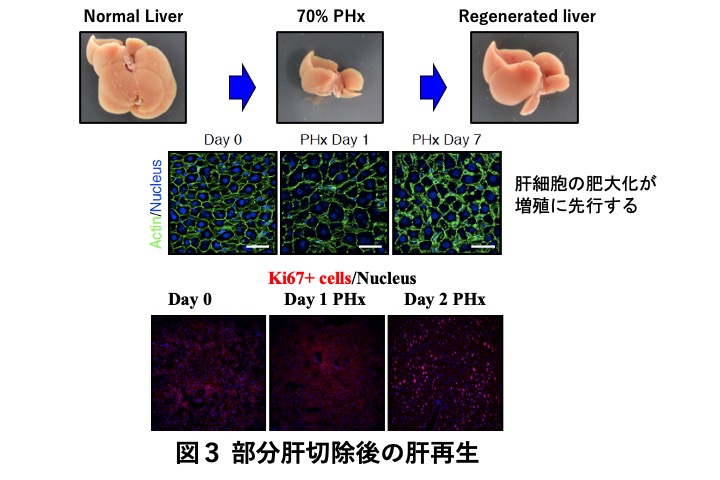
一方、重篤な障害肝においては、実質域に異所的な胆管上皮細胞マーカー陽性の細胞集団が観察されます。これらはオーバル細胞や Liver Progenitor Cell (LPC)あるいは偽胆管として知られ、これらが出現する現象は胆管増生や細胆管反応とよばれていました。しかしその細胞の実態は不明でした。田中稔さんはこの細胞の膜タンパク質としてEpCAMを同定し、EpCAM陽性細胞を分離して培養して肝細胞と胆管上皮細胞への分化能を示しました(10,11)(図4)。
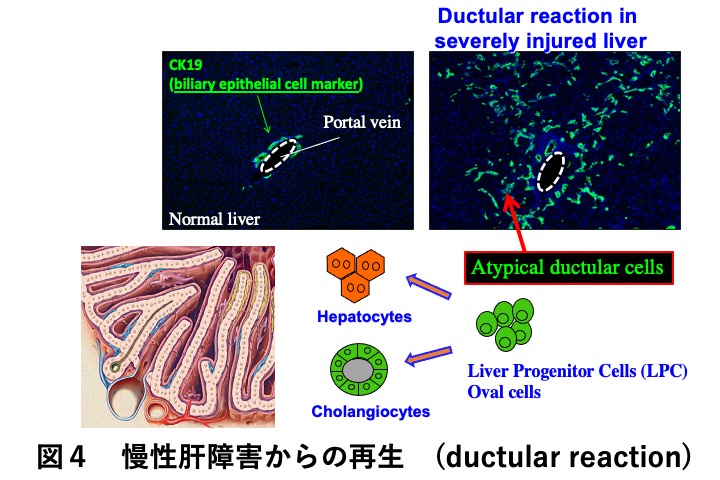
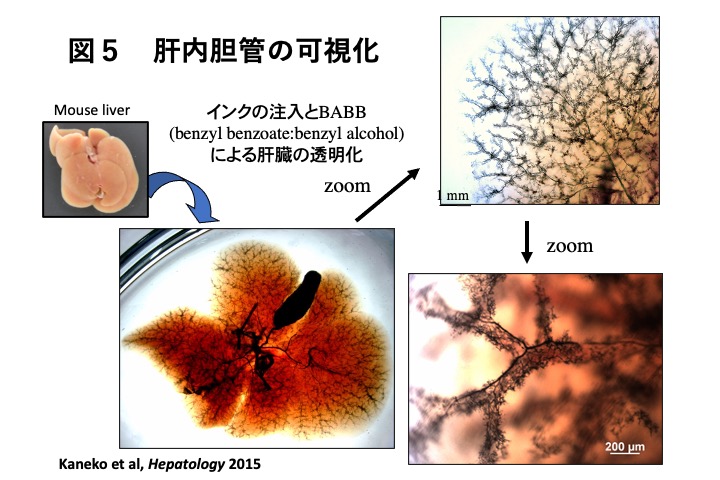
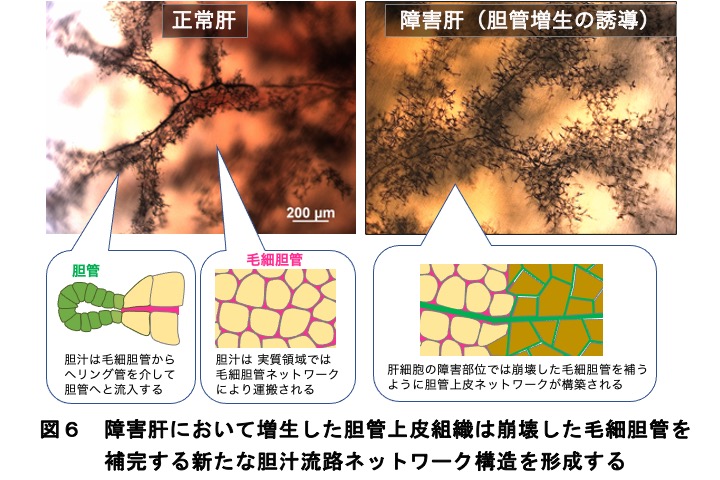
伊藤暢さん(現 東大定量研)は、LPCのニッチシグナルとして障害時に門脈域で増えるThy1陽性間葉系細胞からのFGF7を同定しました(14)。さらに、肝内胆管の微細構造を可視化する方法およびマウス体内で胆管細胞系譜解析法を開発し、肝障害により胆管が増生する様子を明らかにしました(15,16)。中心静脈域を障害するThioacetoamide(TAA)の長期投与により中心静脈域の障害部位では毛細胆管が消失し、門脈域では胆管増生が誘導され、この増生した胆管は障害部位に伸長して胆汁を排泄することが示されました。一方、増生した胆管から肝細胞への分化は限定的でした。すなわち、胆管増生は障害により破壊された毛細胆管の機能を一時的に代替することが本質的な機能であると考えられます(17-19)(図5、図6)。こうした研究の詳細については、田中稔さんと伊藤暢さんが肝細胞研究会ホームページの研究交流とホットトピックスで紹介していますのでご覧ください。
http://hepato.umin.jp/kouryu/kouryu50.html http://hepato.umin.jp/hottopics/hottopics012.html
iPS細胞からの肝臓細胞への分化誘導系と創薬研究
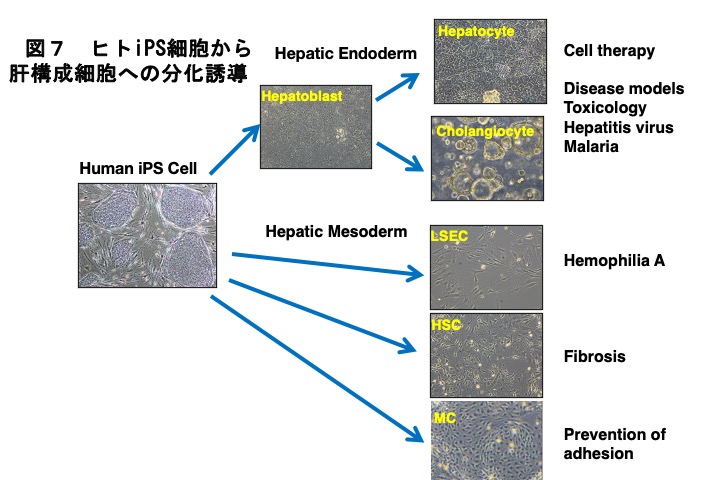
ヒトのES細胞およびiPS細胞が利用できるようになると再生医療や創薬研究に利用可能な細胞を分化誘導する試みが盛んになり、肝細胞分化誘導系の開発も2010年頃から盛んに試みられるようになりました。肝細胞様の細胞を作製することができるようになったのですが、成体肝細胞と同等の機能を備えた肝細胞の分化誘導は難題でした。私の研究室では、木戸丈友さんはこの課題に取り組み、CPMという膜タンパク質を発現する肝前駆細胞の誘導系を構築し、それが増幅可能で肝細胞と胆管細胞への分化能を保持していることを示しました(20)。さらに、類洞内皮細胞や星細胞の分化誘導系も作成し、肝前駆細胞との共培養系により肝細胞の高機能化が促進されました(21)(図7)。
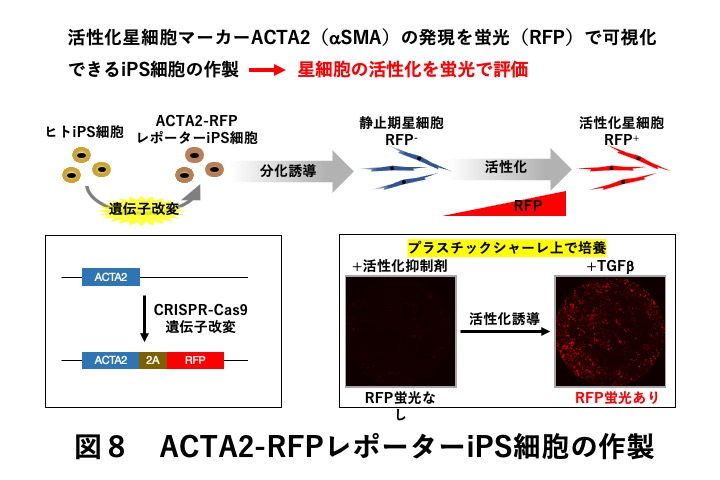
最後にiPS細胞を使った最近の創薬研究について紹介します。様々な病因による慢性的肝障害は肝星細胞の活性化により線維化を誘導し肝硬変につながりますが、線維化に対する有効な治療薬はありません。生体から分離した星細胞は培養により活性化することから生体の静止期星細胞を大量に調製することは現実的ではありません。そこで大量培養が可能なヒトiPS細胞から静止期星細胞を調製するシステムと、その活性化を簡便に定量的に解析可能なレポーター細胞を開発し、星細胞の線維化を抑制する化合物を複数同定することができましたので、これらを肝線維症の治療薬に繋げたいと思っています(22)(図8)。
終わりに
肝臓学のズブの素人の私が肝臓研究を始めて早くも30年余りになりますが、この間に大勢の大学院生や研究員と手探りで肝臓の発生・分化・再生さらに創薬研究と多岐に渡る研究を展開してきました。私の研究方針は、ベンチに向かう学生や研究員の自主性と創意工夫を最大限尊重するというものでしたので、自然と研究は多岐に渡りました。彼らの奮闘で様々な興味深い結果が得られ肝臓研究を楽しむことができました。一緒に研究に関わった方々にこの場を借りて深謝します。
参考文献
- Miyajima A, Kitamura T, Harada N, Yokota T, and Arai K. (1992) Cytokine receptors and signal transduction. Ann. Rev. Immunol. 10, 295-331.
- Mukouyama Y, Hara T, Xu M.J, Tamura K, Donovan P.J, Kogo K, Tsuji T, Nakahata T and Miyajima A (1998) In vitro expansion of murine hematopoietic progenitors derived from the embryonic aorta gonad mesonephros region. Immunity 8, 105-114.
- Takeuchi M, Sekiguchi T, Hara T, Kinoshita T, and Miyajima A. (2002) Cultivation of AGM-derived hematopoietic stem cells in the fetal liver microenvironment amplifies long-term repopulating activity and enhances homing to the bone marrow. Blood 99,1190-1196.
- Kinoshita T, Sekiguchi T, Xu M.J, Ito Y, Kamiya A, Tsuji K, Nakahata T, and Miyajima A (1999) Hepatic differentiation induced by oncostatin M attenuates fetal liver hematopoiesis. Proc. Natl. Acad. Sci. USA. 96; 7265-7270.
- Kamiya A, Kinoshita T, Ito Y, Morikawa Y, Senba E, Nakashima K, Taga T, Yoshida K, Kishimoto T, and Miyajima A (1999) Fetal liver development requires a paracrine action of oncostatin M through gp130. EMBO J 18, 2127-2136.
- Tanimizu N, Nishikawa M, Saito H, Tsujimura T, and Miyajima A (2003) Isolation of hepatoblasts based on the expression of Dlk/Pref-1. J.Cell Sci. 116: 1775-1786.
- Tanimizu N, Saito H, Mostov K, and Miyajima A (2004) Long-term culture of hepatic progenitors derived from mouse Dlk+ hepatoblasts. J. Cell Sci. 117, 6425-6434.
- Nonaka H, Tanaka M, Suzuki K, and Miyajima A (2007) Development of murine hepatic sinusoidal endothelial cells characterized by the expression of hyaluronan receptors. Dev. Dyn. 236, 2258-2267.
- Suzuki K, Tanaka M, Watanabe N, Saito S, Nonaka H, and Miyajima A (2008) The p75 neurotrophin receptor marks precursors of hepatic stellate cells and portal fibroblasts in mouse fetal liver. Gastroenterology 135, 270-281.
- Okabe M, Tsukahara Y, Tanaka M, Suzuki K, Saito S, Kamiya Y, Tsujimura T, Nakamura K, and Miyajima A (2009) Potential hepatic stem cells reside in EpCAM+ cells of normal and injured mouse livers. Development 136, 1951-1960.
- Tanaka M, Okabe M, Suzuki K, Kamiya Y, Tsukahara Y, Saito S, and Miyajima A (2009) Mouse hepatoblasts at distinct developmental stages are characterized by expression of EpCAM and DLK1: drastic change of EpCAM expression during liver development. Mech. Dev. 126, 665-676.
- Onitsuka I, Tanaka M, and Miyajima A (2010) Characterization and functional analyses of hepatic mesothelial cells in mouse liver development. Gastroenterology 138, 1525-1536.
- Miyaoka Y, Ebato K, Kato H, Arakawa S, Shimizu S, and Miyajima A (2012) Hypertrophy and unconventional cell division of hepatocytes underlie liver regeneration. Current Biology 22:1166-1175.
- Takase H, Itoh T, Wang T, Koji T, Akira S, Takikawa Y, and Miyajima A (2013) FGF7 is a functional niche signal required for stimulation of adult liver progenitor cells that support liver regeneration. Genes and Development27:169-181.
- Itoh T and Miyajima A (2014) Cellular Basis of Liver Regeneration. Hepatology 59:1617-26.
- Miyajima A, Tanaka M, and Itoh T (2014). Stem/progenitor cells in liver development, homeostasis, regeneration and reprogramming. Cell Stem Cell14:561-74.
- Kaneko K, Kamimoto K, Miyajima A and Itoh T (2015) Adaptive remodeling of the biliary architecture underlies liver homeostasis. Hepatology61:2056-66.
- Kamimoto K, Kaneko K, Kok C, Miyajima A and Itoh T (2016) Heterogeneous and stochastic growth regulation of biliary epithelial cells dictate dynamic epithelial tissue remodeling. eLife 5: e15034.
- Kamimoto K, Nakano Y, Miyajima A, and Itoh T (2020) Multidimensional imaging of liver injury repair in mice reveals fundamental role of the ductular reaction. Communications Biology 3: 289.
- Kido T, Koui Y, Suzuki K, Kobayashi A, Miura Y, Chen Y-R, Tanaka M, and Miyajima A (2015) CPM is a useful cell surface marker to isolate expandable bi-potential liver progenitor cells derived from human iPS cells. Stem Cell Reports. 5, 508-515.
- Koui Y, Kido T, Ito T, Oyama H, Chen S-W and Miyajima A (2017) An in vitro human liver model by iPSC-derived parenchymal and non-parenchymal cells. Stem Cell Rep. 9, 490-498.
- Koui Y, Himeno M, Mori Y, Nakano Y, Saijou E, Tanimizu N, Kamiya Y, Anzai H, Maeda N, Wang L, Yamada T, Sakai Y, Nakato R, Miyajima A, and Kido T (2021) Development of human iPSC-derived quiescent hepatic stellate cell-like cells for drug discovery and in vitro disease modeling. Stem Cell Rep. 16, 3050–3063.
註 DNAX研究所:
1981年にStanford大学のノーベル賞受賞者Arthur Kornberg教授やPaul Berg教授らが中心となってStanford Research Parkに設立した分子細胞生物学研究所(DNAX Research Institute of Molecular and Cellular Biology)で、設立後まもなく製薬企業のSchering-Ploughの傘下に入り、数多くのサイトカインやそれらの受容体の同定やTh1/Th2ヘルパーT細胞の発見など免疫学に大きな足跡を残しました。しかし、DNAX研究所は2005年にSchering-Plough Biopharmaとなり,さらにSchering-Plough は2009年にMerckに合併されましたので、DNAX研究所はもはや存在していません。しかし、この間に大勢の日本人研究者がここで活躍しました。図9











