ホットトピックス
胆管の可視化
金子 洸太、 伊藤 暢
東京大学分子細胞生物学研究所 発生・再生研究分野
胆管の構造と可視化
肝内の胆管は、組織切片において、いわゆる「門脈三つ組」構造の構成要素として門脈および肝動脈に隣接して観察される。このような観察に基づき、多くの書物では、胆管は門脈に並走する1本の管として描かれている。一方で、胆管は肝臓内で、門脈と同様に三次元的な樹状構造を形成すると考えられる。こうした構造を観察する手法として、これまでに樹脂を胆管に流し込み鋳造することで形を観察する方法(1)、MRI や CT などで撮影する方法(2)、連続切片の免疫染色像を3D構築する方法(3, 4)、などが用いられてきた。我々は最近、新規可視化法を開発することにより、成体マウス肝臓内における胆管の詳細な三次元構造を観察し、胆管が門脈に並走するだけでなく、門脈周囲において複雑なネットワークを形成していることを明らかにした(5)。
胆管の新規可視化法
我々はマウスの胆管を可視化するため、十二指腸に接続されている総胆管から逆行性にインクを注入し、その後、摘出した肝臓を透明化した(図1A)。透明化は、組織中の水分を、脂質やタンパク質に近い屈折率を有するBABBという有機溶媒(ベンジルアルコール benzyl alcoholと安息香酸ベンジル benzyl benzoate の混合液)に置換し、光の散乱を軽減することで行なった。肝組織が透明になることで、胆管に注入された黒いインクを観察することが出来る。この簡便な手法により、肝臓全体における胆管の三次元的組織構造を詳細まで可視化することに成功した(図1B)。また、インクを注入した肝臓から切片を作製し、免疫染色を行なうと、胆管上皮細胞のマーカーとインクが隣接して観察されることから(図1C)、インクにより可視化された流路が、胆管上皮細胞からなる胆管の構造を反映していることが確認できる。
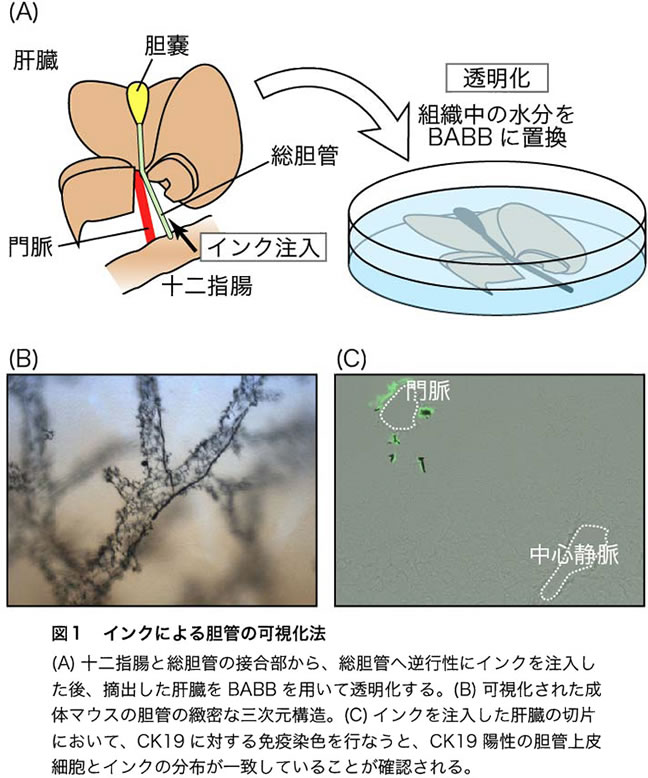
詳細な観察から、胆管には大別して2種類の構造が存在することが明らかとなった(図2A)。一つは、門脈に並走する太い胆管であり、従来観察されてきた典型的な肝内胆管はこれに相当すると考えられる。この胆管は1本の門脈に対し、1ないし2本存在している。もう一つは、複雑に分岐しながら門脈周囲を覆うように存在する細い胆管のネットワークである。これまでにも、細胆管として知られるように、太い胆管から分岐する細い管が存在することは観察されてきたが、新規可視化法を用いた観察により、これらの緻密なネットワーク構造の詳細が明らかとなった。
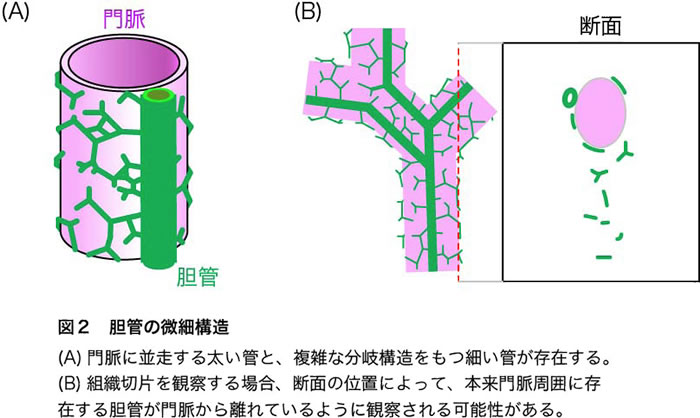
このような胆管のネットワークは、門脈の周囲に隣接して存在しているが、切片を作製して観察する場合、図2Bに示すように、断面の位置によっては、胆管が門脈から離れて観察される場合があることに注意する必要がある。特に、肝障害時に胆管が肥厚した場合などでは、そのような断面像を得る確率が高くなると考えられる。
Takashimaらは最近、連続した肝臓組織切片の免疫染色像を積層化して3D構築するという手法を用いて、マウス肝発生時における胆管構造の形成過程を定量的に解析・記述した(4)。ここでも、我々の観察結果と同様に、成体肝臓における2種類の胆管(太い管と細い管)の存在が示されている。彼らの報告によれば、胎齢16.5日目頃から門脈周囲での胆管上皮(CK19陽性)細胞のネットワーク構造が形成され始めるようである。今後、インク注入などの手法をさらに組み合わせることで、胆汁の流路としての管腔(導管)構造のネットワーク形成過程が明らかになると期待される。
胆管の三次元構造に着目した障害肝の観察
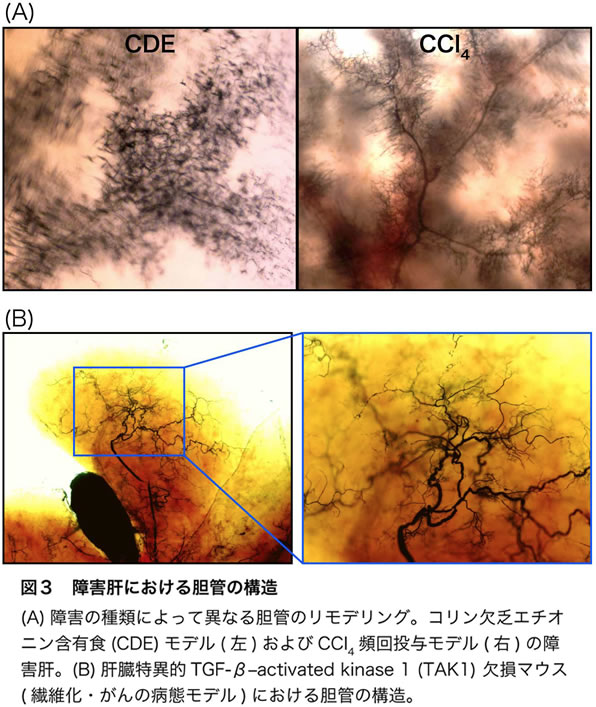
重篤な障害肝においては、実質域に異所的な胆管上皮細胞マーカー陽性の細胞集団が観察される。これらはオーバル細胞や Liver Progenitor Cell (LPC) 、偽胆管として知られ、これらが出現する現象は胆管増生や細胆管反応とよばれる。障害時に胆管増生を誘導することのできない各種遺伝子改変マウスでは、障害がより重篤化することから(6-8)、この反応は肝再生に重要であると考えられる。しかしながら、この反応の実態については不明な点が多く、特に、偽胆管が元から存在する胆管に接続されているか否かは未解明であった。我々は、マウス慢性肝障害モデルの胆管にインクを注入し、切片および三次元的な観察により、これらが接続されたネットワークを形成していることを明らかにした。すなわち、重篤な障害肝では、胆管のネットワークの顕著なリモデリングが起きていることが分かった(図3)。肝臓が代謝異常や薬物により障害を受けた場合には、炎症や繊維形成だけでなく、上皮組織である胆管の構造変化が肝再生に重要な現象として誘導されると考えられる。
同様のリモデリングについての報告がNagahamaらによってもなされている(9)。彼らの報告では、Thioacetamide (TAA) などによる慢性的な肝障害時に胆管のネットワークが門脈周囲から中心静脈周囲へ移行することを観測している。我々がTAAモデル障害肝において、時系列を追って三次元的に観察した結果では、障害の序盤では胆管の枝が門脈周囲から中心静脈の方へ伸びており、中心静脈へ枝が到達した後に激しく分岐し、中心静脈周囲でネットワークを形成することが分かった。
興味深いことに、種々の障害肝の比較解析により、増生した胆管ネットワークが肝障害の種類によって大きく異なることも見いだした(図3A)。各種障害肝において、障害の強いゾーンにおける胆管の密度が高くなるように、胆管の枝が配置されていた。胆管のリモデリングは障害部位の違いに相関・対応していると考えられる。このようなリモデリングは、肝臓の適応的応答と考えられ、いくつかの生理的意義が考えられる。胆管の主要な役割は胆汁の排出であるため、胆汁鬱滞を伴うような肝障害では、増生した胆管は実質域からの胆汁の排出を促している可能性がある。また、胆汁は界面活性剤であるため、疎水性の薬物や、障害時に生じる老廃物を排出し、組織への更なるダメージを軽減している可能性も考えられる。さらに、これまでLPCや胆管は、肝前駆細胞を含むといわれてきた(8, 10-15)。障害部位へ配置された胆管は、障害部位付近における効率的な肝前駆細胞による再生を促しているというモデルが考えられる。
経時的な観察では、肝障害時に増生する胆管上皮細胞マーカーCK19陽性の細胞は、常に胆管から連続した集団として観察され、胆管は門脈域から連続的に伸張していた。近年、偽胆管の細胞の由来として、元から存在する胆管上皮細胞の増殖だけでなく、肝細胞が寄与する場合があることが報告されているが(9, 16-19)、このような寄与は増生した胆管に隣接した部分でのみ誘導されることが示唆される。今後、胆管上皮細胞と肝細胞の分化状態の可塑性に加え、胆管の脈管構造そのものの可塑性にも着目する必要性があると思われる。
おわりに
インクを用いた可視化法は非常に簡便であり、透明化を含めて二日程度で行なうことができる。必要な道具も安価であり、入手も容易である。また、肝臓全体にわたって明視野で観察するため、直感的に構造を理解しやすいという利点がある。慢性的/重篤な障害肝では多くの場合、胆管系三次元組織構造の顕著なリモデリングが起こっていることが明らかとなったため、肝臓の様々な病態モデルや生理現象において、本手法が新たな視点の構築に役立つことを期待したい。
参考文献
- Sparks EE, et al. Defects in hepatic Notch signaling result in disruption of the communicating intrahepatic bile duct network in mice. Dis Model Mech 2011;4:359-367.
- Ernst TM, et al. Imaging of the murine biliopancreatic tract at 7 Tesla: technique and results in a model of primary sclerosing cholangitis. J Magn Reson Imaging 2014;40:1355-1364.
- Vestentoft PS, et al. Three-dimensional reconstructions of intrahepatic bile duct tubulogenesis in human liver. BMC Dev Biol 2011;11:56.
- Takashima Y, et al. Dynamic three-dimensional morphogenesis of intrahepatic bile ducts in mouse liver development. Hepatology 2015;61:1003-1011.
- Kaneko K, et al. Adaptive remodeling of the biliary architecture underlies liver homeostasis. Hepatology 2015, in press (published online: DOI 10.1002/hep.27685)
- Ishikawa T, et al. Hepatocyte growth factor/c-met signaling is required for stem-cell-mediated liver regeneration in mice. Hepatology 2012;55:1215-1226.
- Takase HM, et al. FGF7 is a functional niche signal required for stimulation of adult liver progenitor cells that support liver regeneration. Genes Dev 2013;27:169-181.
- Shin S, et al. Ablation of Foxl1-Cre-labeled hepatic progenitor cells and their descendants impairs recovery of mice from liver injury. Gastroenterology 2015;148:192-202 e193.
- Nagahama Y, et al. Contributions of hepatocytes and bile ductular cells in ductular reactions and remodeling of the biliary system after chronic liver injury. Am J Pathol 2014;184:3001-3012.
- Rodrigo-Torres D, et al. The biliary epithelium gives rise to liver progenitor cells. Hepatology 2014;60:1367-1377.
- Miyajima A, Tanaka M and Itoh T. Stem/Progenitor Cells in Liver Development, Homeostasis, Regeneration, and Reprogramming. Cell Stem Cell 2014;14:561-574.
- He J, et al. Regeneration of liver after extreme hepatocyte loss occurs mainly via biliary transdifferentiation in zebrafish. Gastroenterology 2014;146:789-800 e788.
- Choi TY, et al. Extensive conversion of hepatic biliary epithelial cells to hepatocytes after near total loss of hepatocytes in zebrafish. Gastroenterology 2014;146:776-788.
- Huch M, et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature 2013;494:247-250.
- Espanol-Suner R, et al. Liver progenitor cells yield functional hepatocytes in response to chronic liver injury in mice. Gastroenterology 2012;143:1564-1575 e1567.
- Sekiya S and Suzuki A. Hepatocytes, rather than cholangiocytes, can be the major source of primitive ductules in the chronically injured mouse liver. Am J Pathol 2014;184:1468-1478.
- Tarlow BD, et al. Bipotential adult liver progenitors are derived from chronically injured mature hepatocytes. Cell Stem Cell 2014;15:605-618.
- Yanger K, et al. Robust cellular reprogramming occurs spontaneously during liver regeneration. Genes Dev 2013;27:719-724.
- Sekiya S and Suzuki A. Intrahepatic cholangiocarcinoma can arise from Notch-mediated conversion of hepatocytes. J Clin Invest 2012;122:3914-3918.










