研究交流
肝星細胞の発生研究の動向
朝比奈 欣治 (Kinji Asahina)
Southern California Research Center for ALPD & Cirrhosis
Keck School of Medicine of the University of Southern California
E-mail: asahina@usc.edu
肝星細胞とは
肝星細胞はビタミンAを貯蔵し、肝臓内のディッセ腔と呼ばれる 肝細胞と類洞内皮細胞の間隙に存在する細胞である。この肝星細胞は、肝傷害時に活性化され、筋線維芽細胞様の形態を呈する。活性化した肝星細胞は、肝細胞の再生に必要なHGF等のサイトカインを分泌し肝再生を促進する一方、コラーゲンやTGF-βを産生して肝臓の線維化にも関わることが知られている。肝星細胞は、成体のラットやマウス肝臓をコラゲナーゼ灌流後、密度勾配遠心により単離することができ、培養下において、傷害肝と同じく活性化して筋線維芽細胞様に変化することから、肝臓の線維化を調べる実験に用いられている (1-3)。一方、肝臓発生においても、肝星細胞は重要な働きをしていることが推測されているが、その細胞起源や機能についてほとんどわかっていなかった。近年、いくつかのマーカーが同定され、胎児肝星細胞に関する研究が行われるようになった。
肝臓発生と肝星細胞
肝臓の発生は、マウス胚ではE8.5頃より始まる。この時期の前腸内胚葉 (foregut endoderm)と心臓原基の間には、間充織細胞からなる横中隔 (septum transversum)が存在し、前腸内胚葉の細胞が横中隔へと浸潤し肝芽細胞(hepatoblast)へと分化する (4,5)。肝芽細胞は横中隔の間充織細胞と混ざり合いながら、肝臓原基を形成するが、この横中隔の間充織細胞が肝星細胞になることが電子顕微鏡による形態学的な検討により示唆されている (6)。デスミン (desmin) は肝星細胞の一般的なマーカーとして知られているが、成体肝臓と同じく、 胎児肝臓においても肝芽細胞に沿ってデスミン陽性の線維芽細胞様の細胞が分布しており、これらデスミン陽性の細胞が胎児肝における肝星細胞と考えられている (7)。このように、組織学的に胎児肝の肝星細胞を識別することは可能だが、胎児肝星細胞は成体肝星細胞のように細胞内にビタミンA脂質を貯蔵していないため、 成体の肝星細胞と同じ手法で単離することができない。また、これまで、肝星細胞に特異的な細胞表面抗原や、プロモーターなどが知られていなかったため、胎児肝星細胞を詳細に検討することは不可能であった。2008年に鈴木らは、マウス胎児肝臓を抗原としてモノクローナル抗体を作成し、胎児肝星細胞特異的抗原としてp75 neurotrophin receptor (p75NTR)を同定した (8)。彼らは、抗p75NTR抗体を用い胎児肝星細胞を単離し、この細胞が培養下でビタミンAを貯蔵する細胞、すなわち肝星細胞へと成熟化することを明らかにした。p75NTRは、成体肝臓において活性化した肝星細胞に発現することが知られており、Rhoの活性を調節することで肝星細胞の活性化に関わることが知られている (9)。
肝星細胞の前駆細胞
一方、著者らも胎児肝星細胞の研究を進めるべく、肝星細胞に発現する遺伝子の検索を行った (10)。ホメオボックス遺伝子の一つである、Msx2遺伝子のエンハンサー下にLacZレポーター遺伝子を発現するマウス胎児肝臓を調べたところ、LacZの発現は、デスミン陽性の肝星細胞や、血管周囲の間葉系細胞 、肝臓表面の中皮細胞 (mesothelial cell)とその直下にある間葉系細胞に発現することを見つけた。次に、このLacZ陽性の細胞を単離し、マイクロアレイ解析により遺伝子の検索を行った。その結果、デスミンに加え、p75NTRを含むいくつかの細胞表面抗原をコードする遺伝子が、このLacZ陽性の細胞集団に強く発現していることが明らかとなった。その遺伝子中から、activated leukocyte cell adhesion molecule (ALCAM)とpodoplaninに着目し、免疫組織染色により胎児肝を詳細に検討した。ALCAMは、肝臓表面の中皮細胞と、中皮細胞直下の間葉系細胞に強く発現しており、肝実質内の肝星細胞や血管周囲の間葉系細胞には発現しない (図1)。また、この中皮細胞直下の間葉系細胞は、肝星細胞と同じくデスミンやp75NTRを発現している。一方、中皮細胞はpodoplaninを特異的に発現しており、中皮細胞とその直下の間葉系細胞の間にはIV型コラーゲンからなる基底膜がある。このような特徴から、著者らは、中皮細胞直下に存在する間葉系細胞を中皮下細胞 (submesothelial cell)と名付け、識別することにした。この中皮下細胞は、胎児肝の肝星細胞と、 細胞形態 およびデスミンやp75NTRの発現において類似しているが、胎児肝臓表面直下で基底膜に接していること、ALCAMを発現することが特徴である (図2)。興味深いことに、胎児肝臓表面のデスミンおよびALCAM陽性の中皮下細胞の一部は、基底膜を離れて肝臓内部に移動しているような像が観察される。さらに、ALCAMに対する抗体を用いて、中皮下細胞および中皮細胞を胎児肝から単離してコラーゲンゲル内で培養すると、ビタミンAを貯蔵することから、中皮下細胞は肝星細胞の前駆細胞である可能性が示唆される。このような中皮下細胞は、ヒト胎児肝においてもN-CAMを発現する細胞として報告された (11)。
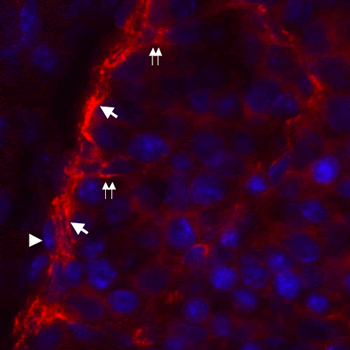
図1 胎生13.5日マウス胎児肝臓におけるALCAMの発現
抗ALCAM抗体を用いた蛍光組織免疫染色によりALCAMを検出した(赤色)。胎児肝臓表面にて、中皮下細胞に強くALCAMの発現が見られる(矢印)。ALCAMの発現は、肝臓表面から離れた中皮下細胞や(二重矢印)、中皮細胞の基底膜側(矢頭)にも見られる。
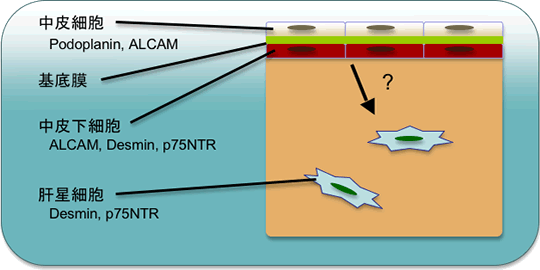
図2 マウス胎児肝臓の模式図
各種マーカーによる蛍光組織免疫染色の結果から推測されるマウス胎児肝臓の模式図。肝臓表面に存在する中皮細胞はpodoplanin, ALCAMを発現し、中皮下細胞とは基底膜により隔てられている。中皮下細胞および肝星細胞は、desmin, p75NTRを発現しているが、中皮下細胞はALCAMを発現し、肝臓表面において基底膜に接していることで識別される。
肝星細胞の発生起源
肝発生初期の横中隔間充織細胞が肝星細胞の起源ならば、星細胞は中胚葉に由来すると推測されるが、そもそも横中隔の発生起源や細胞分化に関する知見が乏しく、肝星細胞の由来についても不明なままであった。一方、成体肝臓の肝星細胞は、デスミンやI型コラーゲンなど間葉系のマーカーだけでなく、上述したp75NTRやネスチン (nestin)、GFAPなど神経系のマーカーも発現することから、肝星細胞は神経堤細胞 (neural crest) に由来するのではないかと考えられていた。ところが、Wnt1-CreマウスとROSA26レポーターマウスを用いて神経堤細胞に由来する細胞を解析した結果、肝臓内に神経堤細胞由来の細胞は見られず、肝星細胞の由来は神経堤細胞ではないことが報告された (12)。筆者らは、 MesP1-Creマウス (13)とROSA26レポーターマウスを用いて、胚発生初期に形成される中胚葉由来の細胞系譜を調べ、胎児肝においてデスミン陽性の肝星細胞は中胚葉に由来することを明らかにした (10)。また、血管周囲の間葉系細胞や、中皮下細胞も同じ中胚葉由来であった。
おわりに
特異的マーカーが同定され、胎児肝における肝星細胞の実体が明らかになりつつある。また、肝星細胞だけでなく、 中皮下細胞という類似した細胞も明らかとなり、肝発生における機能や、成体肝における役割など、多くの解決すべき問題があり、興味がつきない。最後になりましたが、この解説を書く機会を与えて下さいました塩尻信義先生、立野知世先生に、この場を借りて厚くお礼申し上げます。ここで紹介した研究成果は、南カリフォルニア大学、塚本秀和教授の研究室にて得られたものです。
参考文献
- Blomhoff R, Wake K. Perisinusoidal stellate cells of the liver: important roles in retinol metabolism and fibrosis. FASEB J 1991;5:271-277.
- Friedman, SL. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiol Rev 2008;88:125-172.
- 河田 則文. 星細胞と肝線維化研究の動向. http://hepato.umin.jp/kouryu05.html
- 塩尻 信義. 肝臓の発生・分化・組織構築過程における細胞間ならびに組織間相互作用. http://hepato.umin.jp/kouryu01.html
- Zaret KS. Regulatory phases of early liver development: paradigms of organogenesis. Nat Rev Genet 2002;3:499-512.
- Enzan H, Himeno H, Hiroi M, Kiyoku H, Saibara T, Onishi S. Development of hepatic sinusoidal structure with special reference to the Ito cells. Microsc Res Tech 1997;39:336-349.
- Nitou M, Ishikawa K, Shiojiri N. Immunohistochemical analysis of development of desmin-positive hepatic stellate cells in mouse liver. J Anat 2000;197:635-646.
- Suzuki K, Tanaka M, Watanabe N, Saito S, Nonaka H, Miyajima A. p75 Neurotrophin receptor is a marker for precursors of stellate cells and portal fibroblasts in mouse fetal liver. Gastroenterology 2008;135:270-281.
- Passino MA, Adams RA, Sikorski SL, Akassoglou K. Regulation of hepatic stellate cell differentiation by the neurotrophin receptor p75NTR. Science 2007;315:1853-1856.
- Asahina K, Tsai SY, Li P, Ishii M, Maxson RE Jr, Sucov HM, Tsukamoto H. Mesenchymal origin of hepatic stellate cells, submesothelial cells, and perivascular mesenchymal cells during mouse liver development. Hepatology 2009;49:998-1011.
- Loo CK, Wu XJ. Origin of stellate cells from submesothelial cells in a developing human liver. Liver Int 2008;28:1437-1445.
- Cassiman D, Barlow A, Vander Borght S, Libbrecht L, Pachnis V. Hepatic stellate cells do not derive from the neural crest. J Hepatol 2006;44:1098-1104.
- Saga Y, Miyagawa-Tomita S, Takagi A, Kitajima S, Miyazaki J, Inoue T. MesP1 is expressed in the heart precursor cells and required for the formation of a single heart tube. Development 1999;126:3437-3447.










