研究交流
肝臓の発生・分化・組織構築過程における細胞間ならびに組織間相互作用
塩尻信義
静岡大学理学部生物科学科
1. はじめに
肝臓は、成熟肝細胞や星細胞、血管内皮細胞などの構成細胞が規則正しく、いってみれば結晶状に配列した肝小葉を基本単位とする代謝臓器である。その高次の組織構造が種々の肝機能の遂行を保証している。しかし発生初期の肝臓原基はいたって単純で、内胚葉の1層のシート構造、次に憩室構造をとる。そして著しい細胞増殖、さまざまな細胞分化や形態形成を経て、成熟肝組織が成立していくが、その過程では、細胞間ならびに組織間相互作用が必要不可欠である。組織形成が非常に活発な胎児肝臓は造血器官であり、組織像が複雑で、その発生・分化・組織構築メカニズムの研究はあまり進んでいなかった。しかし、最近の遺伝子欠失マウスの開発(conditional knockout miceをふくめ)や、また細胞表面マーカーを基礎とした細胞培養による解析などにより、肝臓発生・分化の研究は格段の進歩を遂げた。ここでは、我々の研究を中心に胎児肝臓の発生・分化・組織構築における細胞間ならびに組織間相互作用に関して紹介したい。
2. 肝臓発生と組織形成
マウス胚の場合、肝臓原基はE9.0に前腸門腹壁内胚葉の肝憩室として発生するが、それには心臓中胚葉や横中隔間充織による2段階の誘導が必要である。E9.5に、肝憩室は頭部・尾部の2部分よりなるようになり、頭部肝憩室を構成する内胚葉細胞が隣接する間充織(横中隔間充織)と臍腸間静脈に肝芽細胞(E12.5までの未熟肝実質細胞;図1)の細胞索を侵入させ、ミニ肝臓が発生する。その後造血幹細胞が移入し、造血器官となるため、胎児肝臓の組織構築は非常に複雑なものとなる(図2)。発生の早い時期、肝臓に肝内胆管は発生していない。一方、胆嚢や肝外胆管は肝憩室尾部として発生し、E9.5の時点で既に肝臓本体を作る部分とは別になっている1)。
成体肝臓で発達する門脈、肝動脈、類洞、肝静脈(中心静脈)の血管系の発生学的起源であるが、我々の組織学的解析からは、門脈は臍腸間静脈由来、肝静脈は後主静脈由来である可能性が高い2)。類洞の起源ははっきりしないが、臍腸間静脈のangiogenesisにより発生する可能性が高い。また門脈-原始類洞-肝静脈という血管系構築は発生初期より発達し、またそれぞれのコンパートメントの遺伝子発現も異なるようである。門脈内皮はJagged1やコネキシン40を発現するが、それ以外の静脈内皮はこれらを発現しない2)。肝動脈は胎児期、肝臓内にあまり発達しないが、生後発達し、その内皮はJagged1、コネキシン40の発現が陽性である。
星細胞の起源は横中隔間充織あるいは臍腸間静脈結合組織と考えられる。
肝内胆管の形成はE13.5に、門脈周囲に位置した肝芽細胞が門脈の細胞から誘導を受けることで始まり、ductal platesあるいはpearl-like structuresが発生する(図1)1)。E16.5-17.5に肝内胆管が出現し始める。門脈周囲以外の肝芽細胞は成熟肝細胞へと分化していく。C/EBPαの発現が肝芽細胞の成熟肝細胞あるいは胆管上皮細胞への分化に密接に関わっている(後述;図1)3)。
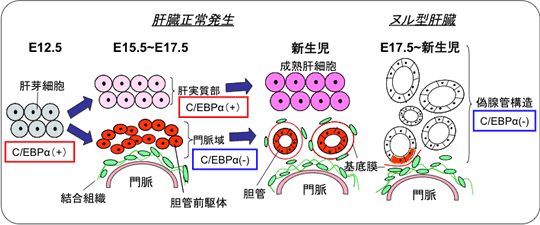
図1 肝臓発生過程における肝芽細胞の分化・成熟化とC/EBPα
肝芽細胞は門脈に位置すると、誘導を受け胆管上皮細胞となるが、それ以外の細胞は成熟肝細胞となる。C/EBPαは胆管上皮細胞の分化過程で発現抑制される。その遺伝子欠失マウス肝臓では、肝細胞の成熟化が抑えられるとともに、偽腺管構造が発生する。門脈周囲に胆管上皮細胞は分化するが、胆管は形成しない。
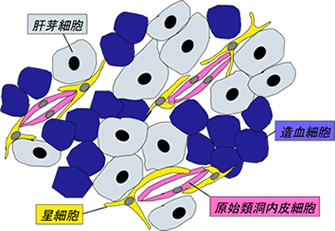
図2 胎児肝臓の模式図
胎児肝臓は造血器官で複雑な組織像を示すが、成体肝臓同様、類洞構造(原始類洞)がよく発達している。原始類洞内皮は星細胞と細胞外マトリックスで裏打ちされている。
3. 肝臓構築・機能発現における細胞間相互作用
肝臓構築・機能発現における細胞間相互作用を調べるため、まずE12.5肝臓を細胞分散し、初代培養を行った。その結果、この培養系では、肝芽細胞、星細胞、血管内皮細胞(原始類洞内皮細胞)、造血細胞、Kupffer細胞等を含む二次元肝organoidが形成された(図3)4)。また培養が進むにしたがい、尿素回路酵素など肝機能を発現した。次に抗E-cadherin抗体を用いた免疫磁気ビーズ法により、肝芽細胞とそれ以外の細胞(非実質細胞)を分離したところ、肝芽細胞の生存・増殖・分化には非実質細胞の存在が必要で、また逆に非実質細胞の生存・増殖等にも肝芽細胞が必要であった。これは肝芽細胞と非実質細胞間の相互作用が肝臓構築・機能発現に必須であることを示している5)。さらに、肝臓構築・機能発現に血管内皮細胞がどのような作用を及ぼしているか調べるため、PECAM-1を発現する内皮細胞を免疫磁気ビーズ法を用いて除去して培養すると、肝芽細胞、星細胞、Kupffer細胞等の増殖・遺伝子発現が著しく減少した。この結果は肝臓の組織構築・機能発現に血管内皮細胞が必須であることを示している。またこの内皮除去の効果は、内皮細胞を除かない胎児肝臓細胞培養のconditioned medium添加で完全にレスキューされ、内皮細胞からの因子が液性のものであると推察された。その本体の解明は極めて重要であるが、これら以外に、図4に示すような細胞間相互作用ネットワークが動いていると予想される。
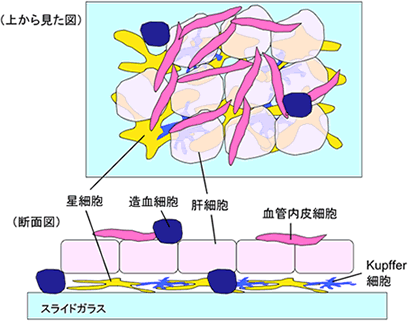
図3 胎児肝臓細胞の初代培養模式図
マウスE12.5肝臓細胞をスライドガラス上で初代培養すると、肝芽細胞は成熟化し(尿素回路酵素を発現)肝細胞シートを形成するが、その下に星細胞やKupffer細胞が位置する。内皮細胞も索状構造をとる。大半の造血細胞は培地交換時に除かれる。
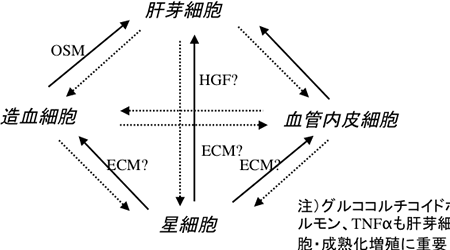
図4 肝発生・分化・組織構築過程における細胞間相互作用ネットワーク
肝発生・分化・組織構築過程で、肝芽細胞、星細胞、造血細胞、血管内皮細胞などの間で細胞間ならびに組織間相互作用が働いている。作用分子群の全貌はまだまだわかっていない。ECM 細胞外マトリックス; HGF 肝細胞増殖因子; OSM オンコスタチンM.
4. 胆管発生における細胞間・組織間相互作用
C/EBPαは肝特異転写因子の一つで、肝芽細胞の肝細胞への成熟化に必須であるが、胆管上皮細胞の分化過程では発現抑制される。その遺伝子欠失マウスの肝臓では肝細胞の成熟化がおこらず、肝臓全体に、胆管形成遺伝子Hnf6やHnf1bを高発現する偽腺管構造が発生する(図1)6)。この結果は、C/EBPαの発現が肝細胞の成熟化に必須であるとともに、発現抑制されることで胆管上皮細胞の分化が進むことを示している。しかし偽腺管構造の多くは胆管前駆構造に似てはいるが、完全な胆管ではない(例えば偽腺管構造の細胞はHNF4を発現する)。この遺伝子欠失マウス肝臓では、胆管上皮細胞はやはり門脈域だけに分化するので、これより胆管分化にはC/EBPαの発現抑制に加え、門脈域からの誘導が重要であることがわかる。誘導因子として、TGFβ/activinやNotchシグナルなどが想定されている(図5)7,8,9)。また、C/EBPαは胆管上皮細胞では発現抑制されるので、胆管形成に不要とも考えうる。そのため遺伝子欠失マウスでは門脈周囲に正常な胆管が形成されてもいいはずだが、実際には細胞分化はおこるものの、きちんとした胆管という形態形成は進行しない。この結果は、肝実質部の成熟化が門脈域の秩序だった組織構築に必要不可欠であることを示唆している。
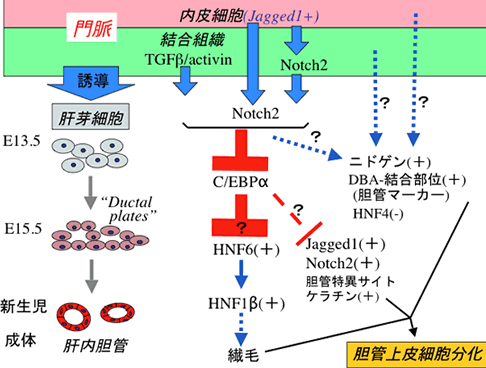
図5 胆管形成誘導メカニズム
胆管上皮細胞が分化する過程で、C/EBPαが発現抑制されることが必要である。その下流に、胆管形成遺伝子HNF6、HNF1βの発現上昇が位置する可能性が高い。門脈からの因子はC/EBPαの発現を抑制するカスケードだけで胆管上皮細胞への分化を誘導するのではない。さらにC/EBPα抑制以外のカスケードもあるようである。
5. 結語
肝発生における組織構築・機能発現では、非常に巧妙な細胞間・組織間相互作用ネットワークが働くが、まだ我々はその氷山の一角を知ったにすぎない。新しい解析技術・視点の研究が精力的に展開され、肝臓発生・分化・組織構築の謎が解き明かされることが望まれる。肝障害や肝再生過程でも、発生期と同様の細胞間相互作用やメカニズムが作動する可能性も非常に高く、発生研究だけにとどまらない、発生から再生そして疾患までをふまえた視点も重要である。ES細胞やiPS細胞から臨床に応用できる肝臓構築を行う上でも、また胎児期の幹細胞をいかに臨床に使えるか考察する上でも、この解説で紹介した細胞間・組織間相互作用をどう保証していくかがキーポイントとなる。
この解説を書く機会を与えていただきました肝細胞研究会世話人代表 吉里勝利先生に、この場を借りて厚くお礼申し上げます。ここで紹介した我々の研究成果は、研究室の学生諸氏との共同研究で得られたものです。
引用文献
- Shiojiri N (1997) Development and differentiation of bile ducts in the mammalian liver. Microsc Res Tech 39: 328-335.
- Shiojiri N, Niwa T, Sugiyama Y et al (2006) Preferential expression of connexin37 and connecxin40 in the endothelium of the portal veins during mouse liver development. Cell Tissue Res 324: 547-542.
- Shiojiri N, Takeshita K, Yamasaki H et al (2004) Suppression of C/EBP α expression in biliary epithelial cells during mouse liver development. J Hepatol 41: 790-798.
- Sugiyama Y, Koike T, Shiojiri N (2007) Immunohistochemical analyses of cell-cell interactions during hepatic organoid formation from fetal mouse liver cells cultured in vitro. Histochem Cell Biol 128: 521-531.
- Nitou M, Sugiyama Y, Ishikawa K et al (2002) Purification of fetal mouse hepatoblasts by magnetic beads coated with monoclonal anti-E-cadherin antibodies and their in vitro culture. Exp Cell Res 279: 330-343.
- Yamasaki H, Sada A, Iwata T et al (2006) Suppression of C/EBPα expression in periportal hepatoblasts may stimulate biliary cell differentiation through increased HNF6 and HNF1b expression. Development 133: 4233-4243.
- McCright B, Lozier J, Gridley T (2002) A mouse model of Alagille syndrome: Notch2 as a genetic modifier of Jag1 haploinsufficiency. Development 129: 1075-1082.
- Tanimizu N, Miyajima A (2004) Notch signaling controls hepatoblast differentiation by altering the expression of liver-enriched transcription factors. J Cell Sci 117: 3165-3174.
- Clotman F, Jacquemin P, Plumb-Rudewiez N et al (2005) Control of liver cell fate decision by a gradient of TGFb signaling modulated by Onecut transcription factors. Genes Dev 19: 1849-1854.










