研究交流
肝臓の組織構築および再生における上皮―神経の相互作用
谷水 直樹
東京大学医科学研究所・幹細胞治療研究センター
1. はじめに
自律神経は消化、代謝、呼吸、血液循環、体温調節など生命にとって最も基本的な生理機能を協調的に調節することで生体恒常性を維持している。肝臓においては、主に代謝機能が自律神経の調節を受けていると考えられている。一方で、肝臓の疾患や再生における機能については充分に理解されていない。我々は、肝臓の発生と再生における上皮組織、特に肝内胆管と肝臓内の自律神経の関係に焦点を当てた解析を行ってきた。これまでの研究で、胆管から分泌されるNerve growth factor (NGF)による肝臓組織内の自律神経ネットワーク形成と再生の制御、神経伝達物質による慢性肝疾患時の胆管リモデリングの制御など、肝臓の発生と再生において上皮-神経の組織間相互作用の役割を明らかにした。本稿では、これまでの研究結果を紹介させていただくとともに、今後肝臓自律神経の機能を明らかにするために必要な研究について考察したい。
2. 肝臓の自律神経についての研究
自律神経系は、組織・臓器から中枢神経系へ情報を伝える求心性神経と、中枢神経系からの指令を組織・臓器に伝える遠心性神経から構成されている。自律神経系の遠心路では、中枢神経系から延びるニューロン(神経細胞)が自律神経節でシナプスを形成して、別のニューロンが効果器に情報を伝える(中枢神経系に細胞体を持つニューロンを節前ニューロン、神経節に細胞体を持つものを節後ニューロンと呼ぶ)。また自律神経系は、活動・緊張をつかさどる交感神経と休息・リラックスをつかさどる副交感神経から構成され、多くの組織・臓器は交感神経と副交感神経の2重支配を受けている。
肝臓では、交感神経刺激によるグリコーゲン分解および糖新生の促進や血管の収縮誘導、副交感神経刺激によるグリコーゲン合成の促進などが報告されている。マウスやラットを用いた研究では、迷走神経の切断による部分肝切除後の肝再生の遅延(1,2)や、神経毒(6-hydroxydopamine)を用いた交感神経除去による肝臓の脂肪化抑制などが報告されている (3)。以上のように、肝臓の生理的機能や代謝性疾患への自律神経の関与が認知されている一方で、肝臓を支配する自律神経ネットワークの形成過程、疾患や再生における上皮組織リモデリングに対する自律神経の寄与などについては充分な解析が行われてこなかった。
3.肝臓発生過程での自律神経ネットワークの形成
3-1.自律神経ネットワークの形成
マウスの成体肝臓組織を観察すると、グリソン鞘内の門脈、肝動脈、肝内胆管の周囲に多くの神経線維を確認できる(図1A)。ヒトでも、門脈、肝動脈、胆管の周囲に神経線維が多く認められるが、マウスとは異なり肝臓の実質領域へも神経線維が伸長している(図1B)。マウスとヒトの神経分布の違いについては、マウスなどでは肝細胞間のGap junctionが発達しており、そのGap junctionを介したシグナルの受け渡しが神経伝達を補完していると考えられているようである。肝臓組織内の自律神経の解剖学的特徴や肝臓の生理機能との関係は、肝細胞研究会ホームページに掲載されている和気先生の総説で非常に詳しく解説されているので、そちらを参照していただきたい(肝臓―温故知新「肝臓支配の自律神経系と臓器相関」)。我々は、神経線維が肝内胆管周囲に多く局在していることに着目し、肝臓の組織構造形成過程における胆管と自律神経ネットワーク形成の相関関係について解析を行った。
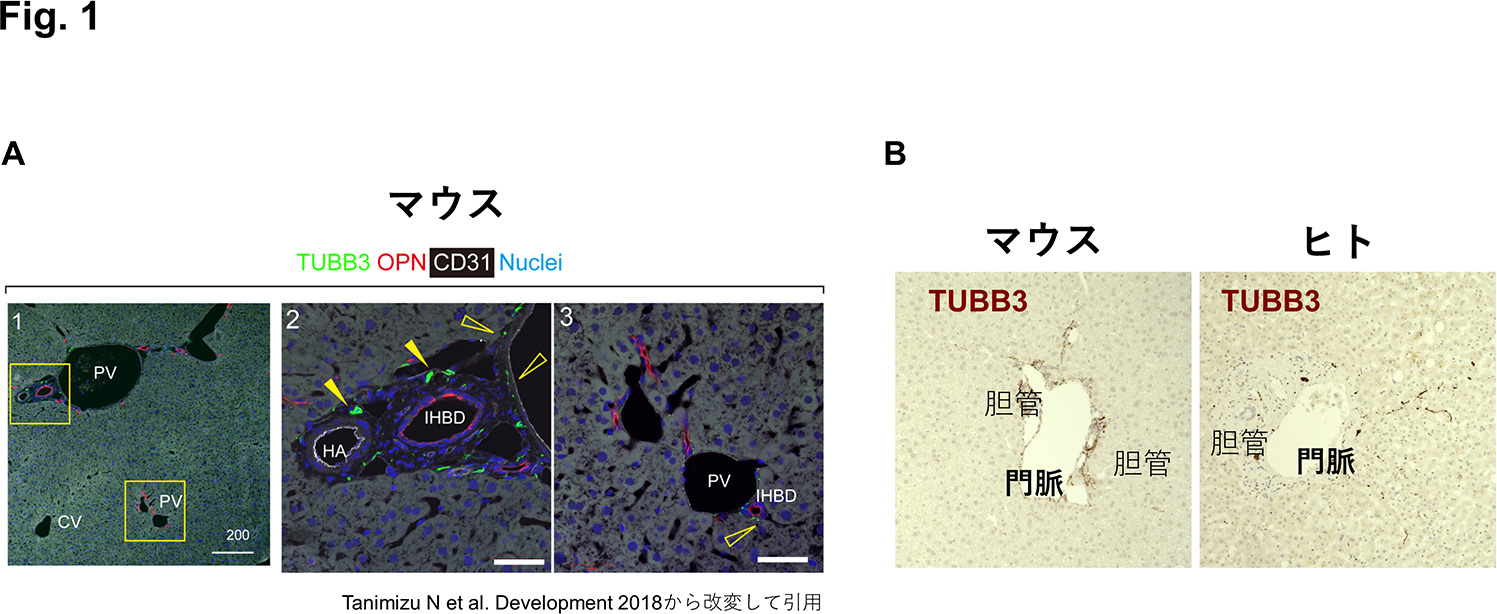
図1.マウスおよびヒト肝臓内の神経線維の局在
A) 成体マウスでは門脈域の血管および胆管周囲に神経線維が分布している。IHBD: 肝内胆管、HA :肝動脈
B) マウス、ヒトともに、門脈周囲に多くの神経線維が存在している。ヒトでは、実質領域にも神経線維が分布している。ヒトサンプルは旭川医科大学西川先生より御提供いただいた。
マウス肝臓は胎生8日頃に腹側前腸内胚葉から発生するが、肝細胞や胆管上皮細胞からなる上皮組織構造の形成は胎生中期以降に始まり、胎生後期から新生仔期にかけての期間に肝内胆管ネットワークや肝細胞の毛細胆管ネットワークなど、成体に近い組織構造が完成する(4-6)。上皮組織構造形成と神経ネットワーク形成の関係を知るために、神経線維Pan markerであるβ3チューブリン (β3-tubulin (TUBB3))に対する抗体を用いてマウス胎仔肝臓の解析を行ったところ、毛細胆管や胆管構造の形成が進行している胎生17日の胎仔肝臓内に神経線維は認められなかった(図2A)。一方、出生後2〜3日には肝門部に近い門脈周囲に神経線維が認められるようになり、生後3週間後にはほぼ肝組織全体に神経ネットワークが張り巡らされていた(図2B)。神経伸長に関わると考えらえるNerve growth factor (NGF)の発現細胞を調べたところ、肝内胆管を構成する胆管上皮細胞および門脈線維芽細胞(Portal mesenchymal cell, PMC) がNGFを発現していた。また、発生過程における胆管上皮細胞のNGF発現変化を検証したところ、生後5から7日の間にNGF発現が上昇していた(図2C)。また、新生仔肝臓内の神経はNGFレセプターであるNeurotrophic Receptor Tyrosine Kinase 1 (Ntrk1/TRKA) を発現していた(図2D)。以上の結果から、新生仔期に胆管細胞からNGFが分泌されることで肝組織内に神経が伸長すると考えた(図3上)。NGFによる神経伸長については、成体マウス肝細胞にNGFを強制発現させた際に、門脈周囲に集積していた神経が肝実質内に進展し、一部は中心静脈付近まで達する実験結果からも支持された(図4)(7)。
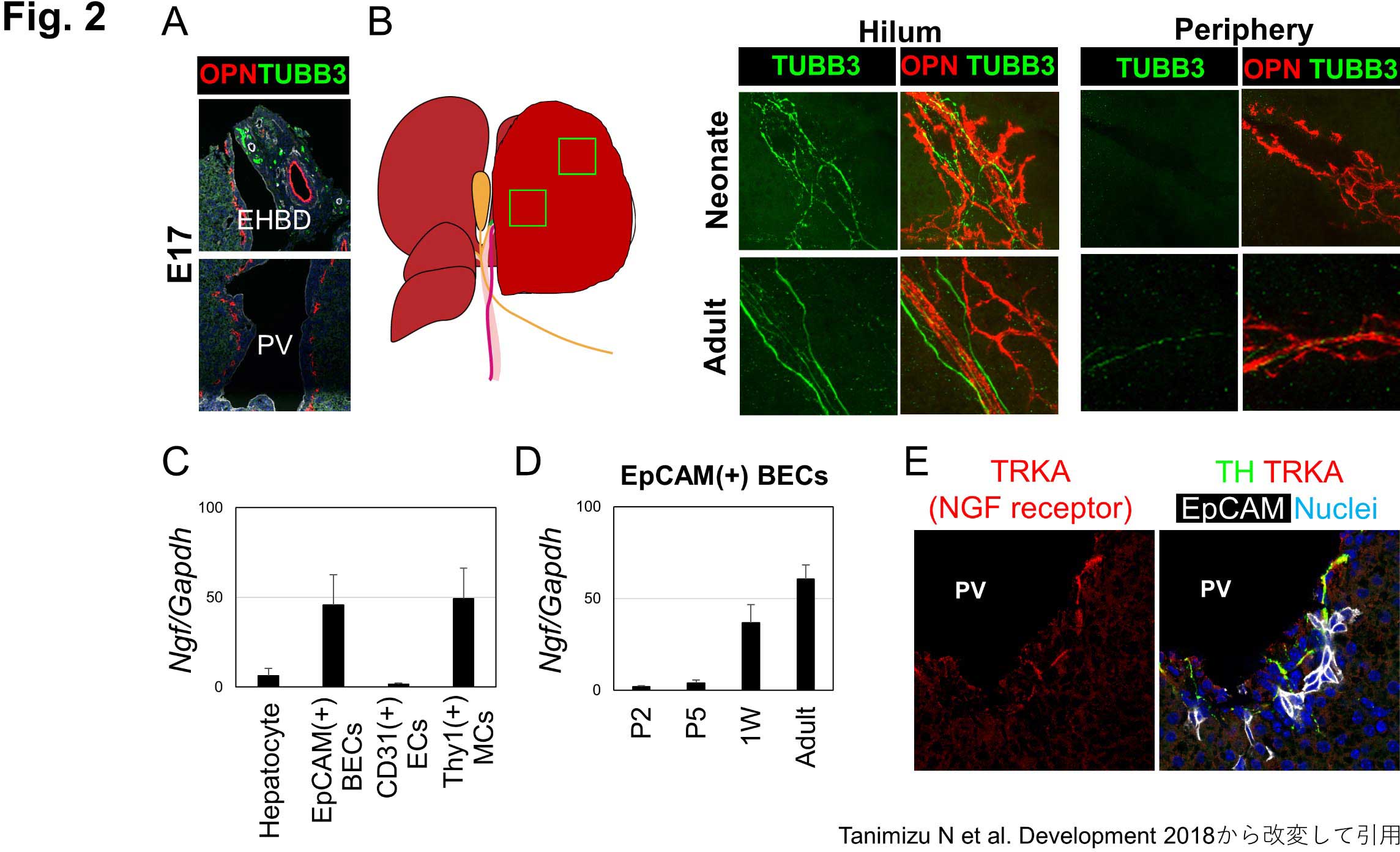
図2.マウス発生過程での肝内自律神経ネットワーク形成
A) E17の胎仔では肝外胆管周囲に神経線維が認められるが、肝臓内には神経線維は存在しない。
B) 生後1週間の新生仔肝臓では、肝門部に近い領域まで神経線維が伸長している。成体マウス肝臓では、辺縁部でも胆管と神経線維が並走している。
C) 成体マウスの肝臓構成細胞のうち、EpCAM(+)胆管上皮細胞とThy1(+)門脈周囲線維芽細胞(PMC)がNgfを発現している。
D) 胆管上皮細胞では生後5日から1週間の間にNgf発現が上昇する。
E) 生後1週間の新生仔肝臓の神経はTRKAを発現している。
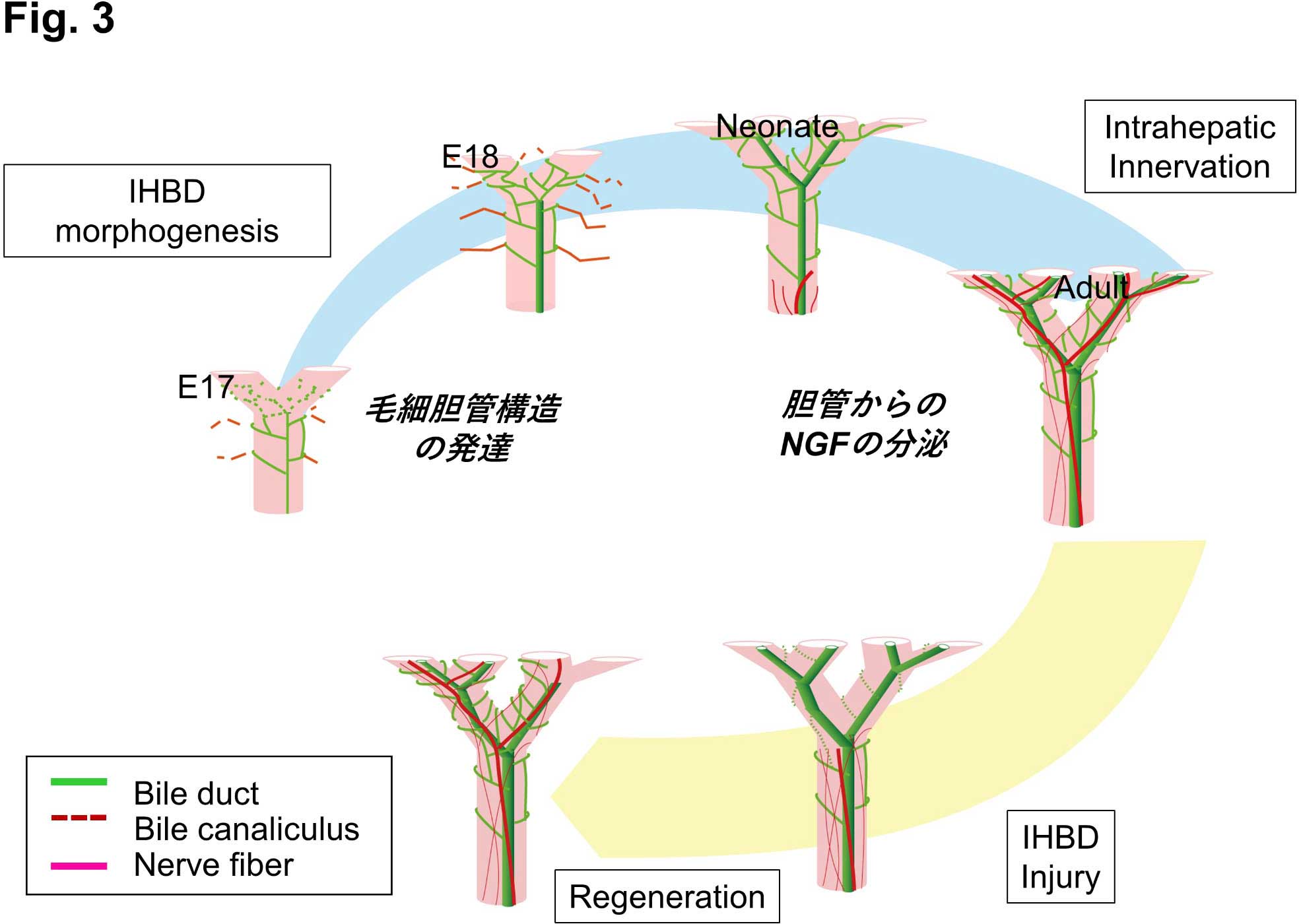
図3.肝発生および再生における神経ネットワーク形成と再構築
胎生後期に毛細胆管および胆管ネットワークが発達するが、それに引き続いて胆管から分泌されるNGF依存的に肝内に神経線維が伸長する。胆管が障害されると、神経も退縮するが、胆管再生後に神経ネットワークも再構築される。

図4.異所性のNGF発現による神経ネットワークのリモデリング
A) Hydrodynamic tail vein injectionによって肝細胞にNGF発現ベクターを導入した。
B) NGF強制発現の結果、神経線維が実質領域にも認められるようになり、一部の神経線維は中心静脈近傍まで達していた。
3-2.肝臓内の交感神経と副交感神経
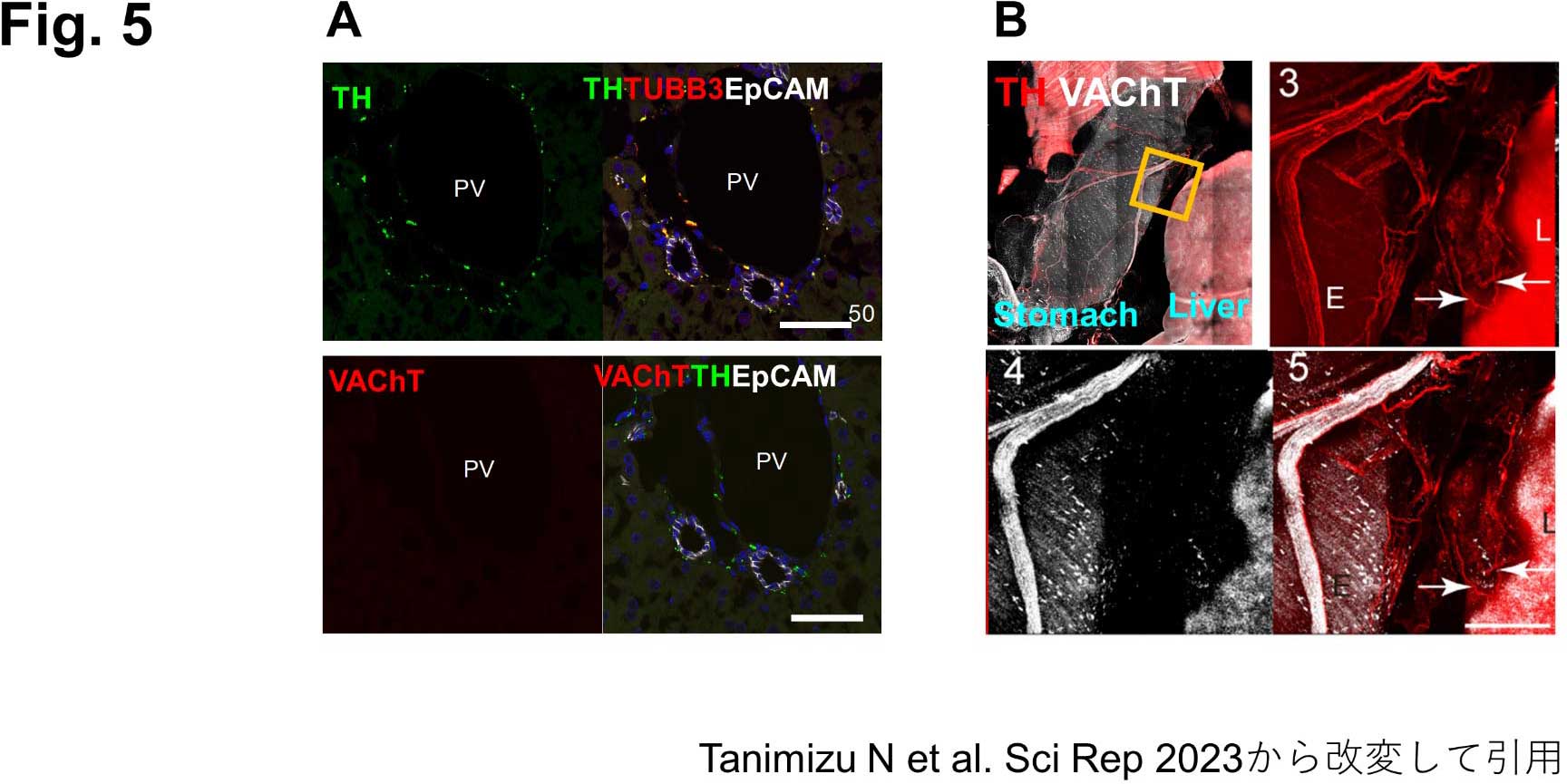
冒頭にふれたように、多くの組織・臓器では、交感神経と副交感神経のバランスによって恒常性が保たれている。肝臓組織内にも両者が存在していると考え、交感神経であるノルアドレナリン作動性神経と副交感神経であるアセチルコリン作動性神経の局在を調べた。アドレナリン作動性神経マーカーであるTyrosine hydroxylase (TH)に対する抗体で組織染色を行うと、肝臓組織内のほぼすべての神経線維が染色されたが、Vesicular acetylcholine transporter (VAhCT)に対する抗体で染色される神経線維は確認できなかった(図5A)。食道に沿って走行する迷走神経から分枝する神経線維が肝内組織へ侵入する様子を観察してみたところ、迷走神経に沿って走行する交感神経が肝臓方向に分枝していた。一方で、明確に副交感神経と考えられる神経線維は肝臓方向へは分枝していなかった(図5B)(8)。これらの結果は、最近の論文で報告されたマウス、ヒト、サルの肝臓内神経ネットワークを構成するのは交感神経であることを示す3次元イメージングデータと一致していた (9,10)。
A) 門脈周囲に認められる神経線維は副交感神経マーカーVAChT(-)で交感神経マーカーTH(+)である。
B) 食道に沿ってVAChT(+)迷走神経束とTH(+)交感神経が走行している。TH(+)神経線維は肝臓方向へ分枝している(矢印)。
4. 肝再生における上皮―神経相互作用の解析
4-1.胆管から神経への作用
マウスに対して4',4'-diaminophenylmethane (DAPM)を腹腔内投与すると、胆管構造が一過性に破壊される。我々が行った実験では、特に肝臓の辺縁部で胆管消失が顕著に認められ、胆管が消失した領域には神経線維も存在しなかった(図6A)。DAPM投与48時間以降には胆管再生が始まり、それに伴って肝内神経ネットワークも再構築された。DAPM障害後の再生肝臓で一過性にNGF発現が上昇していた(図6B)。また、TRKAの阻害剤であるGW441756あるいはGNF5837投与によって神経再生が阻害された (図6C&D)。以上の結果から、再生した胆管から分泌されるNGFが神経線維の伸長を促し、肝内神経ネットワーク再構築を誘導していると考えた (図3下)(7)。
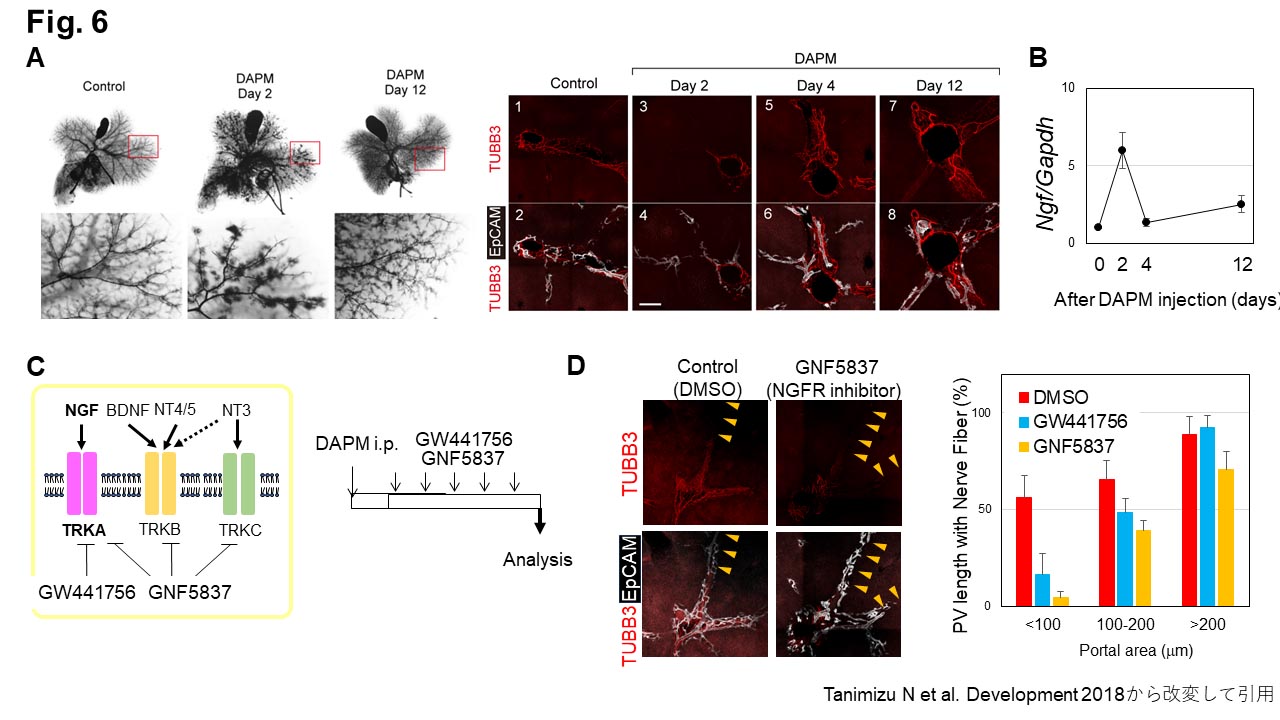
図6.急性胆管障害後の再生における神経ネットワークの再構築
A) DAPM投与によって特に細胆管が破壊されるが、2週間後には胆管ネットワークが再構築されていた。EpCAM(+)胆管が減少している領域ではTUBB3(+)神経線維も減少しているが、胆管の再生と共に神経も再生していた。
B) DAPM投与2日後に、一過性に肝臓組織でのNGF発現量が増加していた。
C) DAPM投与後にTRK(NGF receptor)の阻害剤であるGW441756もしくはGNF5837を投与し、神経再生への影響を検証した。
D) 阻害剤投与によって、胆管再生後も肝内神経ネットワークが再構築されていない領域(黄色矢頭)が増加していた。
胆管が増生する慢性肝疾患モデルにおいては、胆管増生に伴って神経ネットワーク構造がDynamicに変化する。マウスに3,5-diethoxycarbonyl-1,4-dihydrocollidine(DDC)餌を与える慢性肝疾患モデルでは、胆管増生とそれに伴う神経線維の増加が認められた(図7A)(8)。しかしながら、大型の胆管が豊富な肝門部側の門脈周囲において神経線維の増加が顕著である一方で、辺縁部側の門脈周囲では神経線維が認められない場合もあった。高脂肪食投与で誘導される脂肪肝モデルでも胆管増生は認められるが、最近の論文ではクッパー細胞から分泌されるTNFαの影響によって神経線維が退縮することが報告されている(9)。慢性肝障害時の上皮組織リモデリングにおける肝内神経ネットワーク構造の変化については、肝障害の種類や程度、肝組織内の領域による周囲環境の違いなどが影響すると考えられる(11)。今後、肝臓のLobe全体を対象にするような3次元イメージング手法を用いた解析を行う必要があると考えている。

図7.慢性肝障害に伴う胆管および神経の増生
A) マウスDDC肝障害モデルでは、CK19(+)肝内胆管が増生し、その周囲でTH(+)神経線維も増加している。100μm thickの組織切片の共焦点画像をstackして示した。
B) 肝臓構成細胞のうち、CD31(+)Endothelial cell, Thy1(+)portal mesenchymal cell, EpCAM(+) cholangiocytes, HSC, MHがadrenergic receptor (Adr) mRNAを発現している。MHは低速遠心後にpercoll遠心で生細胞を分取した。HSCはOptiprepを用いた濃度勾配遠心によって分取した。
4―2.神経から胆管への作用
マウスDDC混餌モデルで胆管増生が顕著であるが、それに加えて神経線維の増加も認められた(図7A)。図4に示したように肝内自律神経は交感神経であるという事実を踏まえ、慢性障害時上皮リモデリングへの交感神経の関与を調べた。胆管上皮細胞にはβアドレナリン受容体(βADR)が強く発現していたことから(図7B)、マウス皮下にβADRアゴニストであるIsoproterenol (ISO)を投与し、胆管増生への影響を検証した(図8A)。その結果、ISO投与によって胆管増生が促進されることがわかった (図8B&C)。ISO投与によって胆管の管腔拡張と細胞増殖の亢進も認められた(図8D&E)。一方で、βADRのアンタゴニストであるPropranolol (PPL)投与によるアドレナリン受容体阻害あるいは6-hydroxydopamine投与による交感神経除去では、胆管増生が抑制される傾向にあった。以上のことから、交感神経からの刺激によって慢性肝障害時に胆管増生が促進されることが示された。
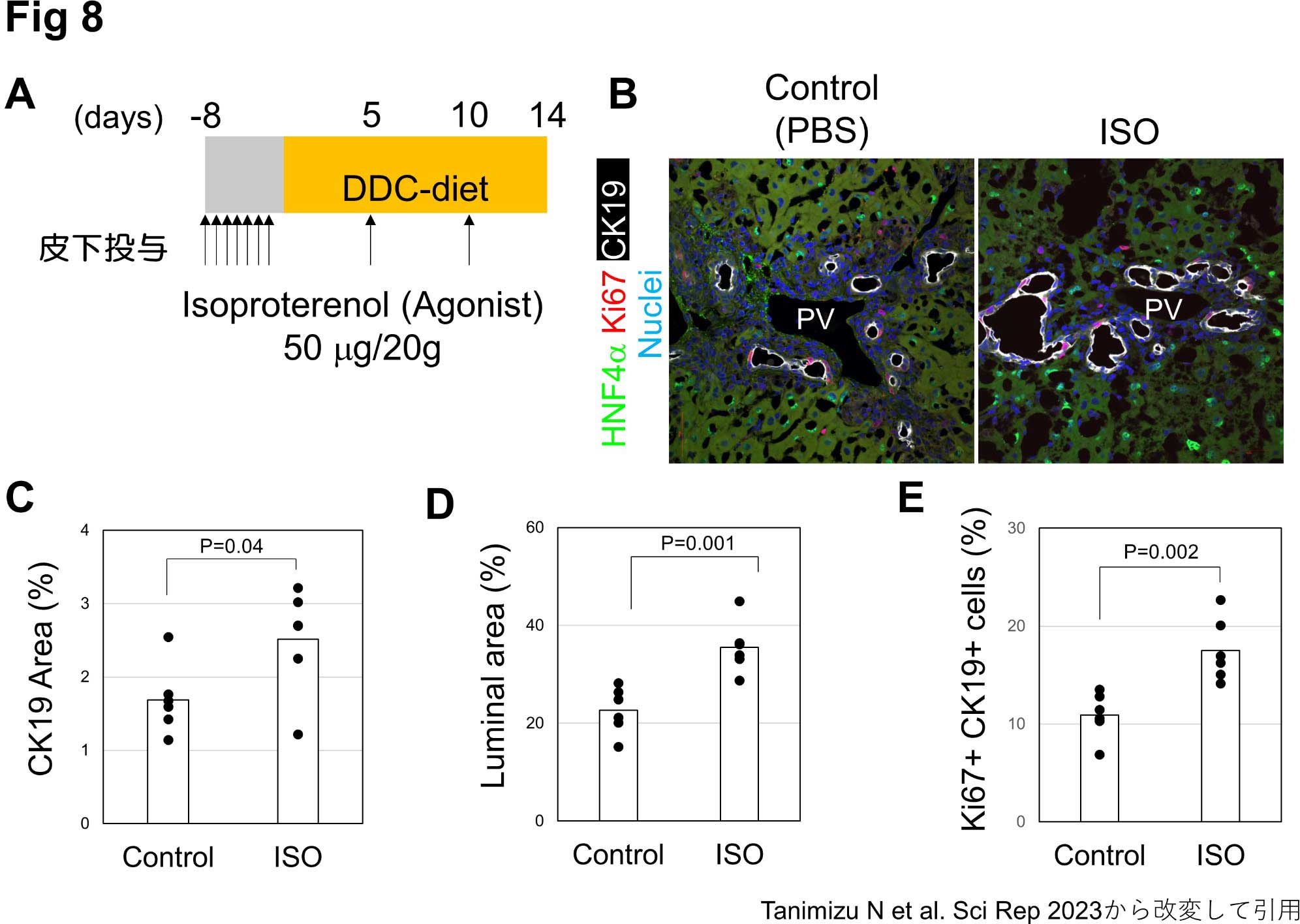
図8.β-Adrenergic receptor活性化による胆管増生の促進
A) マウス腹腔にIsoproterenol(ISO)を投与し、DDC-dietを与えた
B) ISO投与群の門脈周囲ではCK19(+)の胆管が増加している。
C) ISO投与群でCK19(+) areaが有意に増加している。
D) ISO投与群では胆管管腔が有意に拡張している。CK19(+)構造の外縁に囲まれた領域の面積と管腔面積を定量し、管腔が占める割合をしめしている。
E) ISO投与群でKi67(+)胆管上皮細胞が有意に増加している。
βADR活性化による胆管増生のメカニズムを明らかにするために、胆管上皮細胞と神経終末の位置関係を調べるともに、in vitro培養系を用いてISOによる胆管上皮細胞の増殖や形態形成への影響を検討した。免疫染色の結果から、胆管上皮細胞の基底膜面近傍にSynaptophysin(+)の神経終末が存在していた(図9A)。平面培養において、ISOは胆管上皮細胞に直接作用して細胞内cAMP濃度を上昇させるが(図9B)、増殖は亢進しなかった。一方、胆管上皮細胞が管腔を伴うオルガノイドを形成する3次元培養では、ISO添加後に管腔拡張の促進が認められ(図9C&D)、その後に細胞増殖が誘導された(図9E)。ISOによる管腔拡張およびその後に誘導される細胞増殖は、いずれも胆管管腔への分泌に関与するCFTRの阻害剤によって抑制された(図9C-E)。
胆管と肝内神経線維の配置を解析したところ、比較的小型の胆管では神経線維が胆管上皮細胞の近傍で神経終末構造を形成しているのに対して、大型の胆管では神経線維の多くは胆管周囲の門脈域線維芽細胞(PMC)の層にとどまっていた(図9F)。そこで神経がPMCに作用している可能性を考えて、単離したPMCにISOを添加したところ、細胞内でcAMPが上昇しISO反応性であることが確認された(図9G)。さらに、ISO刺激を行ったPMCの培養上清を回収し、胆管上皮細胞の培養に添加する実験を行ったところ、胆管上皮細胞の増殖が促進された(図9H&I)。PMC培養上清の増殖促進作用は抗FGFR2抗体の存在下では減弱したことから、PMCが分泌することが報告されているFGF7 (12) などが増殖促進効果を担っていると考えられる。
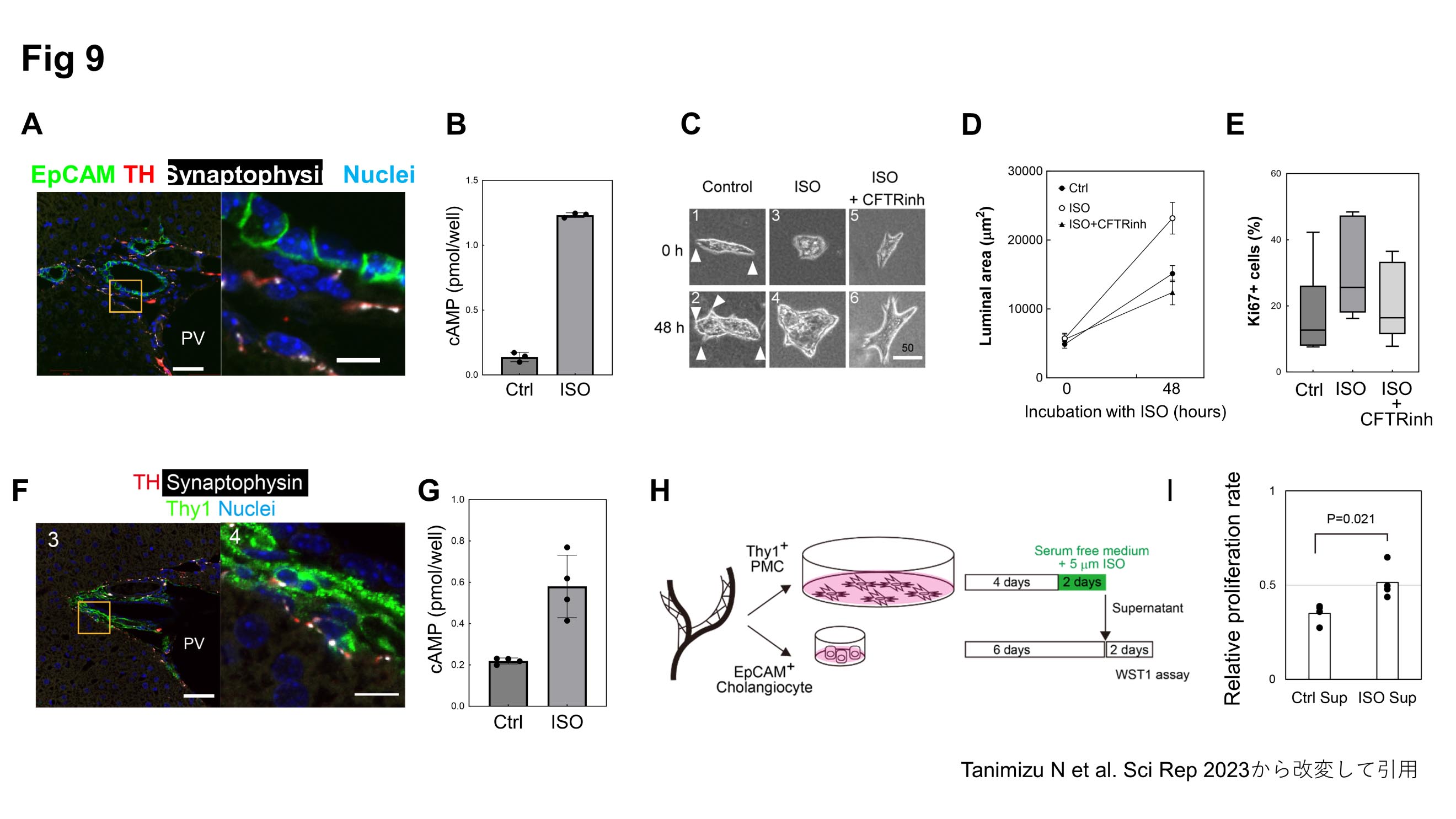
図9.胆管上皮細胞と門脈周囲線維芽細胞に対するβADRアゴニスト(ISO)の作用解析
A 胆管上皮細胞の基底膜面近傍にSynaptophysin(+)神経終末が認められた。
B 培養した胆管上皮細胞にISOを添加すると、細胞内cAMP濃度が上昇した。
C 胆管上皮細胞をコラーゲンゲルに埋め100ng/ml HGF存在下で培養したところ、管腔と突起構造(矢頭)をもつ胆管オルガノイドが形成された。
D ISO添加によってオルガノイドの管腔拡張が誘導され、CFTR阻害剤(CFTRinh)によってISOの作用はキャンセルされた。
E 管腔拡張に加えて、ISO添加によってオルガノイド構成細胞のKi67(+)増殖細胞が増加した。増殖促進作用もCFTRinhによってキャンセルされた。
F 門脈周囲線維芽細胞(PMC)近傍にSynaptophysin(+)神経終末が認められた。
G 培養したPMCにISOを添加すると、細胞内cAMP濃度が上昇した。
H PMCの培養上清を濃縮し、胆管上皮細胞の培養液に加えた。
I ISO付加したPMC培養上清は、胆管上皮細胞に対して増殖促進作用を示した。
以上の結果から、交感神経は胆管上皮細胞への直接作用によって管腔拡張を介した細胞増殖を促す一方、PMCからの増殖因子分泌を誘導することで、胆管増生を促進する役割を担っていることが明らかになった (図10)(8)。
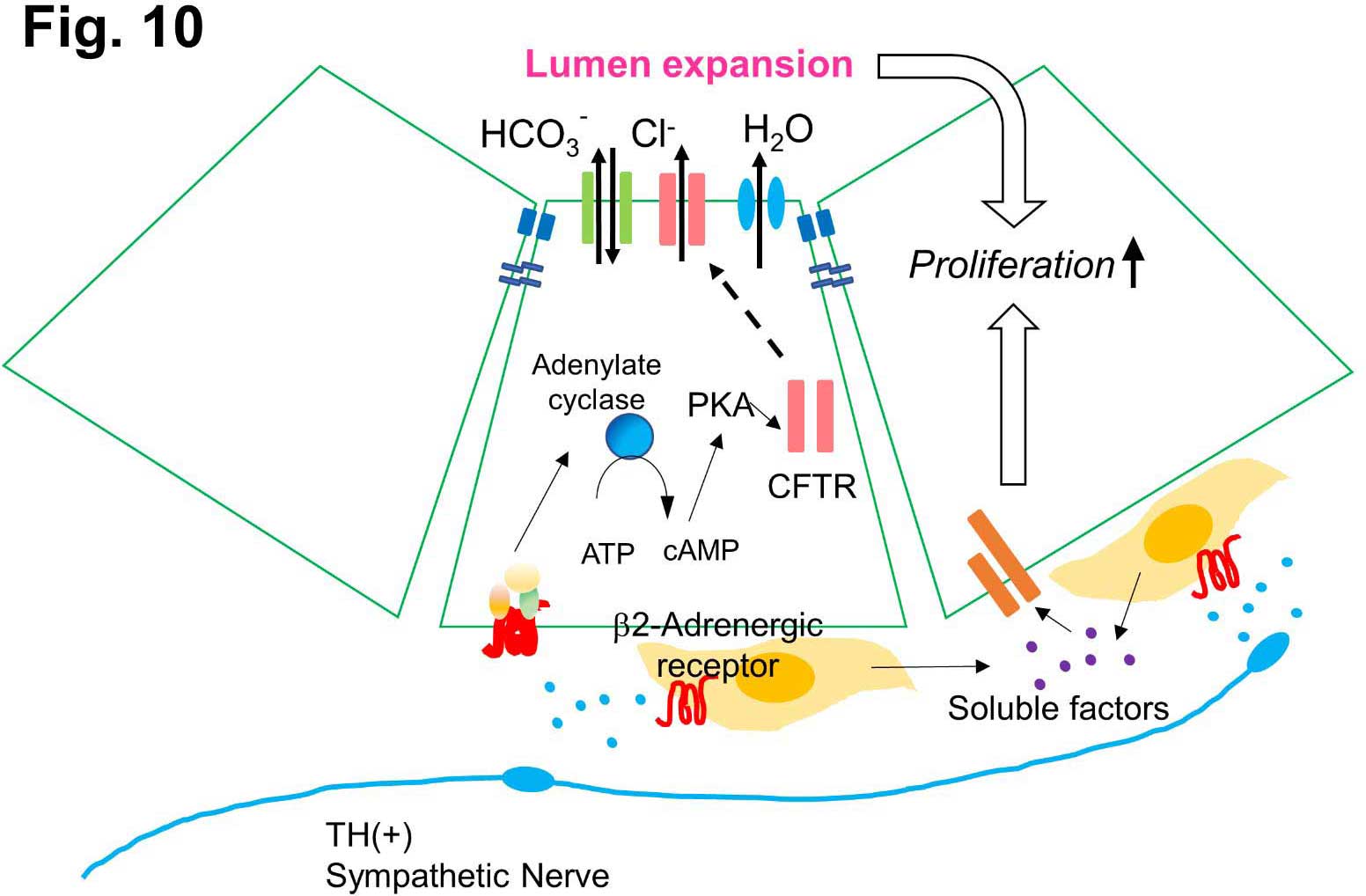 図10.βADRアゴニストによる胆管増殖の制御
図10.βADRアゴニストによる胆管増殖の制御
胆管上皮細胞のβADRが活性化すると細胞内cAMP濃度が上昇し、CFTRがアニオントランスポーターおよびAquaporinと共にアピカル面に輸送されると考えられる。管腔への液輸送が増加して内圧が高まる結果、増殖が亢進する。PMCのβADRも活性化され、胆管上皮細胞に作用する増殖因子産生が誘導される。これら複数の要因によって、胆管上皮細胞の増殖を伴う胆管増生が亢進する。
5.これまでの研究で明らかになった肝臓上皮―神経の相互作用
我々は、マウス疾患モデルとin vitro実験系を用いて、交感神経と胆管上皮細胞との相互作用を解析した。発生過程では、毛細胆管や胆管など上皮構造の基本構造が完成した後に胆管上皮細胞から分泌されるNGF依存的に肝内に交感神経が伸長し肝内神経ネットワークが形成される。急性胆管障害後には、胆管再生後に肝内神経ネットワークが再構築される。一方、慢性肝障害時には、交感神経の神経伝達物質が胆管構成細胞に作用し、胆管の管腔拡張とPMCからの増殖因子分泌を誘導することで、胆管上皮細胞の増殖が促され、その結果、胆管増生が亢進することが明らかになった。以上のように、肝臓の上皮-神経間には双方向性の相互作用が存在し、発生・再生における組織構造構築・再生に寄与することが明らかになった(図11)。
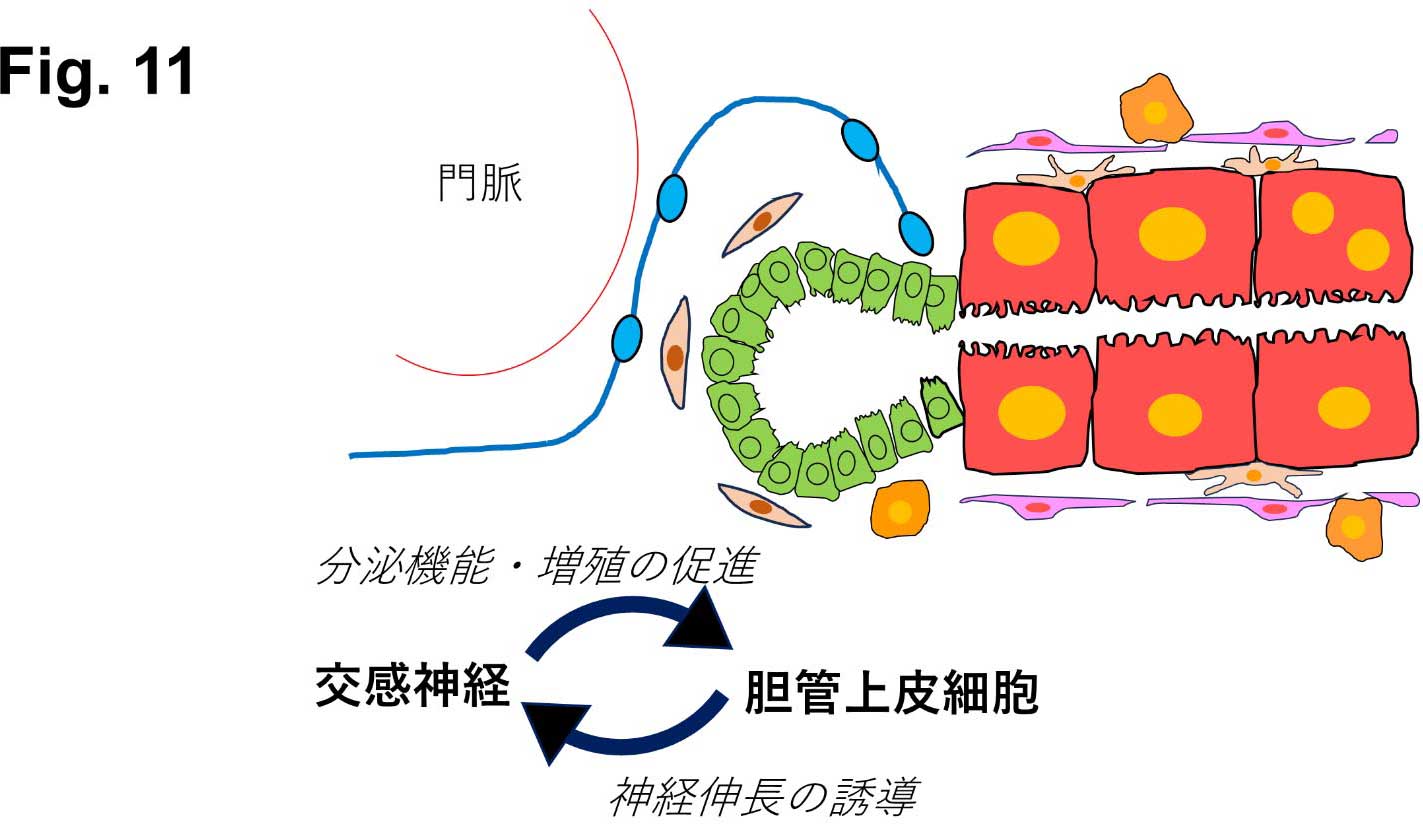 図11.肝内交感神経と肝構成細胞間の相互作用
図11.肝内交感神経と肝構成細胞間の相互作用
胆管上皮細胞はNGF発現を介して交感神経伸長を誘導し、交感神経は神経伝達物質(主にNoradrenaline)を介して胆管上皮細胞の分泌機能および増殖を亢進する。交感神経のレセプターはクッパー細胞や星細胞にも発現している。疾患や再生においては、交感神経はそれらの細胞の挙動にも影響を与えていると考えられる。
6. おわりに
我々は、胆管上皮細胞とPMCが発現するβADR活性化を介した現象を対象として肝臓の上皮―神経相互作用を解析してきた。一方、肝臓構成細胞には、胆管上皮細胞およびPMC以外にも、ADRを発現している細胞が存在している。したがって、肝臓組織のリモデリングへと視野を広げると、複数の細胞への影響を考慮して交感神経の役割を理解する必要がある。我々は胆管増生に伴う肝線維化についても解析を始めており、ADR agonist投与が肝線維化に影響を与えることを示唆するデータを得ている。他の研究グループからの報告でも、交感神経が胆管機能や障害に影響を与えること(13,14)や、障害後の線維化へ影響を与えること(15)などが報告されている。今後、肝臓内の交感神経と複数の肝構成細胞の間に存在する複雑な細胞・組織間ネットワークを明らかにすることで、交感神経調節による線維化の抑制や肝再生の促進などを可能にすることが目標である。
References
- . Otake M, Sakaguchi T, Yoshida K, Muto T. Hepatic branch vagotomy can suppress liver regeneration in partially hepatectomized rats. HPB Surg 1993 6(4):277-86.
- . Ikeda O, Ozaki M, Urata S, Matsuo R, NaokanoY, Watanabe M. et al. Autonomic regulation of liver regeneration after partial hepatectomy in mice. J Surg Res. 2009 152(2):218-23.
- Hurr C, Simonyan H, Morgan DA, Rahmouni K. Young CN. Liver sympathetic denervation reverses obesity-induced hepatic steatosis J Physiol 2019597(17):4565-4580
- Zaret KS and Grompe M Generation and regeneration of cells of the liver and pancreas Science 2008 322(5907):1490-4.
- Tanimizu N, Kaneko K., Itoh T, Ichinohe N, Ishii M, Mizuguchi T, Hirata K, Miyajima A, and Mitaka T. Intrahepatic bile ducts are developed through formation of homogeneous continuous luminal network and its dynamic rearrangement. Hepatology 2016 July;64(1):175-88.
- Belicova L Repnik U, Delpierre J, Gralinska E, Seifert S, Valenzuela JI et al. Anisotropic expansion of hepatocyte lumina enforced by apical bulkheads J Cell Biol 2021, 4;220(10):e202103003.
- Tanimizu, N., Ichinohe, N., and Mitaka, T. Intrahepatic bile ducts guide establishment of the intrahepatic nerve network in developing and regenerating mouse liver. Development 2018 Apr 25;145(9) dev159095.
- Tanimizu N Ichinohe N, Mitaka T. β-adrenergic receptor agonist promotes ductular expansion during 3,5-diethoxycarbonyl-1,4-dihydrocollidine-induced chronic liver injury.Sci Rep 2023, 13(1):7084.
- Liu K Yang L, Wang G, Liu J, Zhao X, Wang Y et al. Metabolic stress drives sympathetic neuropathy within the liver.Cell Metab 2021 33(3):666-675
- Adori C Daraio T, Kuiper R, Barde, S, Horvathova L, Yoshitake T. et al. Disorganization and degeneration of liver sympathetic innervations in nonalcoholic fatty liver disease revealed by 3D imaging Science Adv 20217(30):eabg5733
- Mizuno K et al. Intrahepatic distribution of nerve fibers and alterations due to fibrosis in diseased liver. Plos One 2021 16(4):e0249556.
- Takase H, Itoh T, Ino S, Wang T, Koji T, Akira S.et al. FGF7 is a functional niche signal required for stimulation of adult liver progenitor cells that support liver regeneration Genes Dev 2013 27(2):169-81
- Glaser S Alvaro D, Francis H, Ueno Y, Marucci L, Benedetti A, et al. Adrenergic receptor agonists prevent bile duct injury induced by adrenergic denervation by increased cAMP levels and activation of Akt.J Physiol Gastrointest Liver Physiol 2006, 290(4):G813-26.
- . Alpini G Franchitto A, Demorrow S, Onori P, Gaudio E, Wise C,et al. Activation of alpha(1) -adrenergic receptors stimulate the growth of small mouse cholangiocytes via calcium-dependent activation of nuclear factor of activated T cells 2 and specificity protein 1. Hepatology 2011, 53(2):628-39
- Xue J Jiang T, Humaerhan J, Wang M, Ning J, Zhao H.et al. Impact of Liver Sympathetic Nervous System on Liver Fibrosis and Regeneration After Bile Duct Ligation in Rats J Mol Neurosci 2024 74(1):4