肝臓:温故知新
肝臓支配の自律神経系と臓器相関
和氣健二郎
東京医科歯科大学名誉教授、大阪市立大学名誉博士;
同大学院医学研究科客員教授、(株)ミノファーゲン製薬顧問
はじめに
肝臓は自律神経(植物神経)系によって制御されている。肝臓支配の自律神経系は自律神経の中枢である視床下部を介して内分泌系によるのみならず、求心性・遠心性の神経ネットワークによって肝臓—他臓器相関に重要な役割を演じていることが明らかにされてきた。
I. 自律神経系、総論
1) 研究史
アレキサンドリア医学のヘロビオス (BC 325 - ) はアリストテレスの心臓中心説を排して、精神の中心を脳におき、「紐」という意味の‘nervus’を「神経」に当て、神経を運動と知覚の2系に分けた。ガレノス(AD 129 - )は長い神経は何箇所かで線維を中断させ、その部分は結節腫(ガングリオン)に似ていると記述している。その実態は後年明らかにされた交感神経節をみていたと思われる。ウィリス環の発見者、Thomas Willis(1621 - 1675)は不随意運動を随意運動から区別し、その実体を迷走神経とは異なる交感神経(当時はintercostales「助間神経」と呼ばれた)によるとした。ウイリスはユウスタキオとともに交感神経の発見者と言われている。
18世紀にはJ.B.Winslow (1732)はintercostalesの一部が心臓へ神経を送り、さらに複雑な神経網をつくって身体の一部と他の部分とが互いに影響を及ぼし合っていると考え、この作用を「交感、sympathy」と呼び、それに関与する神経を「大交感神経系、systéme nerveux grand symathique」と命名した。この名称は時代とともに「交感神経系」と呼ばれるようになった。交感神経系はもっぱら身体の植物性機能を支配する神経で、内部環境を自動的に調節するので「植物性神経系、vegetatives Nervensystem」(Reil,1807)とも呼ばれた。Claude Bernard (1852)が自律神経の血管作動性を発見してから自律神経に対する関心は急速に高まった。 薬理実験の結果から胸髄-腰髄 (交感) 及び脳幹-仙髄(副交感)の2群が大別された。両者の相互作用(異化-同化)から、その神経系をW.H.Gaskell (1916)は「不随意神経系、involuntary nervous system」と呼び, J.N.Langley (1898)は「自律神経系、autonomic nervous system」の名称を提唱した。H.Laborit(1952)は自律神経の作用を「環境拮抗的、orthosympathetique」と「環境服従的、parasympathetique」の対立する2作用に分けた。
2) 自律神経の定義
体内の器官には感覚と運動に働く動物性器官(体壁系器官)と栄養、循環、生殖に関与する植物性器官(内蔵系器官)がある。自律神経(植物性神経)は後者を支配する神経系である。自律神経系の対象を器官のレベルから組織・細胞のレベルにまで下げてみると、結局、自律神経とは体内の平滑筋・心筋並びに腺の機能をコントロールする神経系と言える。その作用は無意識下に行われ、内分泌系と協調して、身体のホメオスターシスの維持に働く。
3) 自律神経系の構成
自律神経系は交感神経系と副交感神経系からなり、各系は効果器に対して拮抗的(促進的、または抑制的)に働くが、臓器によってはその効果は逆転する。自律神経線維には遠心性線維と求心性(知覚性) 線維がある。遠心性神経は脊髄や脳幹に存在する神経細胞から発した軸索「節前神経線維、外来性神経系extrinsic nervous system」が末梢組織内の神経節で「節後神経、固有神経系,intrinsic nervous system」とシナプスを形成する。節後線維は効果器官、またはその周囲に終る。節前と節後の軸索の長さを比較してみると、交感神経では節前線維の細胞体は脊髄にあり、その中継点である交感神経節は脊髄に近く位置しているために、節前線維の軸索は短い。逆に副交感神経の起始は脳幹にある一方、神経節は効果器に近く分布するので、その節前線維は長く、節後線維は短い。このように自律神経系では交感神経、副交感神経を問わず、シグナルはそれぞれの神経節のシナプスで一胆中断されるのでJRに例えてみれば在来線、一方体壁系の運動神経は脊髄前角から骨格筋へ直接到達するのでノン・ストップの新幹線と言えよう。
交感神経の走行
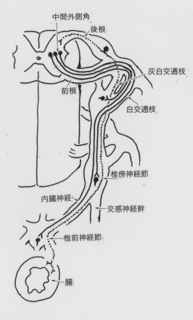 交感神経の節前線維(図、実線)の細胞体は胸髄と上部腰髄の側角(中間外側角)にあり、軸索は前根から白交通枝を経由したのち節後神経とシナプスを形成する。その部位は3カ所で、1)椎傍交感神経節、2)交感神経幹から分枝した内蔵神経を経由して到達する椎前神経節、3)効果器官の被膜を取り巻く壁外神経節、或いは壁内神経節である(図参照)。 遠心性副交感神経線維(図、破線)の細胞体は延髄と仙髄(S3−S4)に分かれて分布している。延髄では迷走神経背側運動核と疑核の内側にあって、その節前神経線維は迷走神経vagusの一部を構成して、食道、気管、肺、心、小腸、肝、膵などの広い範囲を迷走 (wandering)する。その終末は臓器の被膜やその周囲に散在する神経節細胞とシナプスをつくる。一方仙髄側角から出る節前線維は骨盤神経を経由し、交感神経節を素通りして直接、直腸、膀胱,前立腺(男性)、子宮(女性)両側に位置する骨盤神経節内で節後交感神経線維と混ざり合い胆嚢、大腸、直腸、膀胱、生殖器を支配する。
交感神経の節前線維(図、実線)の細胞体は胸髄と上部腰髄の側角(中間外側角)にあり、軸索は前根から白交通枝を経由したのち節後神経とシナプスを形成する。その部位は3カ所で、1)椎傍交感神経節、2)交感神経幹から分枝した内蔵神経を経由して到達する椎前神経節、3)効果器官の被膜を取り巻く壁外神経節、或いは壁内神経節である(図参照)。 遠心性副交感神経線維(図、破線)の細胞体は延髄と仙髄(S3−S4)に分かれて分布している。延髄では迷走神経背側運動核と疑核の内側にあって、その節前神経線維は迷走神経vagusの一部を構成して、食道、気管、肺、心、小腸、肝、膵などの広い範囲を迷走 (wandering)する。その終末は臓器の被膜やその周囲に散在する神経節細胞とシナプスをつくる。一方仙髄側角から出る節前線維は骨盤神経を経由し、交感神経節を素通りして直接、直腸、膀胱,前立腺(男性)、子宮(女性)両側に位置する骨盤神経節内で節後交感神経線維と混ざり合い胆嚢、大腸、直腸、膀胱、生殖器を支配する。
自律神経の伝達物質
交感、副交感神経ともに節前神経線維の終末から放出される伝達物質はアセチールコリンである。効果器組織内に分布する節後線維は盛んに分枝し、枝に沿って多数の小さな膨らみvaricosityを造る。Varicosityと効果器細胞との間隙は不規則で、必ずしも典型的なシナプス構造を呈するとは言えない。Varicosity内には伝達物質が含まれ、刺激を受けると交感神経ではノルエピネフリン、副交感神経ではアセチールコリンを放出する。そのため交感神経を「アドレナリン作動性神経」、副交感神経を「コリン作動性神経」とも呼ぶが、この呼び方は最近の研究からみれば適切ではない。ペプチド含有神経線維は同時にアドレナリン作動性神経線維であったり、コリン作動性神経であったりする。即ち前者は神経伝達物質としてノルアドレナリンの他に、また後者はアセチールコリンのほかにもある種のペプチドを共有していることが多いからである。このことは「一つのニューロンが複数の神経終末を作る場合、これらの終末から同一の伝達物質が放出される」というDaleの原理(Dale’s principle)(Sir Henry Hallett Dale, 1875-1968.)註1)は通用しないことになる。これらの神経ペプチドの作用は、神経伝達物質として作用する以外に、共存する伝達物質の作用を調節していると考えられている。註1)Daleの原理については、参考文献2) 古河太郎(1997)を参照されたい。
迷走神経には遠心性の副交感神経のほかに求心性の知覚線維も含まれている。これらの求心性神経線維は各内臓へ向かう遠心性神経線維と同じ線維束に束ねられて、内臓器官からの感覚情報を中枢へ伝える。これらの求心性神経の細胞体は脊髄神経節や脳神経知覚神経節に存在する偽単極性神経細胞であり、構造的には体壁性somaticの偽単極神経細胞と区別できない。
高位の自律神経中枢——視床下部
自律神経中枢の原基は神経管の両側中央部で、前後に走る分界溝の周囲に発生する。発生の進行とともに神経管前部がよく発達し、その前端部から視床下部が形成される。視床下部には多数の神経核が存在するものの、とくに植物性器官の機能と深い関係をもつ神経核は腹内側核ventromedial hypothalamic nucleus (VMH)と外側核lateral hypothalamic nucleus (LH)である。前者はおもに交感神経系の、後者は延髄の迷走神経背側核と疑核を介して迷走神経の遠心性線維へ繋がっている。 またVMHから出た線維が延髄を経由して、胸腰髄の中間外側核に連なり交感神経系を形成する。
自律神経–内分泌系と自律神経間ネットワークによる臓器相関
視床下部は4−5gの小さな器官で、自律神経系の最高統合中枢であり、且つ直接下垂体と繋がっている。機能的にも自律神経系と内分泌機能との協調(求心性自律神経ー視床下部ー内分泌)によって生体のホメオスターシスが維持されている。最近その系に加えて各種の臓器間に視床下部を介する神経ネットワーク(求心性自律神経ー視床下部ー遠心性自律神経)が重要な役割を演じていることが明らかにされてきた。つぎに各論として植物性器官のひとつ、肝臓の神経支配を述べる。
II. 肝臓支配の自律神経系、各論
肝臓支配の神経系の研究は先ず肝組織内に分布する神経線維の観察に始まった。ついで自律神経中枢との線維連絡の研究から、肝臓内の自律神経線維は、より上位の系からヒエラルキー的に支配されるという概念が生まれた。 その意味から肝臓の神経支配も、「臓器固有の神経系、intrinsic nervous system」と、それを上位中枢から支配する「外来性神経系、extrinsic nervous system」の分類が便利かもしれない(Friedman, 1988; Forssmann et al, 1988)。
肝臓を支配する交感神経節前線維は第5-11胸髄の側角細胞から出た軸索が交感神経節を素通りして内臓神経を構成し、下行して横隔膜を貫通して腹腔内に入り、椎前神経節において肝臓固有のニューロンとシナプスを形成する。その節後神経線維は神経節周囲にplexusを形成し、そこで延髄の迷走神経背側核由来の副交感神経線維と合流したのち、肝動脈や門脈を取り巻きつつ肝実質組織内及び胆管壁周囲に分散して終末する。他方肝臓の求心性神経は有髄で、肝門から脊髄と脳幹網様体や視床下部の高次中枢へシグナルを送る。
肝組織内に分布する神経線維は古くから種々の染色法を用いて観察されてきた。初期にはメチレンブルー染色、Bielschowsky型鍍銀法、髄鞘染色法などの古典的手法が用いられ、次いでこれら神経線維の特性を知るために、活性アミン蛍光組織化学、酵素組織化学や免疫組織化学が導入された。またこれら神経終末の微細構造が電子顕微鏡で観察され、その起始細胞を知るため、HRP注入法やMarchi法、Nauta法が採用され、さらに微小電極法の発達によって中枢神経系との連鎖が解明されてきた。以下これらの方法によって蓄積されてきた肝支配神経の形態学的、機能的性状について述べる。
A) 肝内自律神経線維 Intrinsic liver innervation
古くはPflueger (1869)がオスミウム固定染色法を、またKorolkow (1893)はメチレンブルー染色法を用いて肝臓に有髄線維の存在を確認した。しかし鍍銀法で肝臓の神経繊維を検出していたBerkley (1893), Stoehr (1924), Riegele (1928)らは肝臓の有髄神経の存在に否定的であった。それは鍍銀法では軸索のみが鍍銀され、髄鞘は難染性のためであったと思われる。
オスミウム固定染色扇形標本作成法(福山右門、1960)
イヌの肝門付近で神経線維束を一定の長さに切断分離し、オスミウム固定後に、スライドグラス上で一方の切断端を残してカバーグラスで軽く圧迫すると、線維束は扇状に拡がって線維束中の有髄線維数が数えられる。この方法によるイヌ肝臓の有髄神経数は202 ± 11.1本であった。その神経束切断によって、その起源はTh4−L1の後根神経節と篩状神経節を経由する迷走神経であることが分かった(本田 衷、1960)。肝門近くの肝組織中にHRPを注入するとHRPを取り込んだ大小の神経節細胞が標識された(Carobi and Magni, 1981)。
Bielschowsky-Suzuki鍍銀法(鈴木 清,1963;1965)
門脈と動脈に沿って肝実質内に侵入した神経線維はGlisson鞘を経て肝小葉内へ侵入し、類洞周囲や実質細胞間を縫うように走る。肝小葉内へ侵入する神経線維数は霊長類では比較的多く、ラットとマウスでは少ない。これらの線維は無髄線維で所々に念珠状の膨らみ(bouton de passage)を作る。これらの線維は肝実質細胞とビタミンAを貯蔵する肝星細胞(hepatic stellate cell)に終わるか立ち寄る。鈴木は、Kupffer (1876)が塩化金法で最初に記載し Sternzellen der Leberと命名した星細胞が、Cajal(1911)が腸の平滑筋組織内で記載しneurones sympathiques interstitials(介在細胞:神経終末と効果器の間に介在する細胞の意味)と命名した細胞と同種の細胞ではないかと考え、「肝臓の介在細胞 (liver interstitial cell)」または「伝達細胞 (transmittal cell)(神経刺激を効果器細胞へ伝達する細胞の意味)と呼んだ。
介在細胞の核は円形または楕円形で明瞭な核小体をもち、細胞質は小空胞を多数もち、細胞の形は多極性で分枝する突起が実質細胞を取り巻くように接していていた。その後の筆者の研究(Wake, 1971)から、この小空胞の実態は貯蔵ビタミンAの脂質滴であり、その細胞が本来の肝星細胞(Kupffer, 1876)であることが証明された。 また神経線維のところどころに、実質細胞内に深く入り込む直径2−3μmに達する球状終末bulbous endingを造っていた。この終末はマウスの肝臓でYamada (1965)らが電顕で観察した球状終末に相当する。
モノアミン含有神経線維の検出
肝内へ侵入するアドレナリン作動性神経線維はDisse腔を走行し、実質細胞や肝星細胞にvaricosity やbulbous endingの終末構造をつくる。これらの線維は霊長類肝臓に多くラット、マウスでは少ない(Forssmann and Ito, 1977;上野隆登 他、1989)。これら神経線維の検出法として以前はFalck & Hillap法や蛍光組織化学法がよく用いられたが、最近ではカテコールアミンの合成酵素であるチロシンヒドロキシラーゼやドパミンβ-ヒドロキシラーゼの免疫組織化学法が採用されている(Goeler and Sternini,1991; Feher et al.、1991)。これら線維の大部分はその形状と分布から鍍銀法で検出される肝臓内神経線維に一致するものと考えられる。
アセチールコリンエステラーゼの酵素組織化学
アセチールコリンを伝達物質とするコリン作動性神経繊維は、アセチールコリンエステラーゼの酵素組織化学法により検出される。 肝小葉内に侵入するこの線維はモルモットを除いて少数で、門脈枝や動脈枝に添う線維が少数認められるに過ぎない(De Luca et al. 1982)。
S100免疫組織化学(全 陽,2017)
S100免疫染色陽性神経線維は肝内の大径の門脈の領域では太い線維束を作り、末梢の小径の門脈域では不規則に分布する孤立性線維となって類洞壁に沿って肝小葉内へ侵入する。 S100免疫染色では古典的な鍍銀法と同様に陽性線維の種類は同定できない。
N-CAM (Neural Cell Adhesion Molecules)免疫組織化学(Nakatani et al. 1995)
N-CAM陽性神経線維が門脈域から、類洞壁に沿って肝小葉内へ侵入する。またN—CAMは肝星細胞表面膜にも陽性で、両者が接合する可能性が示唆される。N—CAMは細胞膜糖タンパクの一種で細胞間結合に関与する。
ペプチド含有神経線維の免疫組織化学(Bioulac-Sage et al, 1990)
ニューロペプチドY (NPY)、血管作動性腸管ペプチド(vasoactive intestinal polypeptide, VIP)、サブスタンスP (SP) 、 ニューロテンシン (NT)、ソマトスタチン(SS)などのペプチド含有線維群が血管壁、胆管壁に留まることが多いが、一部は肝小葉内に侵入し、ときに中心静脈に達する。
- NPY含有神経線維:
- ヒト肝におけるNPY線維は肝門部から動脈枝、門脈枝や胆管に沿って肝実質内に侵入する。一部の線維はvaricosityをつくりながら類洞に沿って走り、実質細胞や類洞内皮細胞に終末をつくる。NPY含有線維は交感神経の分布にほぼ一致し、交感神経の刺激によりNPYの放出がみられ、交感神経毒である6−ハイドロキシドーパミン投与により肝内のNPY含有線維は消失する(Goeler and Sternini, 1991)など、NPYは交感神経中に共存していると考えられる。NPYは肝動脈や門脈に対して収縮作用があり、その作用はノルアドレナリンよりも強い(Coder and Withrington, 1988)。
- VIP含有神経線維:
- 肝門部から門脈や動脈に沿い、一部は肝実質内へ侵入し類洞ないし実質細胞索に沿って走行し、ところどころで膨らみ (boutons de passage)を形成し実質細胞や星細胞に密接する(上野隆登ら、1989)。細胞膜に存在するVIP受容体を介して実質細胞に直接作用し、グリコーゲンの分解促進やタウロコール酸の取り込みを抑制する(Knodell and Steele, 1987)。
- SP含有神経線維:
- SP線維は肝動脈壁にみることが多いが、肝静脈壁には比較的少ない(Feher et al., 1992)。これらの線維は肝実質内に侵入し、門脈壁、肝動脈壁、胆管壁に沿って走行し、肝実質細胞や星細胞の近傍に達している。Feher らはペプチド線維の起源を知るため、肝動脈門脈周囲の神経束を肝門の手前で離断したところ、肝内のSP線維はほとんど消失した。一方左右の迷走神経をそれぞれ切断すると消失するSP線維の分布は逆になり、大内臓神経と迷走神経の両者を切断すると血管や胆管に分布する同線維はすべて消失した。このことは起源を異にするSP線維が肝臓の異なった部位に分布していることを示唆する。
肝支配神経終末の微細構造
鍍銀法で記載されたbulbous ending は透過型電顕(TEM)でも観察された(Yamada, 1965; Ito and Shibazaki, 1968; Forssmann and Ito, 1977; Balabaud et al., 1988; Bioulac-Sage et al., 1990)。この球状の膨らみは相手方の肝実質細胞が陥凹し、狭いシナプス間隙(ca. 20μm)を隔てて浅く接するものから、球体がほとんど実質細胞内に陥入しているものまで様々である。終末球体の内部には小型のミトコンドリアや大きさは報告者によって多少の違いがあるシナプス小胞が観られる。カテコールアミンの取り込みなどからこれらの終末は交感神経の終末と考えられる。交感神経の終末は門脈の中膜平滑筋細胞や肝実質内では肝星細胞にもみられる。またSP線維やVIP線維も肝星細胞に終っている(上野隆登ら、1989)。
肝支配神経の機能
肝臓代謝に対する自律神経の作用は、おもに節前線維の刺激実験によって研究されてきた(Hartmannら、1982)。交感神経刺激は肝動脈と門脈の平滑筋,さらに肝星細胞を収縮させるので肝血流は減少する。この血流低下は実質細胞に対しては尿素とグルタミン生成を抑制するなど、窒素化合物代謝を調節する(Balle and Jungermann, 1986)。またグリコーゲンを分解させ、血中グルコースの生成促進がみられる(Shimizu and Usami, 1982)。ラットに対して化学的交感神経切除を行うとコレステロールの合成が抑制され、血中コレステロール値の低下,肝のα-hydroxylase 活性の増加がみられる(Rogersら、1979)。肝門で神経切除を行うと肝リパーゼ値が20%増加する(Hansson ら、1985)。
一方副交感神経を刺激すると、逆にグルコースの取り込みとグリコーゲンの生合成が促進される(Sasse, 1986)。しかし節前線維の刺激では膵臓や副腎による間接作用も起こりうるので、肝還流実験により肝臓へ侵入する線維を刺激することが望ましい。その場合、交感、副交感神経を同時に刺激することになるが、肝臓支配神経はおもに交感神経であるため、あまり問題にならない。
神経ペプチド含有線維は血管壁に終末をつくることから、肝臓支配血管の収縮に関与していることが示唆される。SP線維やSS線維は侵害受容に関与するという報告(Lee ら、1984; Kuranishiら、1985)もあるので、これらの線維が肝臓の痛覚に関与する可能性も否定できない。SS線維が肝障害に対して防御的に作用するという報告(Szabó and Usadel, 1982)もある。
B) Extrinsic liver innervation上位中枢からの肝臓支配神経
Shimazu & Amakawa (1968) は視床下部腹内側核を刺激すると肝臓のグリコーゲンの分解を惹起させ、視床下部外側核を刺激するとグリコーゲンの合成が起こることを観察した。Rogers & Hermann(1983)はラットの迷走神経肝枝にペルオキシダーゼを取り込ませ、左側のsubnucleus gelatinosis, nucleus solitarius, area postrema に求心性神経終末を記載している。
自律神経の総論でも述べたように、生体は常時ホメオスターシス機構によって恒常性が維持されている。その恒常性は従来、自律神経-内分泌系によるものと考えられてきた。しかし最近になって内分泌系のみではなく、神経系も加わって臓器間のフィードバック機構が働いていることが明らかになってきた。その視点から肝臓支配の神経線維に対して疾患との関連に関心が集まっている。肝臓の代謝は遠心性神経によって制御されていることは前述したが、その結果はホルモン分泌によって他の臓器に伝えられるばかりでなく、求心性線維によって中枢神経に伝達され、さらに中枢から遠心性線維によって他の臓器へ伝達されるネットワークが働いている(Katagiriら、2007)。このネットワークには主に交感,副交感神経の遠心性神経と知覚性求心神経が関与している。
全身の糖代謝を例として、肝臓–中枢神経–膵臓のネットワークから説明してみると、交感神経が刺激されると肝実質細胞において糖新生が促進する(Yi, 2010)。一方膵臓では低血糖状態で交感神経が刺激されると、ノルアドレナリンが膵島のα細胞に発現するβ2adrenergic受容体と、β細胞に発現するα2 adrenergic受容体に反応して、グルカゴンの産生亢進とインシュリンの産生抑制が起こる(Thorens, 2014)。α2 adrenergic受容体のgenetic variant は2型糖尿病の疾患感受性遺伝子として同定されている。この遺伝子多型を有するとα2 adrenergic受容体の発現が亢進しており、インシュリン分泌能は低下している(全、2017)。つまり交感神経とβ細胞の相関が2型糖尿病のリスクを上げることになる。詳細は参考文献5を参照されたい。
おわりに
この小論では先ず自律神系を総論的に述べ、続いて肝臓の神経支配を解説した。肝臓は1200gにも達する消化器系最大の臓器である割には、その支配神経線維は少なく、むしろ脇役的存在と思われがちであった。ところが最近になって肝臓の神経支配は単に肝臓代謝を調節するのみならず、視床下部へフィードバックされ、さらにそこから内分泌系と神経系を介して広く他の植物性器官へ信号を送る一大サ−キットを作り上げて全身のホメオスターシスを維持していることが知られるようになった。今後の進展に期待したい。
謝辞:稿を終えるに当たり、肝細胞研究会HPに本題を掲載する機会を与えていただきました仁科博史 東京医科歯科大学教授に感謝いたします。
参考文献
- Brodal, P. (1992): The central nervous system. Structure and function, 2nd Ed. Oxford University Press. Oxford
- 古河太郎 (1997): 原著を探るDal’s principle CLINICAL NEUROSCIENCE Vol.15 (6) 120-121. 中外医学社, 東京
- 後藤由夫、松尾 裕、佐藤昭夫 (1993): 自律神経の基礎と臨床. pp 318, 医薬ジャーナル社, 大阪
- 萬年 甫(2011):. 脳を固める・切る・染める–先人の智恵. x-288, メデイカルレビユー社, 東京
- 瀬川 徹 (2017): 肝胆膵臓器間ネットワークの新展開。特輯 臓器間ネッ トワークから観た肝胆膵の恒常性とその破綻. 肝胆膵 73巻5号,アーク メデイア社,東京
- 嶋津 孝. 斉藤昌之(1988):神経と代謝調節 ix-360. 1988, 朝倉書店、 東京
- Soury, J.(1899):ジュール・スーリイ中枢神経系. 古代編. 構想と機能.理論と学説の批判的歴史. 萬年 甫・新谷昌宏 訳. xx-469, 2017,みすず書房, 東京
引用文献
- Friedman, M. I., (1988) Hepatic nerve function, In: The Liver. Biology and Pathobiology. Ed. by I. M. Arias, W.B. Jakoby, H. Popper, D. Schachter, and D. A. Shafritz. Raven Press, Ltd., New York
- Forssmann, W.G., Bruehl, B., Ito, S. (1988), In: Biopathology of the liver. An ultrastructural approach. Ed. by P. M. Motta. Kluwer Academic Publishers, Ltd., Dordrecht
- Pflueger, E. (1869): Ueber die Abhaengigkeit der Leber von dem Nervensystem. Arch. Gesamte Physiol. 2: 459-491
- Korolkow, P. (1893): Ueber die Nervenendigungen in der Leber. Anat. Anz. 23/24: 751-753
- Berkley, H. J. (1893): Studies in the histology of the liver : I . The intrinsic nerves. Anat. Anz. 23/24: 771-783
- Stoehr, P. (1924): Lehrbuch der Histologie und der mikrokopischen Anatomie des Menschen mit Einschluss der mikroskopischen Technik. Gustv Fischer, Jena
- Riegele, L. (1928): Ueber das feinere Verhalten der Nerven in der Leber von Mensch und Saeugetier. Z. mikr. Anat. Forsch. 14: 73-98
- 福山右門 (1960): 迷走神経有髄線維の形態学的並に実験的分析. 最新医学15: 256-274
- 本田 哀 (1960): 肝臓の神経支配に関する実験:組織学的研究. 福島医学10: 181-201
- Carobi, C., Magni, F. (1981): The afferent innervation of the liver: a horseradish peroxidase study in the rat. Neurosci. Lett. 23: 269-274
- 鈴木 清 (1963) 植物性神経の終末装置について. 第16回日本医学会総会学術講演集、日本の医学、1963年版 IV:13-28
- 鈴木 清(1965): 平滑筋の形態とその神経支配. 日本平滑筋学会誌1:139-154
- Wake, K (1971) "Sternzellen" in the liver: perisinusoidal cells with special reference to storage of vitamin A. Am J Anat 132:429-462
- Kupffer, C. (1876): Ueber Sternzellen der Leber. Briefliche Mitteilung an Prof. Waldeyer. Arch. mikr. Anat . 12: 353-358
- Cajal, S.R. (1911): Histologie du systeme nerveux de I’homme et des vertebres. Tome 2. Maloine. Paris.
- Yamada, E. (1965): Some observations on the nerve terminal on the liver parenchymal cell of the mouse as reveled by electron microscopy. Okajima Folia Anat. Jpn. 40: 663-677
- Forssmann, W.G., Ito, S. (1977): Hepatocyte innervation in primates. J. Cell Biol. 74: 299-313
- 上野隆登, 鳥村拓司,犬塚貞孝 他 (1989): ヒト肝類洞壁における神経ペプチドの局在. 肝類洞壁細胞研究の進歩(谷川久一編)2: 135-141
- Goehler, L.E., Sternini, C. (1991): Neuropeptide Y immunoreactivity in the mammalian liver; Pattern of innervation and coexistence with tyrosine hydroxylase immunoreactivity. Cell tissue Res. 265: 287-295
- Feher, E., Foder, M.. Gores, T., et al.(1991): Immunohistochemical distribution of neuropeptide Y and catecholamine-synthesizing enzymes in nerve fibers of the human liver. Digestion 50: 194-201
- De Luca, C., Cantagalli, A., De Angelis, E., et al. (1982): Cholinergic nerves in the human liver. Experimentia 38: 397-398
- 全 陽 (2017): 肝臓・膵臓内に存在する神経線維の分布と機能. 肝胆膵75: 923-928
- Nakatani, K., Seki, S., Kawada, N., et al. (1995): Expression of neural cell adhesion molecules (N-CAM) on the stellate cells of human liver. In: Cells of the Hepatic Sinusoid. Vol. 5. (eds. Wisse,E., Knook,D.L. Wake,K.) Kupffer Cell Foundation, Leiden, The Netherlands
- Bioulac-Sage, P., Lafon, M.E., Saric, J., et al, (1990): Nerves and perisinusoidal cells in human liver. J. Hepatol. 10: 105-112
- Goehler, L.E., Sternini, C. (1991): Neuropeptide Y immunoreactivity in the mammalian liver; Pattern of innervation and coexistence with tyrosine hydroxylase immunoreactivity. Cell Tissue Res. 265: 287-295
- Fehér,E., Fodor, M., Fedér,J. (1992): Ultrastructural localization of somatostatin- and substance P-immunoreactive nerve fibers in the feline liver. Gastroenterology 102: 287-294
- Coder, R., Withrington, P.G. (1988): The actions of neuropeptide Y and peptide YY on the hepatc arterial and portal vascular beds of the anesthetized dog. Br. J. Pharmacol. 94: 1149-1156
- Ito, T., Shibazaki, S. (1968): Electron microscopic study on the hepatic sinusoidal wall and the fat-storing cells in the normal human liver. Arch. Histol. Jpn. 29:137-192
- Balabaud, C., Boulard, A., Quiton, A., et al. (1988): Light and transmission electron microscopy of ainusoids in human liver. In: Sinusoids in human liver : health and disease (ed. by Bioulac-Sage, P., Balabaud, C. ) Kupffer Cell Foundation , Rijswijk, The Netherlands, pp 87-110
- 上野隆登,権藤和久,鳥村拓司.他 (1989):ヒト肝におけるサブスタンスPレセプターの局在—光顕および電顕オートグラフィーによる観察. 肝臓30:96
- Hartmann, H., Beckh, K., Jungermann, K. (1982): Direct control of glycogen metabolism in the perfused rat liver by sympathetic innervation. Eur. J. Biochem. 123: 521-526
- Balle, C., Jungermann, K. (1986): Control of urea production, glutamine release and ammonia uptake in the perfused rat liver by the sympathetic innervation. Eur. J. Biochem. 158:13-18
- Shimazu, T., Usami, M. (1982): Further studies on the mechanism of phosphorylase activation in rabbit liver in response to splanchnic nerve stimulation. J. Physiol. (London) 329: 231-242
- Hansson, P., Lindfeldt, J., Ekelund, M., et al. (1985): Hepatic lipase activity increases after liver denervation in the rat. Biochim. Biophys, Acta 833: 351-353
- Sasse, D. (1986): Structure and innervation Liver. In: Regulation of hepatic metabolism. Intra- and intercellular compartmentation (ed by Thurman, R.G. et al. ) Plenum Press, New York, pp 3-25
- Lee, T.H.E., Saito, A., Berezin, I. (1984) Vasoactive intestinal polypeptide-like substance: The potential transmitter for cerebral vasodilatation. Science 224: 897-900
- Kuranishi, Y., Hirota, N., Sato, Y., et al. (1985): Evidence that substance P and aomatostatin transmit separate information related to pain in the spinal dorsal horn. Brain Res. 325: 294-298
- Szabó, S., Usadel, K.H. (1982): Cytoprotection-organoprotection somatostatin: Gastric and hepatic lesions. Experimentia 38: 254-255
- Shimazu, T., Amakawa, A. (1968) Regulation of glycogen metabolism in liver by the autonomic nervous system. II. Neural control of glycogenolytic enzymes. Biochem. Biophys, Acta 165: 335-345
- Rogers,R.C., Hermann, G.E, (1983): Central connections of the hepatic branch of the vagus nerve : A horseradish peroxidase histochemical study. J. Auton. Nerv, Syst., 7: 165-174
- Katagiri, H., Yamada,T., Oka, Y. (2007): Adiposity and cardiovascular disorders: disturbance of the regulatory system consisting of humoral and neuronal signals. Cir. Res. 101: 27-39
- Yi CX, la Fleur SE, Fliers E et al (2010): The role of the autonomic nervous liver innervation in the control of energy metabolism. Biochim Biophys Acta 1802:416-431
- Thorens, B. (2014): Neural regulation of pancreatic islet cell mass and function. Diabetes. Obes. Metab. 16 ( Suppl 1) : 87-95










