研究交流
胆管上皮障害を基盤とした胆管癌モデルの構築と発癌機序・起源細胞解明
中川 勇人
東京大学医学部附属病院 消化器内科
はじめに
胆管癌は発生部位によって肝内胆管癌と肝外胆管癌に分類され、いずれも予後不良であるため、新たな治療・予防法の開発が望まれる。胆管癌発症の危険因子として、原発性硬化性胆管炎(PSC)・肝吸虫症などが知られ、その基盤に慢性炎症の存在が示唆されているが、その発症機構は不明な点が多い。また近年肝内外の大型胆管において、胆管周囲付属腺に胆管前駆細胞が存在し、癌起源細胞となり得るとの説が提唱されている。しかし胆管癌、特に肝外胆管癌の適切な動物モデルがないため、エビデンスレベルの高い報告はない。最近我々は新規の肝外胆管癌マウスモデルおよびオルガノイドモデルを樹立し、その発症機序・起源細胞の同定を行ったので、その一部を紹介したい。
肝外胆管癌マウスモデルの樹立
ヒト胆管癌では高頻度にRasおよびTGFb経路に遺伝子変異が認められることから1)、タモキシフェン(TAM)依存的にK19陽性細胞でCreを発現するK19-CreERTマウスと、LSL-KrasG12Dマウス・Tgfbr2F/Fマウスを交配させ、肝内胆管、肝外胆管、胆嚢を含めた胆管上皮全域にわたって、Kras活性化・TGFbR2欠損を誘導するマウス(KT-K19CreERT)を作製した。遺伝子改変効率は、いずれの胆道領域においても40%程度であった。しかしKT-K19CreERTマウスは肝外胆管上皮の軽度過形成を生じるのみで、胆管癌は発症しなかった。そこでさらなる胆管癌発症促進因子が必要と考え、我々は以前肝臓において接着因子E-cadherin(CDH1)を欠損させると肝癌発症を著明に促進させることを見出していたことから2)、上記マウスにCDH1F/Fマウスを交配させたマウス(KTC-K19CreERT)を作製した。すると驚くべきことにTAM投与わずか4週で肝外胆管全長に渡り上皮下を這って進展する胆管浸潤型胆管癌を発症した(図1)。また興味深いことに、肝内末梢胆管の変化は肝内外の大型胆管に比べ非常に軽度であり、遺伝子異常に対する反応性は胆管の部位によって異なることが示唆された。
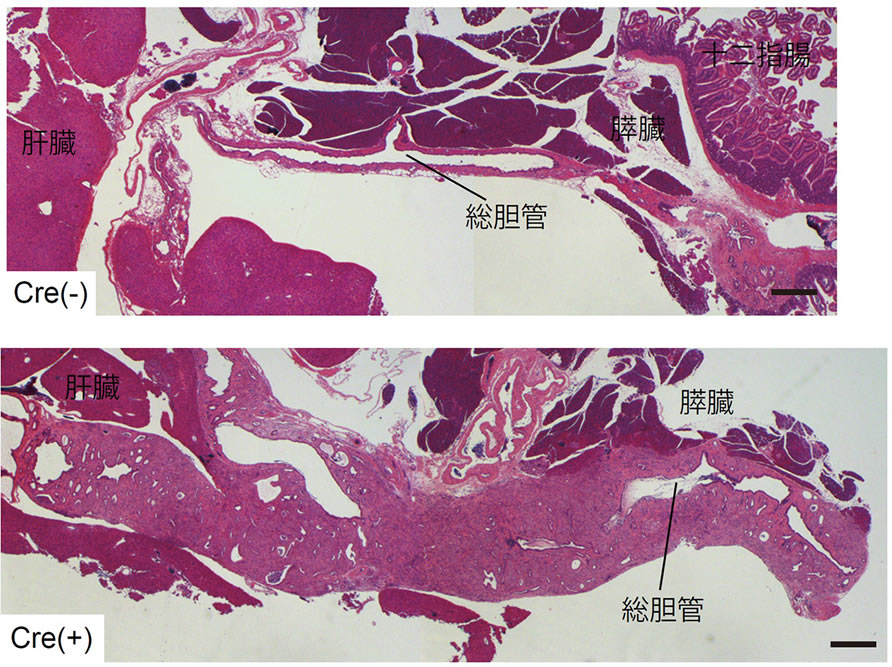
図1. KTC-K19CreERTマウスは肝外胆管癌を発症する
TAM投与3.5週後の肝外胆管病理像(H&E染色)。上段:Cre陰性KTCマウス、下段:KTC-K19CreERTマウス(scale bar: 500 μm)。(文献7より改変)
肝外胆管癌の発癌過程
胆管上皮幹細胞および癌起源細胞の存在部位はまだ明らかとなっていないが、最近、胆管上皮下でネットワークを形成する胆管周囲付属腺内に前駆細胞が存在し、癌の起源細胞ともなり得るとの説が提唱され注目されている3) (http://hepato.umin.jp/kouryu/kouryu32.html)。そこで我々は本マウスの発癌過程を詳細に解析した。すると、TAM投与1週間後から胆管表層上皮細胞がボロボロと胆管内腔に脱落し、胆管周囲に強い炎症反応が観察された(図2)。遺伝子改変細胞の細胞系譜を追跡すると、胆管表層では遺伝子改変細胞がE-cadherin欠損に伴い脱落し、正常細胞に修復されていく一方で、胆管付属腺内では遺伝子改変細胞が生存しつづけることができるニッチが存在することがわかった。さらに胆管付属腺では、胆管障害に対する修復反応として強い増殖反応が起き、次第に胆管付属腺が異型性をもって増大していく様子が観察された。すなわち、E-cadherin欠損により生じる胆管上皮障害が代償性の炎症・胆管再生反応を誘導するが、その反応が結果として胆管付属腺からの発癌を促進していることが明らかとなった。実際にPSCや肝内結石症患者では、胆管付属腺の増生や付属腺内のKras変異の存在が報告されており4)、本モデルは慢性胆管障害からの発癌過程を模倣し、機序解明に有力なツールになると考えられた。
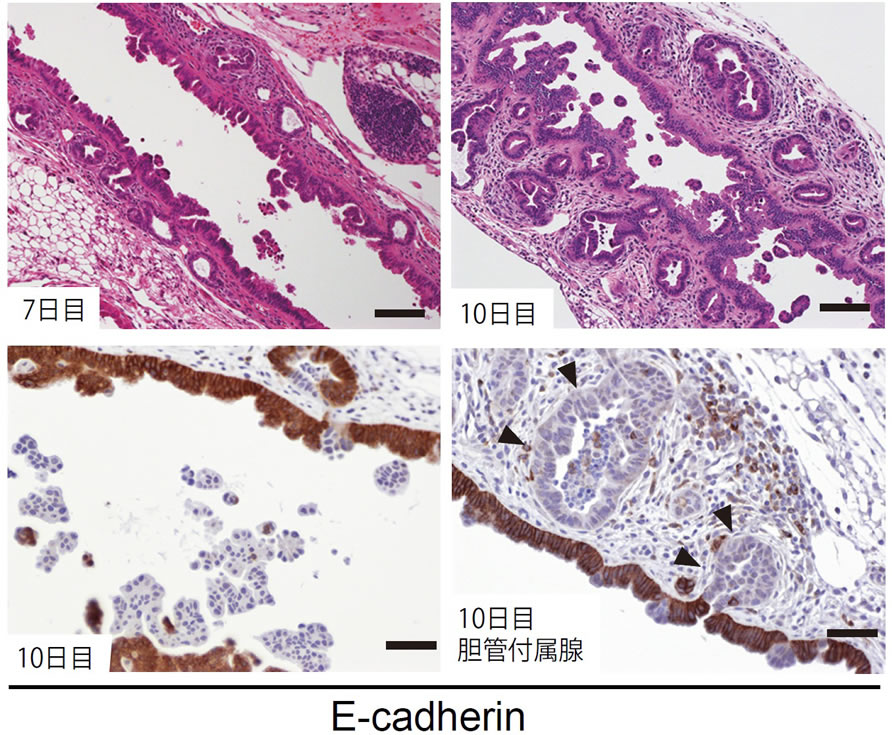
図2. KTC-K19CreERTマウスにおける肝外胆管病理像の時間経過
上段:TAM投与7日目、10日目の肝外胆管病理像(H&E染色, scale bar: 100 μm)。下段:TAM投与10日目のE-cadherin免疫染色(scale bar: 50 μm)。E-cadherinを欠損した胆管表層上皮細胞が胆管内腔に脱落していく一方(左図)、胆管付属腺内では生存し続けることができる(右図、矢頭)。(文献7より改変)
胆管オルガノイドを用いた解析
さらに発癌機序を明らかにするため、我々はマウス肝外胆管からオルガノイド培養法を確立し、Cre陰性KTCマウスからオルガノイドを作製、Cre発現レンチウイルスで遺伝子変異を導入した。すると興味深いことに、胆管上皮細胞が脱落していく現象がオルガノイドでも再現された(図3)。次いでこのオルガノイドを免疫不全マウスの皮下に移植することによって、in vivo同様の腺癌を形成することにも成功した。すなわち、胆管オルガノイドを用いることでin vivoの現象を試験管内で再現でき、かつ胆管上皮内に起きている変化を周囲の環境と切り離して解析することが可能となった。
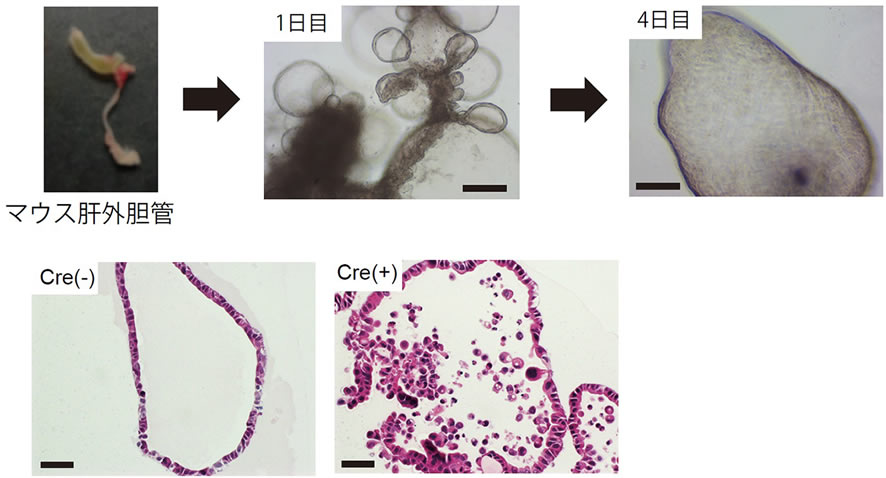
図3. マウス肝外胆管オルガノイド培養法の確立
上段:マウス肝外胆管由来オルガノイドの顕微鏡写真 (scale bar: 250 μm)、下段:Cre陰性KTCマウス由来胆管オルガノイドへCre発現レンチウイルスを用いて遺伝子変異を導入。胆管上皮が剥離していく様子が観察される(H&E染色, scale bar: 50 μm)。(文献7より改変)
肝外胆管癌進展におけるIL-33の関与
そこでKTCマウス由来オルガノイドを用いてマイクロアレイを行ったところ、3つの遺伝子改変によって炎症性サイトカインIL-33の発現が著明に上昇していた。IL-33は、寄生虫感染やアレルギーにおいて2型自然リンパ球(ILC2)やマスト細胞に作用してTh2型免疫応答を誘導することが知られているが、同時に死細胞やストレスを受けた細胞から “alarmin”として放出され、組織修復に寄与することも報告されている5)。加えて最近、胆管周囲付属腺を増殖させる作用があることも報告されていることから6)、IL-33に着目してさらなる検討を行った。KTC-K19CreERTマウスの胆管ではIL-33の発現が亢進しており、特にE-cadherinが欠失し胆管上皮が破綻しているところに特に強く発現していた。さらにKTC-K19CreERTマウスの肝組織では、2型自然リンパ球の浸潤が有意に増加しており、下流のサイトカインであるIL-13, amphiregulin(AREG)などの発現も有意に上昇していることが分かった。次いでKTC-K19CreERTマウスにIL-33中和抗体を投与すると、胆管付属腺の増殖反応が低下し、肝外胆管癌の進展が有意に抑制された。また過形成しか生じないKT-K19CreERTマウスにIL-33を外的に投与することで、肝外胆管から肝門部まで著明な腫瘍性変化を誘導することができた。すなわち胆管上皮障害によって放出されたIL-33は、胆管付属腺に存在するKrasやTGFbR2の変異と協調的に胆管癌発症を促進することが明らかとなった(図4)7)。
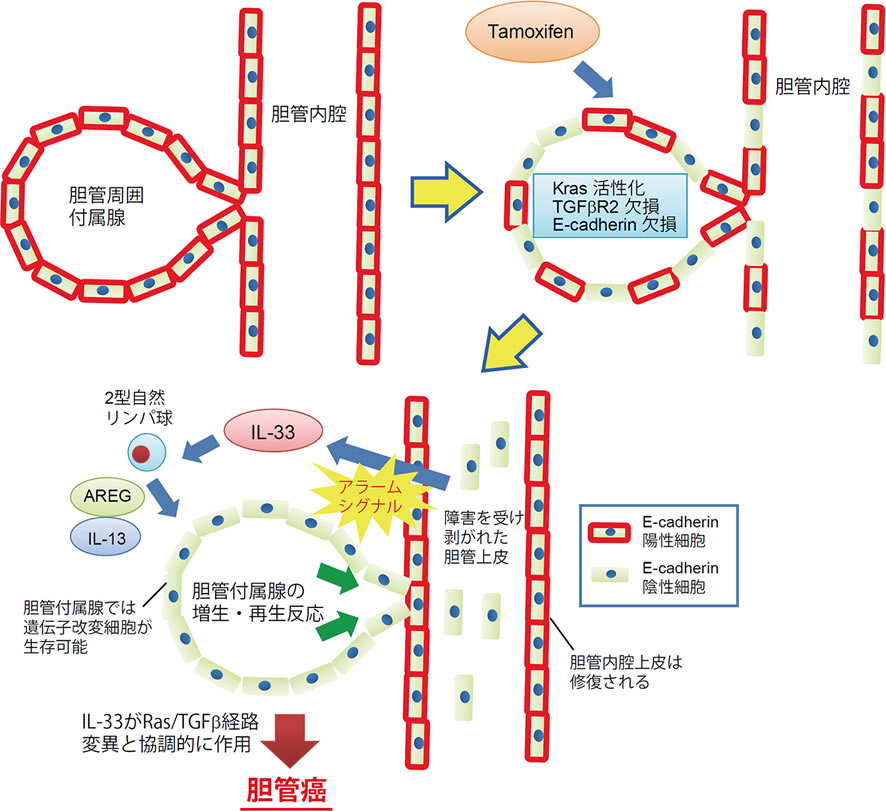
図4. 胆管上皮障害による胆管癌発症促進機構
障害を受けて剥がれた胆管上皮細胞はアラームシグナルとしてIL-33を放出し、胆管周囲付属腺を増殖させることによって胆管の再生反応を誘導する。しかし胆管周囲付属腺内には遺伝子異常が起きた細胞が生存できる環境が存在しており、IL-33による再生反応は結果として胆管付属腺からの癌化を促進している。(文献7より改変)
おわりに
本モデルは慢性胆管障害からの胆管癌発症機序解明に有力なツールであり、その病態解析から、胆管付属腺が癌起源細胞の一つとなり得ると同時に、治療標的としてIL-33が有望である可能性が示唆された。最近の研究から、胆管癌の高危険群である肝吸虫感染患者において、胆管上皮や血清のIL-33が著明に上昇していることが明らかとなってきている8)。本マウスモデルの結果と合わせると、やはりIL-33が発癌に重要な役割を担っている可能性が強く示唆され、今後さらに病態解析を進めていく予定である。
参考文献
- Nakamura H, et al. Genomic spectra of biliary tract cancer. Nat Genet 2015;47(9):1003-1010.
- Nakagawa H, et al. Loss of liver E-cadherin induces sclerosing cholangitis and promotes carcinogenesis. Proc Natl Acad Sci U S A 2014;111:1090-5.
- Lanzoni G, et al. The hepatic, biliary, and pancreatic network of stem/progenitor cell niches in humans: A new reference frame for disease and regeneration. Hepatology 2016;64(1):277-286.
- Hsu M, et al. KRAS and GNAS mutations and p53 overexpression in biliary intraepithelial neoplasia and intrahepatic cholangiocarcinomas. Cancer 2013;119(9):1669-1674.
- Molofsky AB, et al. Interleukin-33 in Tissue Homeostasis, Injury, and Inflammation. Immunity 2015;42(6):1005-1019.
- Li J, et al. Biliary repair and carcinogenesis are mediated by IL-33-dependent cholangiocyte proliferation. J Clin Invest 2014;124(7):3241-3251.
- Nakagawa H, et al. Biliary epithelial injury-induced regenerative response by IL-33 promotes cholangiocarcinogenesis from peribiliary glands. Proc Natl Acad Sci U S A. in press.
- Yu Q, et al. Expression and potential roles of IL-33/ST2 in the immune regulation during Clonorchis sinensis infection. Parasitol Res 2016;115(6):2299-2305.










