研究交流
世界初fibrolamellar hepatocellular carcinoma patient-derived xenograft model の確立
及川恒一
東京慈恵会医科大学 内科学講座 消化器肝臓内科
Fibrolamellar Hepatocellular Carcinoma (FL-HCC) とは
FL-HCCは1956年に肝細胞癌の特殊型として報告された疾患で、原発性肝癌の約1-5%以下と稀な疾患である。古典的肝細胞癌とは異なり、慢性肝炎や肝硬変等の背景肝疾患の合併がない若年者に多く、近年はやや増加傾向であるものの病因は不明である。病理組織学的に大型多形成で細胞質が好酸性を示す腫瘍細胞で占められ、名前の由来とされる腫瘍細胞の間に層状に走る線維性結合織を認め、島状に区画されているのが特徴である。根治的治療の基本は外科切除のみで化学療法や放射線療法は奏功せず、その予後は不良である(1)。
現在までのFL-HCCにおける研究
FL-HCC研究における一番の障壁は、これまで研究ツールとしての細胞株や動物疾患モデルが存在しないということであり、これらの確立が切望されていた。研究の多くはパラフィン切片を用いた研究で、稀な疾患ゆえに十分な検体収集が困難であり、分子メカニズムの解析はほとんど行われていなかった。近年になってようやくゲノム解析が行われるようになり、FL-HCCは肝細胞癌や胆管細胞癌で認められるTP53、β-catenin (CTNNB1)、KRAS等の変異が見られない等、他の肝癌とは大きく異なるユニークなプロファイルを持つことが明らかになってきており注目を集めている(2)。FL-HCCの病態解明や新規治療法の発展のためにcell lineやtumor line (ヌードマウス可移植腫瘍株)の確立が必須である。
世界初のCancer Stem Cell様の特徴を持ち合わせたFL-HCC PDX modelの確立とその特徴
今回、筆者がかつて所属したノースカロライナ大学・細胞生物学講座 Lola Reidラボで確立した世界初のFL-HCC patient-derived xenograft (PDX)について紹介したい。我々はFL-HCC患者の癌性腹水中の腫瘍細胞を研究目的で入手した。患者が死亡した後、検体を少しでも研究に役立ててほしいという御家族の強い希望によりプライベートジェットでReidラボに即座に届けられたことに、筆者はアメリカならではのスケールの大きさを感じずにはいられなかった。この腹水由来腫瘍細胞をKubota’s Mediumで培養後、免疫不全マウスの皮下に移植することで、腫瘍の発育は非常にゆっくりであるものの、マウス体内で継代可能なxenotransplantable tumor line; TU-2010を世界に先駆けて確立した(3)。Reidラボを含め2つのラボで一部の腫瘍細胞は培養せずにすぐに免疫不全マウスに移植されたが、腫瘍形成は認められず、内胚葉系幹細胞に適したKubota’s Mediumで培養することで癌幹細胞が濃縮された可能性が考えられた。このようにtumor lineの確立は成功したが、細胞株樹立は困難を極め、現在まで試行錯誤を繰り返すも樹立には至っていない。実際に形成された腫瘍の組織像は同一患者の肝内腫瘍に類似していた (図1)。FACS解析の結果から、形成された腫瘍は約50%のヒト腫瘍細胞と約50%のマウス細胞より構成されていることが確認された (図2A)。これらの細胞をMagnetic sortingによりヒト腫瘍細胞を分離しLimiting dilution tumorigenicity assayを行ったところ、わずか100個の腫瘍細胞の移植により腫瘍形成が確認され、FL-HCC PDX由来のヒト腫瘍細胞は癌幹細胞様の特徴を持ち合わせている可能性が示唆された (図1)。
このFL-HCC PDX由来のヒト腫瘍細胞をlow attachment plateで3D培養すると癌幹細胞self-renewalの指標とされるsphere形成が可能で、接着培養ではNANOGやCD44等の幹細胞マーカーが陽性であり、形態的にヒト正常胆管系幹細胞に類似していた。また培養をさらに継続すると、その形態は患者癌性腹水腫瘍細胞のprimary cultureと類似していた (図2B-D)。
次にFACSや免疫染色でFL-HCC PDX由来ヒト腫瘍細胞のphenotypeを調べたところ、CD13、CD24、CD44など癌幹細胞や正常幹細胞に高発現する分子の発現が高く、またOCT4、KLF4等の多能性幹細胞マーカー、BMI1、SHH等の幹細胞self-renewalマーカー、SOX17、SOX9等の内胚葉系幹細胞マーカーのみならず、HepPar1、CK18等の肝細胞マーカー、CK7、CK19等の胆管マーカー、PDX1、NGN3等の膵分化マーカーが陽性であった (図1)。
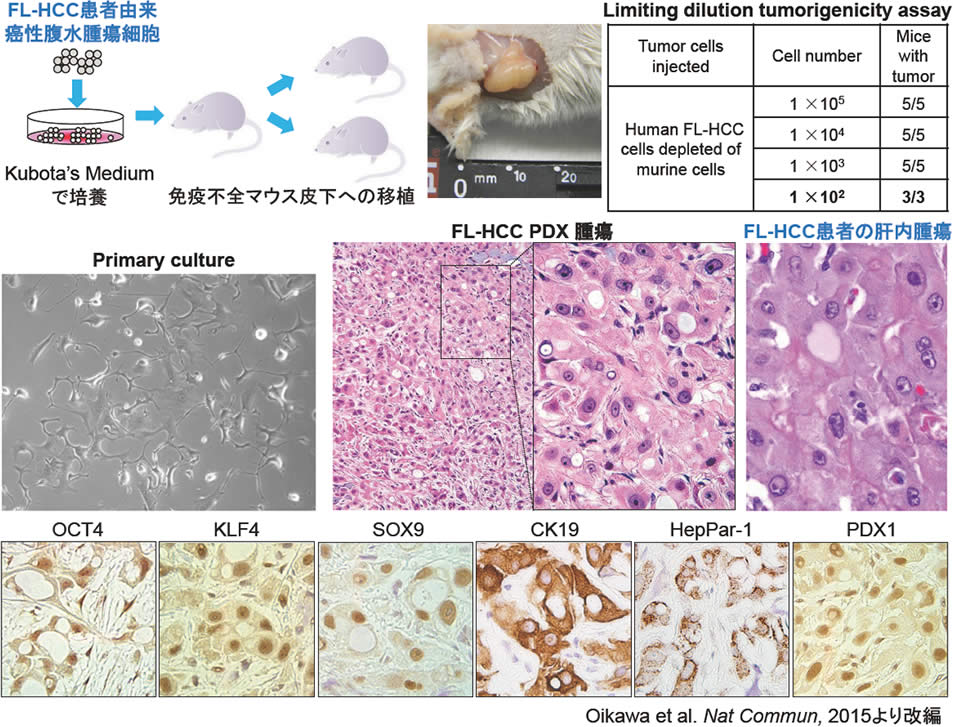 図1.FL-HCC PDXの確立
図1.FL-HCC PDXの確立
27歳で永眠されたFL-HCC患者癌性腹水細胞を内胚葉系幹細胞の培養に適したserum-free培地Kubota's mediumで培養後 (primary culture)に免疫不全マウス (NSG)の皮下へ移植した。特記すべきことに、わずか100個の腫瘍細胞の移植により腫瘍が形成された。腫瘍の組織像はFL-HCC患者の肝内腫瘍に類似しており、多能性幹細胞マーカーOCT4、KLF4、胆管マーカーSOX9、CK19、肝細胞マーカーHepPar-1、膵分化マーカーPDX1を発現していた。
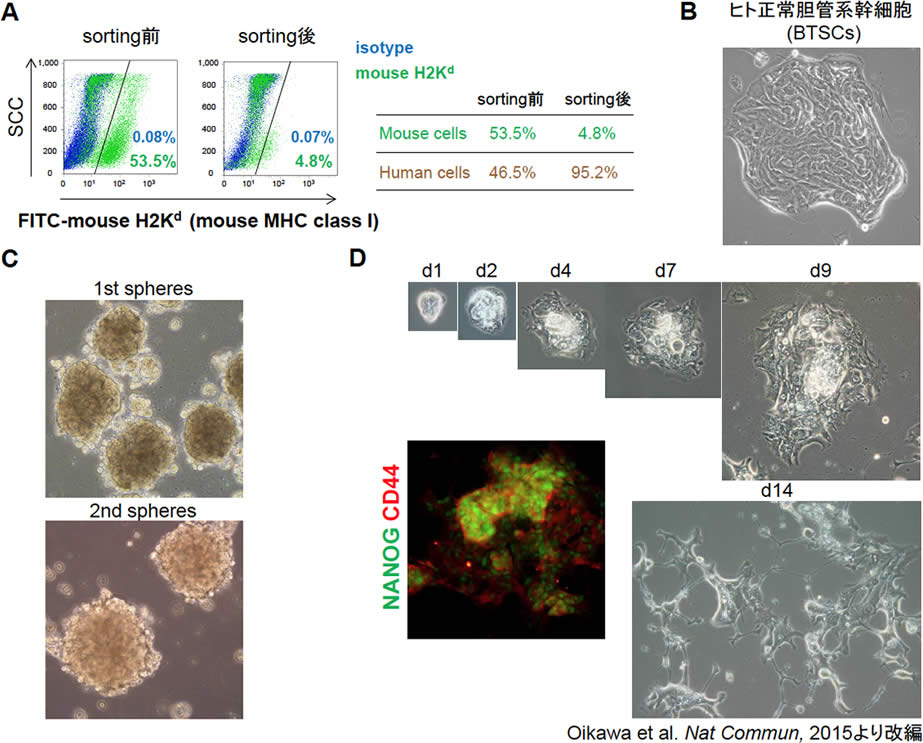
図2.FL-HCC PDX由来ヒト腫瘍細胞の培養系の確立
| A. | FL-HCC PDX由来細胞は約50%ずつのヒト腫瘍細胞とマウス細胞で構成されていた。FL-HCC PDX由来細胞よりヒト腫瘍細胞を磁気ビーズを用いて分離した。 |
| B. | 正常胆管系幹細胞 (BTSCs)の培養。 |
| C. | 磁気ビーズによりヒト腫瘍細胞を分離後にlow attachment plateで培養すると自己複製の指標とされるsphereの形成が認められた。 |
| D. | 接着培養において、NANOGやCD44といった癌幹細胞マーカーの発現を認め、その形態はヒト胆管系幹細胞; biliary tree stem cells (BTSCs) に類似していた。day14 (d14)には、その細胞形態はprimary culture(図1)と類似していた。 |
これらのphenotypeは近年、biliary treeのperibiliary glands(4)に存在し、肝細胞、胆管細胞、膵内分泌細胞の3方向へ分化しうる能力を持ち合わせるヒト胆管系幹細胞biliary tree stem cells (BTSCs) (5, 6)に類似していると考えられた(図2B, 3Aおよび本研究会 研究交流 中沼安二先生 “胆管系に分布する幹細胞biliary tree stem cells”の項を参照)。原発性肝癌における癌幹細胞の起源については依然として不明であるが(7)、癌幹細胞と正常幹細胞が類似した特性を持ち自己複製能制御機構の破綻が癌化につながる可能性が示唆されていることから、FL-HCCの起源は胆管系幹細胞が悪性形質転換した細胞である可能性が考えられた(3) (図4)。
実際にFL-HCC PDX由来ヒト腫瘍細胞が正常ヒトBTSCsに類似した遺伝子発現プロファイルを持つかを調べるために、上記2種類の細胞にヒト肝幹細胞hepatic stem cells (HpSCs)、肝芽細胞 hepatoblasts (HBs)、正常肝細胞 adult hepatocytes (AHEP) を加えた5細胞群 (図3A)でRNA-sequenceを行った。このヒト肝臓における各lineage細胞群(8)における遺伝子発現プロファイルは世界初の試みであったが、この解析よりFL-HCC PDX由来ヒト腫瘍細胞はヒトBTSCに最も類似した遺伝子発現プロファイルを持つことが確認された (図3B)。
また近年、FL-HCC患者に特異的なfusion geneとしてDNAJB1-PRKACAが報告された(9, 10)。このDNAJB1-PKRACAを上記5細胞群でRNA-sequenceで確認したところ、幹細胞を含めたヒト正常細胞には認められず、FL-HCC PDX由来腫瘍細胞のみに認められた(図3C)。このことから我々の確立したFL-HCC PDX modelが正真正銘のFL-HCCであること、またこのfusion geneがFL-HCCの発症や進展に関与している可能性が示唆された(3)。
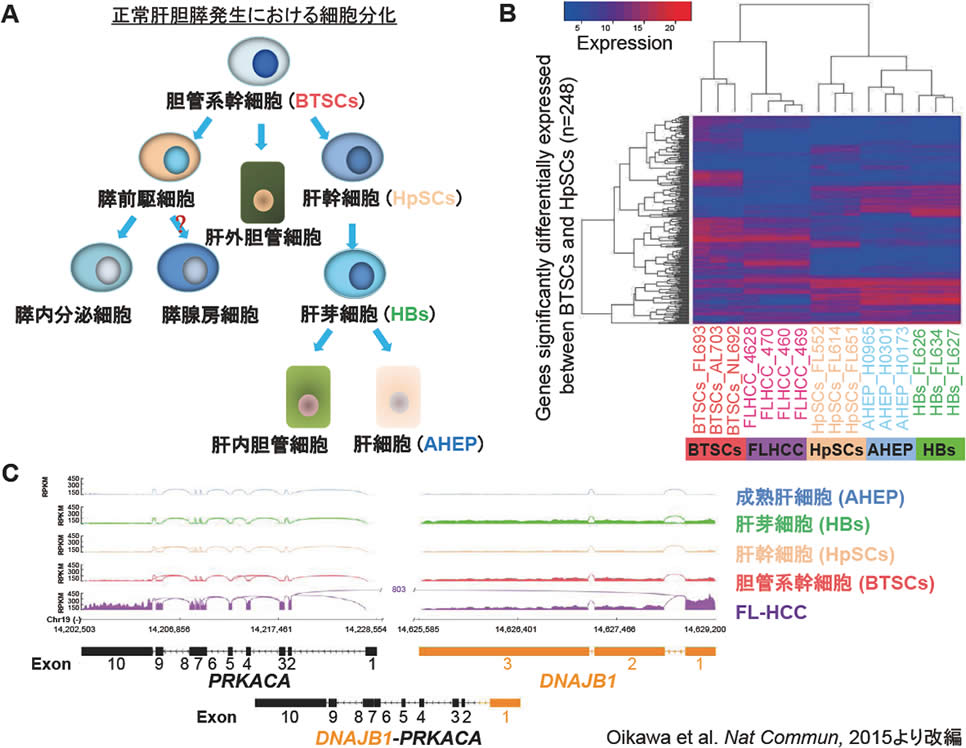
図3.FL-HCC PDX由来ヒト腫瘍細胞の遺伝子発現プロファイル
| A. | 正常肝胆膵発生における細胞分化。 |
| B. | RNA-sequenceを用いたFL-HCC PDX由来ヒト腫瘍細胞とヒト正常肝における各分化段階細胞(BTSCs; 胆管系幹細胞、HpSCs; 肝幹細胞、HBs; 肝芽細胞、AHEP; 成熟肝細胞)との遺伝子発現解析より、FL-HCC PDX由来ヒト腫瘍細胞の遺伝子発現プロファイルは胆管系幹細胞 (BTSCs)に最も類似していた。 |
| C. | FL-HCCに特徴的fusion geneとして同定されたDNAJB1-PRKACAの発現解析。FL-HCC PDX由来細胞ではこのDNAJB1-PRKACAが認められるのに対し、その他の幹細胞を含めた正常細胞群では認められなかった。 |
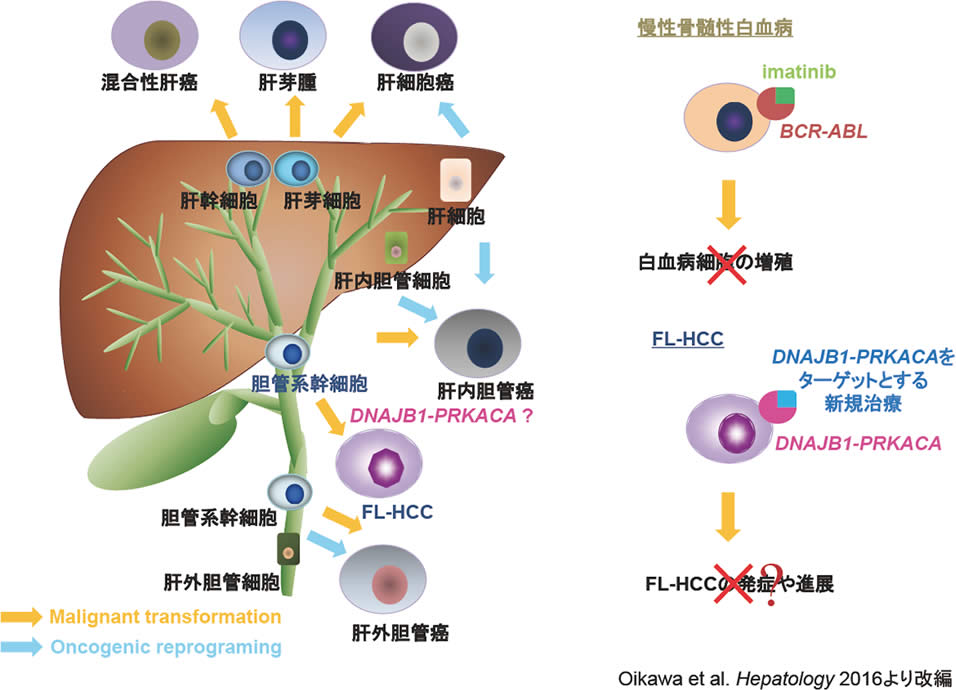
図4.原発性肝癌の起源とFL-HCCの将来的治療の可能性
原発性肝癌および癌幹細胞の起源については未だ不明であるが、筆者はFL-HCCにおいては正常胆管系幹細胞を起源として悪性形質転換が起こり、この悪性形質転換の誘導過程にDNAJB1-PRKACAがdriverとして働く可能性を考えている。現在、慢性骨髄性白血病において行われているfusion gene;BCR-ABLを標的とした治療およびFL-HCCにおけるDNAJB1-PRKACAを標的とした将来的な治療戦略の可能性。
おわりに
我々が樹立した世界初FL-HCC PDX tumor modelは、研究ツールとして従来困難であった癌幹細胞の自己複製・増殖・分化制御メカニズムを直接FL-HCC由来細胞およびマウス個体レベルでの解析を可能とし、FL-HCCの病態解明のみならず将来的な新規治療法の開発への応用を含め、FL-HCC研究のブレイクスルーにつながる可能性が期待される。筆者はFL-HCCは正常胆管系幹細胞を起源として悪性形質転換を起こし、この悪性形質転換の誘導過程にDNAJB1-PRKACAがdriverとして働く可能性を考えている (図4)。現在までにFL-HCC特異的な融合遺伝子DNAJB1-PRKACAまたこれにより作られる蛋白がFL-HCCの発症や進展に関与しているかは不明である。他の代表的融合遺伝子である慢性骨髄性白血病のBCR-ABLは現在、実臨床において診断に利用されるだけでなく、その機能阻害剤であるイマチニブは多くの患者救命に貢献し、さらにこれに続くニロチニブ、ダサチニブ、ボスチニブ、ポナチニブといった分子標的薬が次々に開発されている。FL-HCCにおいてもDNAJB1-PRKACAが病態形成や進展に関与することが証明できれば、バイオマーカーとしての使用のみならず、DNAJB1-PKRACAを標的とする新規治療法開発への急展開につながり、多くのFL-HCC患者に大きな貢献ができる可能性があるため、今後さらなる解析が待たれる。
謝辞
最後にこの研究を支援していただいたノースカロライナ大学Lola Reid博士、Praveen Sethupathy博士をはじめとする共同研究者の皆様、貴重な検体をご提供していただいた患者ご家族、Fibrolamellar Cancer Foundation (http://fibrofoundation.org/) に感謝申し上げます。
参考文献
- Torbenson, M. Fibrolamellar carcinoma: 2012 Update. Scientifica. 2012, 743790 (2012).
- Cornella, H. et al. Unique genomic profile of fibrolamellar hepatocellular carcinoma. Gastroenterology. 148, 806–18 (2015).
- Oikawa T. Wauthier E, et al. Model of fibrolamellar hepatocellular carcinomas reveals striking enrichment in cancer stem cells. Nat Commun. 6, 8070. (2015).
- Nakanuma Y, et al. Microstructure and development of the normal and pathologic biliary tract in humans, including blood supply. Microsc Res Tech.38:552-70 (1997).
- Cardinale, V. et al. Multipotent stem cells in the extrahepatic biliary tree give rise to hepatocytes, bile ducts and pancreatic islets. Hepatology .54, 2159–72 (2011).
- Cardinale, V. et al. The biliary tree: a reservoir of multipotent stem cells. Nat. Rev. Gastroenterol. Hepatol. 9, 231–40 (2012).
- Oikawa T. Cancer stem cells and their cellular origins in primary liver and biliary tract cancers. Hepatology, 64, 645-51 (2016).
- Turner, R. et al. Hepatic stem cells and maturational liver lineage biology. Hepatology. 53, 1035–45 (2011).
- Honeyman, J. N. et al. Detection of a recurrent DNAJB1-PRKACA chimeric
transcript in fibrolamellar hepatocellular carcinomas. Science .343, 1010–4
(2014).
- Xu, L. et al. Genomic analysis of fibrolamellar hepatocellular carcinoma. Hum.
Mol. Genet. 24, 50–63 (2015).










