Master's Perspective
疾病構造の変化を見据えた肝細胞研究の方向性
大阪中央病院特別顧問・熊本大学名誉教授
佐々木裕
近年のウイルス性肝疾患治療の進歩により、肝硬変や肝細胞癌(以下、肝癌)の成因がB型・C型肝炎ウイルスからアルコールや肥満など生活習慣に移行しており、アルコールを含めた肝臓を取りまく栄養環境が肝疾患の病態形成や進展に関与することが注目されるようになった。このような状況の中で、脂肪性肝疾患に対する疾患概念の見直しが行われた。例えば、従来のNAFLD(nonalcoholic fatty liver disease、非アルコール性脂肪性肝疾患)、NASH(nonalcoholic steatohepatitis、非アルコール性脂肪肝炎)は、メタボリック症候群の基準の一部を満たす場合に限定して、MASLD(metabolic dysfunction associated steatotic liver disease)、MASH(metabolic dysfunction associated steatohepatitis)と定義されるようになった。さらに 2023年6月には欧州肝臓学会、米国肝臓病学会などから合同で新たな包括的な概念として Steatotic liver disease(SLD、脂肪性肝疾患)が提唱され、アルコール性肝疾患はalcohol-associated (alcohol-related) liver disease(ALD)、飲酒量がALDとNAFLD の中間でメタボリック症候群の基準の一部を満たす場合はMetALD、薬物性、Wilson病などに起因する場合は specific aetiology SLD、NAFLDでメタボリック症候群の基準の何れも満たさない場合はcryptogenic SLDと定義され、このような種々の脂肪肝がSLDに統合されることになった(https://doi.org/10.1016/j.jhep.2023.06.003)。
そもそも脂肪肝では原因が何であれ、全身的には高脂肪負荷(lipid overload)な環境である。脂肪組織で脂肪の貯蔵量を超えるような状態になると、アデイポサイトカインの分泌変動やインスリン抵抗性が誘発され、糖代謝や脂質代謝の恒常性が破綻をきたす。その結果、肝細胞で産生される、あるいは脂肪組織から遊離し肝細胞に取り込まれる遊離脂肪酸(FFA)は、脂肪毒性という形でミトコンドリア障害を惹起し、酸化ストレスの発生や肝細胞障害に結び付く。さらに多量な FFA を取り込んだクッパー細胞から放出された炎症性サイトカインにより炎症が誘発され、肝線維化へと結び付く(https://doi.org/10.3389%2Ffmed.2021.615978)。一方、肝癌細胞ではlipid overloadな環境に対して代謝リプログラミングが誘導される。例えば、高脂肪食飼育下の肝発癌モデルマウスでは、脂質β酸化のkey enzymeであるCPT2 の発現が肝癌細胞で低下して脂肪毒性による細胞死が回避されると共に、脂質代謝の中間代謝物が STAT3 の活性化を介して肝癌細胞の増殖を亢進する”疾患メタボライト”として働く(https://doi.org/10.1136/gutjnl-2017-315193)。また、近年増加傾向にある非B非C肝癌では、脂肪を含有する肝癌細胞の周辺では免疫細胞に疲弊が生じているが、その一因として飽和脂肪酸が肝癌細胞表面上の免疫チェックポイント分子PD-L1の発現を増強させ、肝癌組織に集まってきた細胞障害性T細胞上のPD-1との結合を介して、T 細胞の活性を抑制することが報告されている(DOI: 10.1002/hep.32573)。このような代謝リプログラミングは低栄養状態、とくにグルタミンの欠乏状態でも観察され、癌細胞では細胞膜リン脂質の合成経路が阻害され、中間代謝物が蓄積することで栄養飢餓に対する耐性を獲得すると共に、増殖が促進されることが明らかになっている(https://doi.org/10.1016/j.celrep.2019.08.087)。
代謝リプログラミングでは、代謝酵素やその関連遺伝子群の発現変化を伴うことから、統合的なエピゲノム制御が関与していることが考えられる。かかる状況において近年のニュートリゲノミクス(NutritionとGenomicsとの合成語)の進歩により、栄養・代謝物と遺伝子発現との相互作用が解明されつつある。具体的には、栄養素摂取や代謝状況が DNA のメチル化、ヒストンのメチル化、アセチル化等のエピゲノム制御を介して遺伝子発現を変化させ、正常な細胞機能の維持に働く場合もあれば、メタボリック症候群や発癌に結び付く場合もある。例えば、高脂肪食投与マウスでは、ヒストン脱メチル化酵素LSD2の発現亢進により脂質代謝関連酵素の発現制御がもたらされ、脂肪毒性による肝細胞障害が回避される(https://doi.org/10.1128/MCB.01404-14)。このようなクロマチンを修飾する酵素は、栄養由来の代謝物を基質と補酵素として利用するため、エピゲノム制御は、生来、栄養状態と代謝状況に大きな影響を受けることは予想される。
今後、遺伝子・蛋白質の網羅的な発現解析、蛋白質の機能解析、代謝物のメタボローム解析、エピゲノム解析などを統合したマルチオミクス解析を通して、種々の栄養環境における代謝リプログラミングを時空間的に解析することで、代謝リプログラミングの制御による肝疾患の進展や発癌を予防する治療法の開発に結び付くことが期待される。
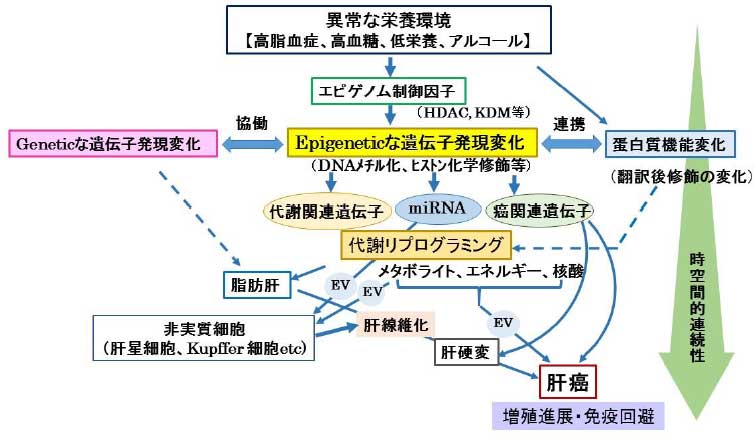
加えて、このような代謝リプログラミングを、非侵襲的に診断・評価するために、新たなバイオマーカーの同定も急務である。近年、すべての種類の細胞が分泌する細胞外小胞(Extracellular vesicle, EV)が注目されている。EVは脂質、蛋白質、RNA、miRNA、メタボライトなどを含有し、さまざまな細胞間情報伝達を担い、その結果、組織内応答を誘導する。このような観点から、異常な栄養環境に対する代謝リプログラミングが、肝細胞や肝癌細胞より分泌されるEV内のいかなる含有物の変動に反映されるかが明らかになれば、バイオマーカーとして臨床的な意義は大きい。
今後、アルコールを含めた異常な栄養環境に起因する肝疾患が増加していく状況において、代謝リプログラミングの詳細な解明とそれを反映するバイオマーカーの同定は、肝疾患の発症・進展、肝発癌を予防し抑制するうえで、今後ますます重要な研究テーマとなるものと考える。










