Master's Perspective
肝発癌にリンクする前駆細胞はOval Cells or Hyperplastic Nodules ?
沖田 極
山口大学名誉教授
はじめに
私の生涯の師匠と仰ぐFarber Eは(図1)、ethionine, 2-acetylaminofluorene (2-AAF), 3-methyl-4-dimethylaminoazobenzene(3’-Me-DAB)という3種類の肝化学発癌剤を混ぜた飼料でラットを飼育し、いずれの肝発癌剤投与においても初期の特徴的形態変化として門脈域周辺におけるoval cell(卵円形細胞)の出現とその後の短期間での消失、更にhyperplastic noduleという小型肝細胞増殖巣が肝発癌期まで観察されることを明らかにした(1)(図2)。Farberはoval cellの形態から胆管細胞への分化を考え、また、発癌剤投与開始後1か月以降から発癌期まで持続的に観察されるhyperplastic noduleが肝発癌に関わる前癌病変と考えた。即ち、肝発癌剤で生じた変異肝細胞(initiated hepatocyte)が過形成巣(hyperplastic foci)を形成し、promotion➡selection➡progressionという多段階を経て発癌するという仮説である(2)(図3)。但し、hyperplastic noduleもそれを構成する肝細胞には小型でhyperbasophilicなものから、clear celltype, 更には大型細胞と様々であり、hyperplastic noduleはselectionの過程でremodelingやapoptosisを生じながら、より異型性の強い結節巣から発癌すると考えた。Sell SやThorgeirsson Sは肝発癌におけるoval cellの重要性をphenotypeの面から強調している。因みに、Sellは肝発癌研究でFarberの指導を受けたがFarberのhyperplastic nodule説に異を唱えたためか袂を分けた。その後、肝発癌に連結する前癌性病変を巡りoval cell説とhyperplastic nodule説が今日まで激しく議論されてきた。そこで、Master’s Perspectiveには相応しくないとは思いつつも両者の論点の違いを私見を交えて紹介し肝細胞研究会ホームページ委員長である仁科博史教授からのご依頼の責を果たしたい。

図1:私のFarewell Partyでシャンパンの栓を抜くFarber教授
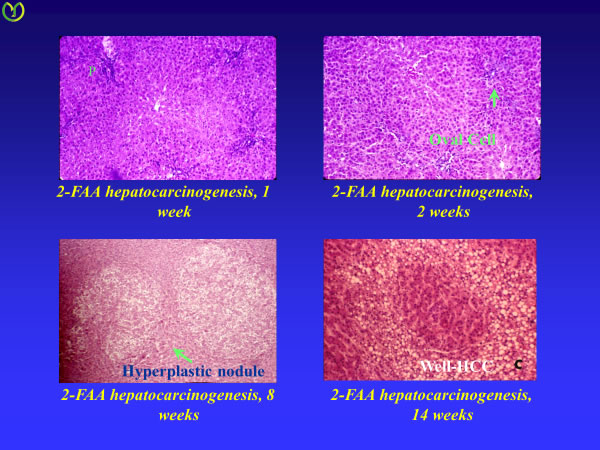
図2:2-fluorenylacetamide (2-FAA)による肝発癌過程の初期変化
投与開始後1週目から門脈域周辺にoval cellの増殖像をみとめる
投与2週目にはoval cellの集簇像は消失
投与8週目には様々な形態のhyperplastic noduleが見られる。本スライドでは淡明細胞で構築されている。
投与14週では結節内結節として小型異型肝細胞の増殖巣が見られる。高分化肝癌と診断
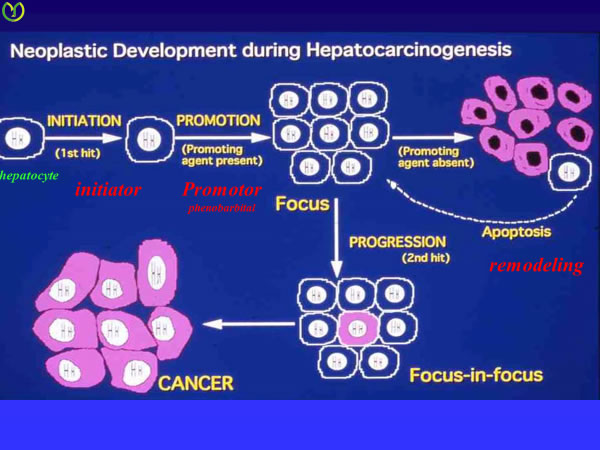
図3:肝発癌に関するFarber仮説
発癌剤によりinitiateされた変異肝細胞はpromoter存在下で増殖巣を形成する。宿主の種々な環境下でhyperplastic noduleはselectionされ、一部はremodelingし、一部のhyperplastic noduleからfocus in focusの様式で発癌する。
Oval cellを肝発癌における前駆細胞(progenitor cell)とする根拠
Farberは肝発癌剤投与開始後数週間で門脈域に出現するoval cellを胆管細胞に分化する細胞と考えたが、この細胞は肝細胞が増殖できないような重篤な肝障害で観察され、肝部分切除後の再生肝や四塩化炭素単回投与の肝障害では出現しない。従って、Farberが考えたようにductular reactionであり、肝再生が制限された場合に現れるfacultative stem cell、即ち、肝前駆細胞(liver progenitor cell: LPC)と考える研究者もいる(3)。Sellはoval cellを前駆細胞と考え今日に至っているが。その根拠としてoval cellのAFP(α-fetoprotein)産生能から幹細胞(stem cell)と考え肝細胞癌の幹細胞起源を提唱している (4)。Faustoらのgroupは健常ラット、ラット胎児肝、四塩化炭素投与ラット、3’- Me-DAB投与ラットにおけるAFPmRNAを測定し、胎児肝、oval cell, 肝細胞癌に強い発現を認めている(5)。Thorgeirrsonらは、oval cellの運命に関し超微形態学的、肝細胞マーカー(AFP, γGTP)、オートラジオグラフィと言った種々の手段で検討しているが、結論的にはoval cellは肝細胞に分化するとした(6)。また、この論文の中でSolt-Farberモデル(7)を用いると、oval cellの頻度と過形成性結節の頻度、更には肝発癌率が比例することも明らかにしている。しかしながら、oval cellから分化した肝細胞の肝発癌における意義については明確に述べていない。彼自身はoval cellからhyperplastic nodule へ,
そして肝発癌というlinkageを想定しているが、それを証明するエビデンスは示されていない。Fausto論文は、oval cellには、(a) 胆管細胞、(b)胎児性タンパクであるAFP産生能を有する一時的に出現するfacultative stem cell, (c) アルブミンやAFPを産生する肝細胞様の移行細胞、の3種のタイプがあることを明らかにしている。即ち、oval cellには多様性があるものの発癌に結び付く、所謂前駆細胞に進展するかどうかについては明らかにしていない。肝発癌におけるoval cellの意義を強調するSellの仮説(8)を図4に示した。表自体は複雑で判断が難しいが、要するに、oval cell‐肝癌のlineageの意義を強調したものであるが、oval cellをliver cancer stem cellと考えなければこの図は理解できないのではなかろうか。 一方、げっ歯類の化学肝発癌と同様にヒトの硬変肝でもAFP陽性oval-type cellが再生結節周辺に観察される。ThorgeirssonのグループはAFP産生能やCK19の局在(9)、また、HBs抗原、HBc抗原、更にTGF-αの発現からoval cellの肝発癌との関りを論じている(10)。
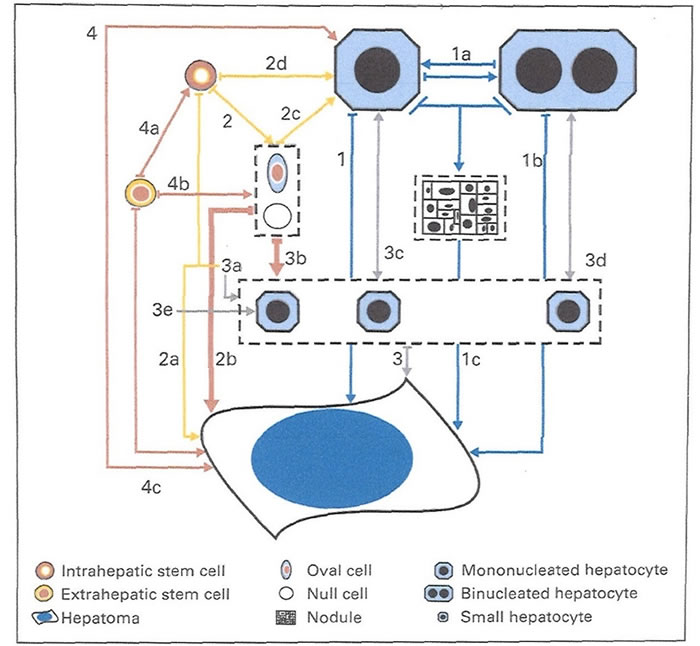
図4:肝発癌にリンクする前駆細胞としてoval cellを重要視するSellの仮説
肝発癌に到る様式として4種をあげているが、pathway 2,3はoval cellの肝発癌における 重要性を強調している。彼は、periductular oval cellから、更にadult ductal liver progenitor cell から胆管細胞癌や肝細胞癌が発生すると考えている。
Hyperplastic noduleを肝発癌の前癌病変(preneoplastic lesion)とする根拠
肝発癌に結びつく前駆細胞としてoval cellをhepatic stem cellとして重要視するグループに対し、oval cellは胆管上皮細胞として肝発癌には直接結びつかないとするグループがあり、数十年にわたって激しい論争が行われてきた。前者がSellや、Thorgeirssonであり、後者がFarber一門である。Farberは病理形態学的な検討から過形成性結節を肝発癌に結びつく前癌性病変と考えた(2)。筆者は、2-FAAで飼育したラットに関し肝発癌期まで連続的にAFPの発現を免疫組織化学的に検討した(11)。確かに、飼育開始して1ヶ月までの早期の肝組織にはAFP陽性oval cellの著しい浸潤像が門脈域周辺に見られるが、その後oval cellは消えAFPの局在を示す好塩基性小型肝細胞の集簇像(hyperbasophilic foci)が観察されるようになる。Hyperbasophilic fociはpromotion, selection, progressionの過程で小型肝細胞からなる過形成性結節、大型肝細胞からなる過形成性結節、clear cellからなる過形成性結節など様々な形態を呈しながらAFP陽性の肝細胞癌が出現する。oval cell出現と過形成性病変の出現とは時間的にずれがあり、oval cellと過形成性病変との関連はあるのか、過形成性病変は変異肝細胞の直接的な増殖を意味するのかは未だ不詳である。過形成性結節に関してはAFP以外にもマーカーを見出し発癌との強い関連を示すエビデンスが必要と考え、結論的にはγGTPが過形成性結節と肝癌で局在が見られること、また、二つの病変に共通に存在するPN抗原(preneoplastic antigen、後にepoxide hydraseであることが証明された)を見出し(12)、過形成性結節の究極的前癌性病変(ultimate precursor lesion)としての可能性を論じた(図5)。hyperplastic noduleを究極的前癌性病変とするにはnoduleを構成する細胞の自律性/自己増殖性を証明する必要がある。筆者も肝発癌過程のラットから様々なサイズのhyperplastic noduleを単離しchamberに入れ発癌過程のラット腹腔内に戻しこれら細胞の変化をみることを行ったが徒労に終わった。ところが、LaconiらはSolt-Farberモデルで得られた過形成性結節から遊離細胞(GST7-7陽性)をretrorsineで肝細胞増殖を抑制したラットの門脈から注入したところrecipientの肝にGST7-7陽性細胞巣の形成を認めている。つまり、過形成性結節を構成する細胞は特殊な環境で自律増殖が可能であることを証明し、過形成性結節から肝癌へのlineageを明らかにした(13).
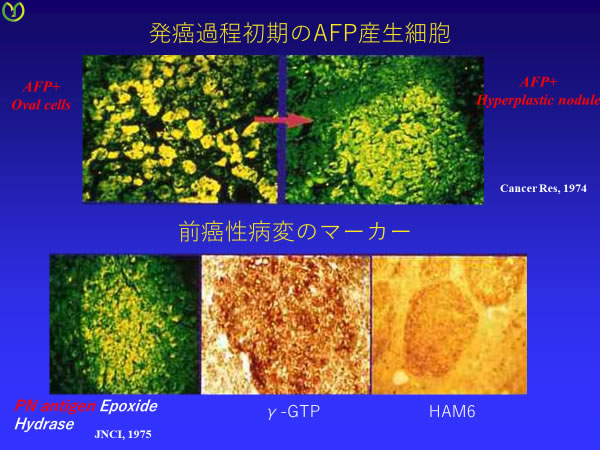
図5:hyperplastic noduleと形質発現
AFP:門脈周囲のoval cellに局在が見られ、oval cellの消失と共にhyperplastic noduleを構成する細胞に再び局在が見られる。 PN抗原:hyperplastic noduleと肝癌に共通して存在する。 γGTP:hyperplastic noduleの細胞に酵素活性を認める。 HAM6:hyperplastic noduleから細胞を単離しmonoclonal抗体を作成し、 HAM6というhyperplastic noduleに存在するタンパクを発見した。
げっ歯類の化学肝発癌において肝癌と結びつく(究極的)前癌性病変についての議論は上述した通りであるが、ヒト肝発癌に関しては、異型度の低いdysplastic nodule(low)から異型度の高いdysplastic nodule(high)を経て高分化から低分化の肝癌へと多段階的に進展することでコンセンサスが得られている(12)。筆者らはdysplastic noduleの前の段階の異型肝細胞集団としてsmall cell dysplasiaの存在を明らかにしている(13)。ヒトの肝癌はHBV、HCVの長期の持続感染やNASH/NAFLDに見られる長期の肝代謝障害を背景に発生することから上記のような組織変化を伴う多段階的発癌を考えるのが一般的である。
平成30年6月に開催された第45回日本肝癌研究会総会(会長:久留米大学医学部中島 収教授)の折に旧知のNeil David Theise教授(New York大、病理)にFarber亡き後(2014年に死去)や研究の第一線から退いたThorgeirsson教授以降のoval cell研究の動向を尋ねたが肝発癌との関連を肯定する意見はマイナーとなっているとのことであった。但し、アメリカ人的な言い回しではあるが“議論を続けていればグラントが稼げる”とも言っていた。
むすび
Farberが形態的に卵円形を示すoval cellと腺腫様過形成巣、即ち、hyperplastic noduleがラット肝化学発癌過程に特徴的に発現すると記載して以来、oval cellの肝発癌過程における意義について多くの議論が戦わされ、かれこれ60年が経過した。oval cellの運命に関し、肝発癌早期に一時的に出現するも短期間で消失することから直接肝発癌に結び付く細胞とは考え難い。Sellはoval cellにliver cancer stem cellの可能性を求め、Thorgeirssonはhepatic stem cellの可能性を考えている。しかしながら、oval cellの細胞動態を見ればfacultative stem cellとし胆管細胞へ、あるいは成熟肝細胞へ分化すると考えるべきであろう。宮島の見解に従うものである。oval cellの関りを重要視するSellの仮説を証明するには、cancer stem cellとしてのマーカーの存在を明らかにすべきであり、もしも存在が証明できれば再びoval cellの肝発癌に於ける意義が議論の対象となろう。
文献
- Farber E: Similarities in the sequence of early histological changes induced in the liver of the rat by ethionine, 2-acetylaminofluorene , and 3’-methyl—dimethylaminoazobenzene. Cancer Res 1956 ;16:142-148
- Farber E: On the pathogenesis of experimental hepatocellular carcinoma. In Hepatocellular Carcinoma, edited by Okuda K & Peters R, Wiley Medical Publication, New York, 1976, pp.3-22
- Miyajima A, Tanaka M, Itoh T: Stem/progenitor cells in liver development, homeostasis, regeneration, and reprogramming. Cell Stem Cell 2014;14:561-574
- Sell S: Distribution of α-fetoprotein-and albumin-containing cells in the livers of Fischer rats fed four cycles on N-2-fluorenylacetamide. Cancer Res 1978;38:3107-3113
- Petropolos C.A, YaswenP, Panzica M, et al.: Cell lineages in liver carcinogenesis: possible clues from studies of the distribution of α-fetoprotein RNA sequences in cell populations isolated from normal, regenerating, and preneoplastic rat livers. Cancer Res 1985;45:5762-5768
- Evarts R., Nagy P., Marsden E., et al.: A precursor- product relationship exists between oval cells and hepatocytes in rat liver. Carcinogenesis 1987;8(11):1737-1740
- Solt D.B., Medline A., Farber E.:Rapid emergence of carcinogen-induced hyperplastic lesions in a new model for the sequential analysis of liver carcinogenesis. Am J Patholo 1977;88:595-618
- Sell S., & Leffert H.L.: Liver cancer stem cells. J Clin Oncol 26(17):2800-2805
- Hsia C.C., Evarts R.P., Nakatsukasa H., et al.: Occurrence of oval-type cells in Hepatitis virus-a ssocia ted human hepatocarcinogenesis. Hepatology 1992;16:1327-1333
- Hsia C.C., Thorgeirsson S., Tabor E.: Expression of hepatitis B surface and core antigens and transforming growth factor-αin “oval cells” of the liver in patients with hepatocellular carcinoma J Med Virol 1994;43:216-221
- Okita K., Gruenstein M., Kliber M., et al.: Localization of α-fetoprotein by immunofluorescence in hyperplastic nodules during hepatocarcinogenesis induced by 20acetylaminofluorene. Cancer Res 1974;34:2758-2763
- Okita K., Kligman. E., Farber E.: A new common marker for premalignant and malignant heparocyteinduced in the rat by chemical carcinogens. J Natl Cancer Instit. 1975;54(1):199-202
- Laconi S., Pani P., Pillai S., et al.: A growth-constrained environment drives tumor progression in vivo. Proc Natl Acad Sci USA 2001;98(14):7806-7811










