Master's Perspective
肝星細胞―私の研究から―
和氣健二郎
(株)ミノファーゲン製薬 肝臓リサーチユニット
東京医科歯科大学名誉教授
e-mail: k_wake@minophagen.co.jp tel: 03-3402-6224
肝星細胞の再発見
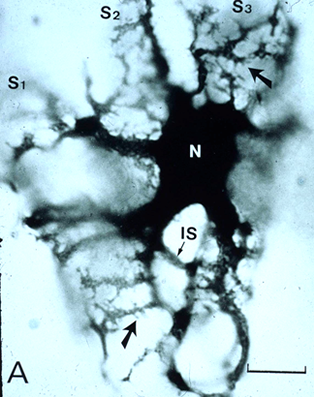
鈴木 清教授(大阪市大解剖学)はBielschowsky型鍍銀法(鈴木鍍銀法)を用いて肝臓の自律神経支配を観察していた。その神経終末は鈴木が‘Interstitial cells’(介在細胞)と命名した特殊な類洞周囲細胞に終っていた(1)。この細胞は鍍銀操作の最終過程で行う塩化金液処理によって、ひと際鮮やかに浮き出ることに気付いた鈴木は、この細胞が Kupffer(1876)が鍍金法(塩化金法)で報告した肝臓のSternzellen(星細胞)(2)ではないかと予想し、当時大学院生であった私にKupfferの方法を追試するように勧めた。この方法はラットの新鮮肝切片をクロム酸液で処理した後、希薄な塩化金溶液に一夜浸すという簡単なものであったが、繰り返し試みてみたものの星細胞は検出されなかった。塩化金法の追試はKupffer門下の Rothe(1882)の学位論文(3)以外に見当らなかった。その理由に方法の不安定性が考えられた。ある日家兎の肝臓を試してみたところ、星細胞が見事に染まった(4)。それは「赤い視野のなかに黒色の星が規則正しく散在している」というKupffer(1876)の記載通りであった(図1)。星細胞の細胞質内に明るく抜けた球状の構造物が観察された。Rothe(1882)はその構造物を「小さな核」と記載していた(3)。クロム酸処理の代わりにホルマリン固定でも反応することがわかり、脂肪染色との重染色が可能になった(5)。その標本で星細胞の脂肪滴表面に還元金の沈着が観察された。その脂肪滴は蛍光顕微鏡下でビタミンA蛍光を発したので、Rotheの「小さな核」はビタミンA脂質滴で、それが塩化金と反応することが分かった。星細胞を検出できなかったラットの肝臓もビタミンAを過剰に投与すると星細胞は強く染まった。つまり私たちが当時用いていたラットの飼料(当時は固形飼料ではなかった)はビタミンAが不足していたことがわかった。電顕観察により塩化金と反応する細胞は網内系のKupffer細胞ではなく、伊東俊夫教授(群馬大解剖学)が1951年に報告したFat-storing cells(脂肪摂取細胞)(6)に一致していた。 1920年代以降、30数篇の論文がビタミンAは肝網内系のマクロファージ(今日のKupffer細胞)に貯蔵されると記載していた(7)。それは蛍光顕微鏡下で肝小葉内に散在するビタミンA蛍光源はKupffer細胞以外にあり得ないと思われていたためである。一方研究史上報告されてきた類洞周囲細胞には、Kupffer(1876)とRothe(1882)の‘Sternzellen’以外に、Berkley(1893)の‘Granular cells’(ゴルジ法)(8)、Zimmermann(1928)の‘Pericyten’(ゴルジ法)(9)、伊東の‘Fat-storing cells’(脂肪染色)、および 鈴木の’Interstitial cells’(鈴木鍍銀法)がある。これらの細胞の異同を知るため、ラットに過剰のビタミンAを投与した後、肝組織にそれぞれの方法を施し無処置肝臓の細胞像と比較した。その結果いずれの細胞も脂質滴の増大により細胞は膨化していたので、上記の細胞はすべて同一の細胞であることが判明した。この細胞には20通りの名称が付されていた(7)が、国際的に名称を統一する機運が高まり、1996年に‘Hepatic stellate cell’(HSC)とすることが提唱された(Hepatology 23: 193, 1996参照)。
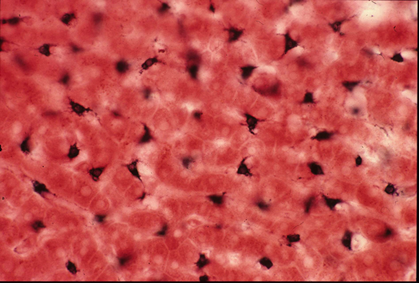
図1. ヒト肝臓の星細胞。Kupfferの塩化金法。
Sternzellen (Hepatic stellate cells) Human, Gold chloride method
Wake K et al (1986) Stain Technol 61: 193-200
肝星細胞とKupffer細胞との混同
20世紀の初頭からほぼ70年間に亘り、肝臓の網内系細胞が「Kupfferの星状細胞」と呼ばれてきた。この混乱の流れを辿ると、Kupffer(1898; 1899)(10, 11)の報告に行き着く。Kupfferは1876年に前記論文(2)を発表して以来、沈黙していたが、1898に至り再び星細胞についてドイツ解剖学会に報告した(10)。この発表でKupfferは『星細胞を22年前に発表したときは双刃刀Doppelmesserで作製した厚い切片で観察していたので、星細胞の位置を見誤っていた。今回凍結ミクロトームで作製した薄い切片で観察してみると、星細胞は特殊な内皮細胞で、墨を貪食することが判かった』と述べた。その根拠としてつぎの3点を挙げた。
- 塩化金と反応する星細胞と墨を貪食させた細胞の肝小葉内分布パターンは共に散在性で類似している。
- 塩化金標本で星細胞中の明るく抜けた球状構造(Rotheの「小さな核」)は「貪食された赤血球の断片」である。
- 類洞が収縮した標本では星細胞は肝細胞板側に付かず、類洞壁側に付く。
この学会発表は翌年膨大な原著論文(11)として発表され、以来真の星細胞は消失し、「Kupffer の星状細胞は肝臓の貪食細胞」が教科書に定着した。Kupfferがドイツ解剖学会で訂正論文を発表したのは1898年4月18日。その1週間後の4月25日にはクラクフのポーランド科学アカデミーで Browitz (1898)(12)が肝臓の食細胞は「類洞腔中に中吊りになっている細胞」と正しく発表をしていた(13)。しかし両者の矛盾は「食細胞の起源は内皮細胞」とする網内系学者の見解によって調整された(14)。
肝星細胞の位置と形態
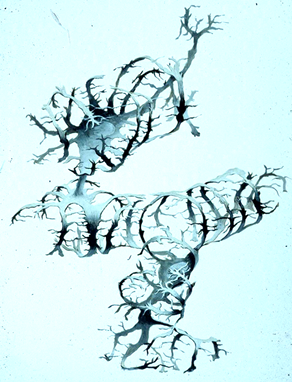
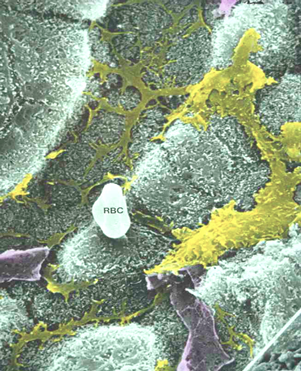
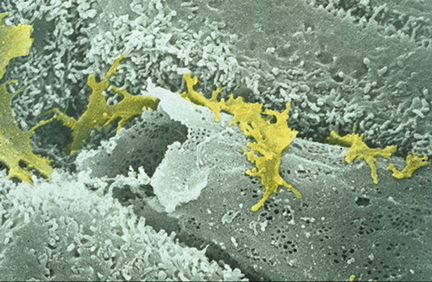
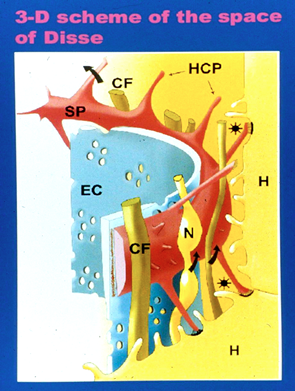
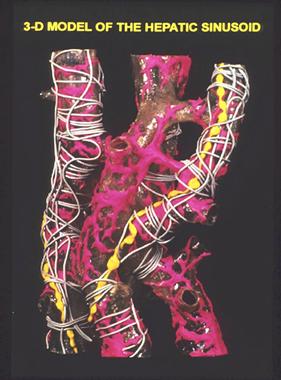
肝星細胞の細胞体は類洞の外側にあって、数本の長い突起(内皮下突起)で類洞内皮を外側から取り巻いている(15)(図2, 3, 4)。また肝細胞板を貫通し隣の類洞に達する突起(類洞間突起)も見られる。単一の星細胞が取り巻いている類洞の総距離は数十ミクロンから百数十ミクロンに達する(図2)。従って星細胞の表面積は極めて広い。その突起は3次元に広がっているので、細胞の全体像を通常の組織切片で観察することは難しい。6N-NaOHでコラーゲン線維を除去した後、肝組織を凍結割断しSEMで観察すると、類洞の外側が露出し、広い範囲に亘って星細胞を観察できる(16)(図4)。しかし標本の深部へ延びている突起は観察できない。星細胞のほぼ全体像が観察出来る唯一の方法はゴルジ法(切片の厚さは50ミクロン)である。ゴルジ法やSEMで観察された星細胞の特異な構造は内皮下突起の側縁から突出する多数の棘状突起で、これをspineと呼ぶ(図2, 4)。Spineは内皮面から斜めに立ちあがり、Disse腔を斜めに走行し、その先端付近で実質細胞の細胞膜と接着している(図5, 6)。つまり星細胞は内皮下突起によって類洞内皮に接着する一方、spineによって実質細胞に接着している。おおまかに計算してみると、単一の星細胞は1~3コの内皮細胞と20~40コの実質細胞と結合して細胞の連鎖を構成している。この細胞連鎖は肝組織内に構造的、機能的単位を形成していると考えられ、その単位をstellon(星細胞単位)と呼ぶことにした(15)。従来Disse腔とは「類洞内皮と実質細胞との間の間隙で、星細胞はDisse腔内に存在する」と定義されている。しかし厳密には星細胞は類洞内皮と密着しており、両者の間には正常肝では間隙は存在せず、両者は一つの細胞複合体cell complexを形成している。したがってDisse腔とはこの複合体と実質細胞の間の間隙と定義すべきである。類洞壁は外から内へ向って、コラーゲンの層、星細胞層、内皮細胞層が層状構造をつくり(図7)、さらにその内側にはKupffer細胞や樹状細胞、NK細胞など類洞内腔細胞群が付着している。星細胞のビタミンA脂質滴(以下A脂質滴)には膜で囲まれたI型と膜のないII型がある。I型は多胞体multivesicular body(MVB)から発達したものである(17)。
|
|
|
|
|
|
肝星細胞の小葉内部域差
肝構成細胞はすべて小葉内部域差 intralobular heterogeneityがある。肝星細胞は細胞形態と貯蔵ビタミンA量に部域差が認められる(18)。細胞形態ではP-C軸(P、門脈域;C、中心域)に沿ってPからCへ向かうほど細胞突起がよく発達している。1コの星細胞がもつA脂質滴のサイズ(ビタミンA量に比例する)は肝小葉内の2つの軸に沿って部域差がみられる(19)。第1はP-C軸では小葉の最辺縁部では小さく、辺縁部で最大になり、小葉部へ向かって次第に小さくなり、中心静脈周囲では脂質滴は消失する。第2はP-M軸(隣接小葉のC-C線とP-P線の交差点をMとする)のPからMに向かって次第に小さくなる。PからMに向かって門脈枝から類洞へ注ぐionlet venuleの数は減少しているので、M-C線近傍は血流の良くない領域である。その所見はその領域がもっとも血流の良い領域というRappaportの肝腺房説とは相容れない。以上の結果から肝小葉内では血流のより下流にある部分のビタミンAの貯蔵量は少ないと言える。
肝星細胞の主な機能
肝星細胞は生体のビタミンAの80%以上を貯蔵するとともに、コラーゲンを産生する(20)。1975-1985年のほぼ10年間は生化学者を中心にして肝臓のコラーゲン線維産生細胞は実質細胞とする見解が大勢を占めていた。1984年私たちは培養星細胞がI, III, IV型コラーゲンを産生することを最初に報告した(21)。その後内外の多くの研究者によって星細胞が肝線維化の主役を演じる事実が定着した。肝線維化モデルの作成には四塩化炭素(CCl4)投与とブタ血清投与が知られている。そのいずれも前もって、或は同時にレチニールエステルを投与すると線維化は抑制される(22)。Balb/cマウスにCCl4を単回投与すると5日後に実質内に肉芽腫が形成され、その内部に存在する星細胞は増殖し線維を産生する(23)。ブタ血清投与による肝線維化は、門脈域と中心静脈周囲の筋線維芽細胞の増殖が先行し(24)、ブタ血清抗原に対する免疫反応の関与が示唆される(25)。
肝臓以外の星細胞
産卵のため川を遡上するヤツメウナギ成体には、大量のビタミンAが肝臓、腸、腎、心臓、鰓、精巣、卵巣などに貯蔵されている(26)。肝臓では星細胞以外にも結合組織中の線維芽細胞が大きなビタミンA脂質滴を持つ(27)。腸では固有層、粘膜下組織、筋層の結合組織細胞(28)、腎では糸球体のメサンギウム細胞(29)や尿細管周囲細胞、鰓のpillar 細胞(30)などである。一方皮下結合組織、神経組織、脊索、体壁筋など体壁側の臓器や結合組織にはほとんどビタミンAは貯蔵されていない(26)。つまりヤツメウナギの間葉組織は内臓性と体壁性の異なる細胞系列からなり、前者はビタミンA貯蔵細胞系または星細胞系で、後者は線維芽細胞系と分類できることが明らかになった。この2系列は脊椎動物全般に共通しているが、哺乳類では肝星細胞のみが生理的状態で多量のビタミンAを貯蔵し、それ以外の臓器の星細胞はほとんど貯蔵していない。しかし過剰のビタミンAが摂取された場合には肝臓以外の内臓諸器官にも貯蔵するようになる。この現象は古くから栄養学者の間で「ビタミンAが肝臓から溢れる」と言われてきた。内臓諸器官に星細胞(ビタミンA貯蔵細胞)が存在することことから、これら臓器の線維化(例えば、間質性肺炎、膵線維症、腎硬化症など)は肝線維化と同様の機構で進展すると考えられる。
文献
- 鈴木 清 (1958) 組織の鍍銀法. 実験治療 No. 310-320
- von Kupffer C (1876) Ueber Sternzellen der Leber. Briefliche Mitteilung an Prof. Waldeyer. Arch mikr Anat 12: 353-358
- Rothe P (1882) Ueber die Sternzellen der Leber. Inaug.-Dissertation Munich University
- Wake K (1971) ‘Sternzellen’ in the liver: Perisinusoidal cells with special reference to storage of vitamin A. Am J Anat 132: 429-462
- Wake K, Motomatsu K, Senoo H, Masuda A, Adachi E (1986) Improved Kupffer's gold chloride method for demonstrating the stellate cells storing retinol (vitamin A) in the liver and extrahepatic organs of vertebrates. Stain Technol 61: 193-200
- Ito T (1973) Recent advances in the study on the fine structure of the hepatic sinusoidal wall. Gumma Rep Med Sci 6: 119-163
- Wake K (1980) Perisinusoidal stellate cells (fat-storing cells, interstitial cells, lipocytes), their related structrure in and around the liver sinusoids, and vitamin A-storing cells in extrahepatic organs. In: Bourne GH, Danielli JF (eds) Int Rev Cytol Vol 66, Academic Press, New York, pp 303-353
- Berkley HJ (1893) Studies in the histology of the liver. III The perivascular cells of the rabbit's liver. Anat Anz 8: 787-792
- Zimmermann KW (1923) Der feinere Bau der Blutcapillaren. Z f d ges Anat 63: 29-109
- von Kupffer C (1898) Ueber Sternzellen der Leber. Verh anat Ges 12 Versammlung in Kiel. pp 80-86
- von Kupffer C (1899) Ueber die sogenannten Sternzellen der Saeugethierleber. Arch mikr Anat 54: 254- 288
- Browitz T (1898), cited from Browicz T (1900) Ueber intravasculare Zellen in den Blutcapillaren der Leberacini. Arch mikr Anat 55: 420-426
- 和氣健二郎 (2009) Browiczの食細胞とKupffer の「いわゆる星細胞」. 解剖誌 84: 17-21
- Kawai Y, Smedsrod B, Elvevold K, Wake K (1998) Uptake of lithium carmine by sinusoidal endothelial and Kupffer cells of the rat liver: new insights into the classical vital staining and the reticulo-endothelial system. Cell Tiss Res 292: 395-410
- Wake K (2006) Hepatic stellate cells: Three-dimensional structure, localization, heterogeneity and development. Proc Jpn Acad, Ser B 82: 155-164
- Wake K (1999) Cell-cell organization and functions of ‘sinusoids’ in liver microcirculation system. J Electron Microscopy 48: 89-98
- Wake K (1974) Development of vitamin A-rich lipid droplets in multivesicular bodies of rat liver stellate cells. J Cell Biol 63: 683-691
- Wake K, Sato T (1993) Intralobular heterogeneity of perisinudoial stellate cells in porcine liver. Cell Tiss Res 273: 227-237
- Zou Z, Ekataksin W, Wake K (1998) Zonal and regional differences identified from precision mapping of vitamin A-storing lipid droplets of the hepatic stellate cells in pig liver: A novel concept of addressing the intralobular area of heterogeneity, Hepatology 27: 1098-1108
- Blomhoff R, Wake K (1991) Perisinusoidal stellate cells of the liver: Important roles in retinol metabolism and fibrosis. FASEB J 5: 271-277
- Senoo H, Hata R, Nagai Y, Wake K (1984) Stellate cells (vitamin A-storing cells ) are the primary site of collagen synthesis in non-parenchymal cells in the liver. Biomed Res 5: 451-458
- Senoo H, Wake K (1985) Suppression of experimental hepatic fibrosis by administration of vitamin A. Lab Invest 52: 182-194
- Lukita-Atmadja W, Sato T, Wake K (1993) Granuloma formation in the liver of Balb/c mice intoxicated with carbon tetrachloride. Virchows Archiv B Cell Pathol 64: 247-257
- Bhunchet E, Wake K (1992) Role of mesenchymal cell populations in porcine serum-induced rat liver fibrosis. Hepatology 16: 1452-1473
- Bhunchet E, Eishi Y, Wake K (1996) Contribution of immune response to the hepatic fibrosis induced by porcine serum. Hepatology 23: 811-817
- Wold H, Wake K, Higashi N, Wang D, Kojima N, Imai K, Blomhoff R, Senoo H (2004) Vitamin A distribution and content in tissues of the lamprey, Lampetra japonioca. Anat Rec 276A: 134-14 2
- Wake K, Motomatsu K, Senoo H (1987) Stellate cells storing retinol in the liver of adult lamprey, Lampetra japonica. Cell Tiss Res 249: 289-299
- Higashi N, Wake K, Sato M, Kojima N, Imai K, Senoo H (2005) Degradation of extracellular matrix by extrahepatic stellate cells in the intestine of the Lamprey, Lampetra japonica. Anat Rec 285A: 668-675
- Bauer P, Wake K (1996) Mesangial cells of the lamprey, Lampetra japonica, store vitamin A. Arch Histol Cytol 59: 71-78
- Wake K, Sato T, Ekataksin W, Kaneda K (1989) Pillar cells in gill filaments of the Lamprey, Lampettra japonica, store retinol. Biomed Res 10 (Suppl 3): 597-605
- Kawada N, Klein H, Decker K (1992) Eicosanoid-mediated contractility of hepatic stellate cells. Biochem J 285: 367-371