研究交流
ヒト肝細胞を持つキメラマウスの光と影
株式会社フェニックスバイオ
立野知世
1. はじめに
ヒト肝細胞キメラマウスの研究を1999年に開始してから23年になる。2004年に当時広島大学の吉里勝利先生率いる広島県地域結集型共同研究事業でmouse albumin enhancer/promoter urokinase-type plasminogen activator transgenic/severe combined immunodeficiency(uPA/SCID)マウスにヒト肝細胞を移植することにより、ヒト肝細胞キメラマウスが誕生した1)。当時、世界中でヒト肝細胞により置換されたマウスの開発が進められており、私達のキメラマウスは置換率が高く安定的に生産できるという点で優れていた。ヒト肝細胞キメラマウスが医薬品開発などに利用できるのではないかという期待から、株式会社フェニックスバイオが2002年に設立され、今では多くの製薬企業やアカデミアの研究者に利用されている。
マウス肝臓がヒト肝細胞で95%以上置換されていても、マウスは健康状態を保っており、長いものでは1年以上生きることができるというのは未だに不思議であるが、この異種キメラマウスが私達に教えてくれる異種移植による不具合を発見し追求したいと考えている。本総説では、ヒト肝細胞を持つキメラマウスの光と影というタイトルを付けた。ヒト肝細胞を持つキメラマウスはB型C型肝炎ウィルスやマラリアに感染することから新薬の薬効試験に利用することができる。また、ヒト型薬物代謝酵素を持つことから新薬のヒトにおける薬物動態の予測やヒト肝臓への毒性を予測することが可能である。キメラマウスの8割以上の遺伝子がヒト肝臓におけるヒト肝細胞の遺伝子発現の2倍の範囲内であることから、最近では核酸医薬や抗体医薬などのモダリティへの薬効試験や毒性試験への利用も増えつつある。これらのことは、ヒト肝細胞キメラマウスの光の部分である。しかし、免疫不全マウスの体の中とはいえ、マウスの体内に異種のヒト肝細胞が存在するということが、マウス本体やヒト肝細胞にとってどのような影響を及ぼしているのか、そのことによりどのような影が存在するのかを、私達は見逃さず捉えなければならない。影の部分を追求することがさらなるヒト肝細胞キメラマウスの改良に繋がり、これまで明らかにされていなかった生命科学のメカニズムの発見に繋がることを期待している。
2.ヒト肝細胞キメラマウス
1995年にDr. BrinsterのグループがuPA/nudeマウスにラット肝細胞を移植することによりラット肝細胞キメラマウスの作製に成功した2)。私達も含めこの論文を読んだ多くの研究者がヒト肝細胞を持つキメラマウスができるに違いないと研究を開始した。2001年ころからヒト肝細胞による置換率は低いもののヒト肝細胞の生着したキメラマウスが報告され始めた3)。私達はその競争の中で、2004年にuPA/SCIDマウスにヒト肝細胞を移植することにより70%以上の置換率を持つキメラマウスが作出できたことを発表した1)。現在、世の中で多く利用されているキメラマウスは、uPA/SCIDキメラマウス以外に、FRGマウス、TK-NOGキメラマウスが存在する。
Dr. Grompeのグループが開発したFRGマウスは、FAH(fumarylacetoacetate hydrolase)という酵素が欠損したチロシン血症モデルであるFAHノックアウト(KO)マウスに免疫不全マウスであるRag2KO/IL2RgcKOマウス、さらにNODマウスを掛け合わせたものをホストマウスとしている4)。チロシンはいくつかの酵素により代謝され、フマレートやアセトアセテートに分解される。チロシン血症患者は、このFAHが欠損しているが、体内でサクシニルアセトンが生じ、肝細胞壊死、血液凝固障害、腎尿細管障害が起きることが知られている。この症状はNitisinone(NTBC)を投与することにより改善され繁殖もできる。NTBCの投与を中止することによりマウス肝細胞壊死を誘導し、さらに肝細胞を生着を促すためにuPAのアデノウィルスを投与後、脾臓経由でヒト肝細胞移植を行う。その後は、NTBCの投与を調整しキメラマウスを作製する。ホストマウスもキメラマウスもYecurisという会社から販売されている。
2011年に実験中央研究所のDr. Suemizuらにより報告されたヒト肝細胞キメラマウスは、mouse albumin enhancer/promoter下にthymidine kinase(TK)の遺伝子をNOGマウスに導入したTK-NOGマウスをホストマウスとしている。6-8週令のTK-NOGマウスにガンシクロビルを投与すると肝障害が生じALTが上昇し、投与後7日目にヒト肝細胞を脾臓経由で移植する5)。このホストマウスやヒト肝細胞キメラマウスは、(株) インビボサイエンスから販売されている。このホストマウスには、雄性不妊という特徴があることから繁殖効率が悪く、また雌は肝障害が弱いことからホストマウスとして利用できないという特徴を持つ。この原因はTK遺伝子配列にあることから、mouse transthyretin enhancer/promoter下にTKの変異体m30の配列をNOGに導入したマウスが2022年に報告された。この改良により、雄性不妊が克服され、雌キメラマウスもできるようになった6)。
2. uPA/SCIDマウス
私達は、1999年に当時Dr. BrinsterらがJackson Laboratoryに寄託していたAlbumin enhancer/promoter uPA transgenicマウス7)を購入し、SCIDマウスと掛け合わせ、uPA/SCIDマウスを作製した。このマウスにヒト肝細胞を脾臓から移植すると、マウス肝臓の70%以上がヒト肝細胞で置換されたキメラマウスを安定的に作製できることを2004に報告した1)。uPAはセリンプロテアーゼであり、マウス肝細胞がuPAを発現し分泌することによって類洞内のECMを溶解し、移植した肝細胞が生着しやすくなると考えている。このことからFRGマウスでもuPAのアデノウィルスを移植前に投与している。また、マウス肝細胞はuPAの発現により増殖を抑えられているが、分泌されたuPAはHGFを活性化することも知られている。uPAの活性は3週令で高くその後低下する。私達は、3週令でヒト肝細胞を移植しているが、マウスの体の成長期の中、マウス肝細胞の増殖は抑えられヒト肝細胞は活発に増殖することから、マウス肝臓がヒト肝細胞で徐々に置換される。uPA/SCIDキメラマウスは、3週令の子マウスに移植していることと、マウス肝細胞の壊死や炎症は伴っていないという点で他の二種類のキメラマウスと異なっている。
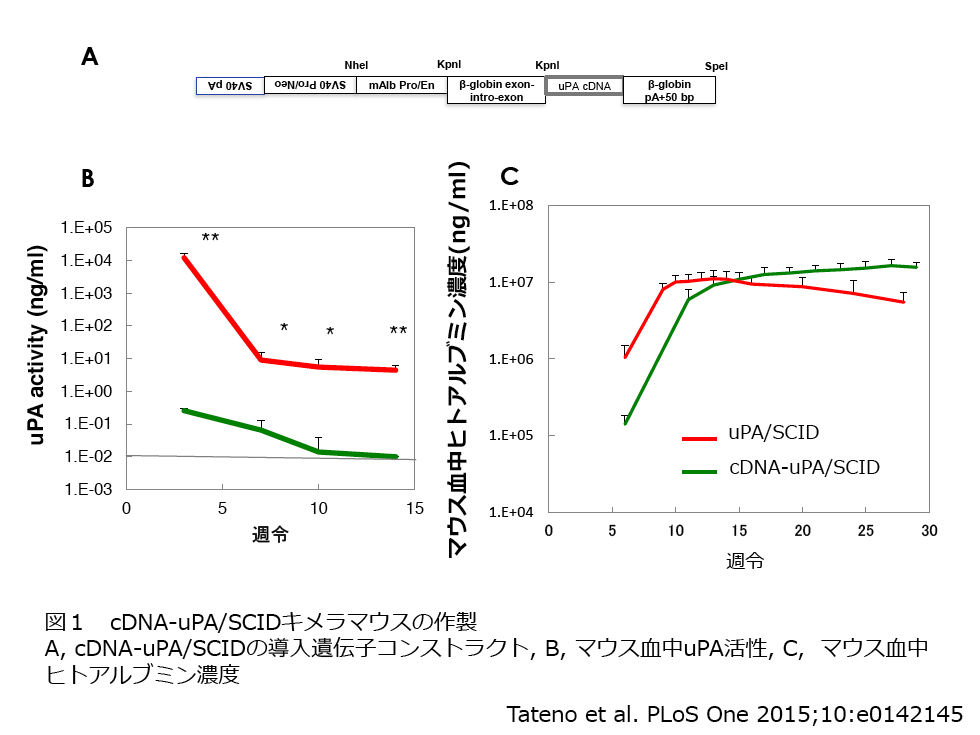
uPA遺伝子は、マウスuPAゲノムの遺伝子配列が5つタンデムにつながっていることから、肝細胞の細胞分裂時に相同組換えで遺伝子の欠失が起こり、uPA遺伝子が欠失したマウス肝細胞が正常化しコロニーを形成して徐々に大きくなることが知られている。この性質が非移植のホストマウスが生存・繁殖できる利点でもあるが、キメラマウスとなった後、16週令以降からマウス肝細胞コロニーの出現によりヒト肝細胞の置換率が低下するマウスも見られ、長期間の試験が難しいという問題点があった。さらに、このキメラマウスには体が小さい、腎障害があるという特徴もあった。これらは、キメラマウスにおける影の部分であり、これらの問題を克服するために私達は新たなホストマウスの開発に取り組んだ。導入遺伝子の欠失が起こらないように、ゲノムuPAをuPAのcDNAに変更したコンストラクトによりホストマウス(cDNA-uPA/SCIDマウス)を作製したところ、これまでと同様にヒト肝細胞キメラマウスを作製することができた。このホストマウスのuPA活性では、これまでのマウスよりも1/10000と低いが、ヒト肝細胞の生着には十分であった。これまでのようなマウス肝細胞のコロニーは観察されず、ヒトアルブミン濃度、すなわち置換率も下がることなく30週令以上維持でき、体重も大きく、腎臓にも障害は見られなかった8)(図1)。
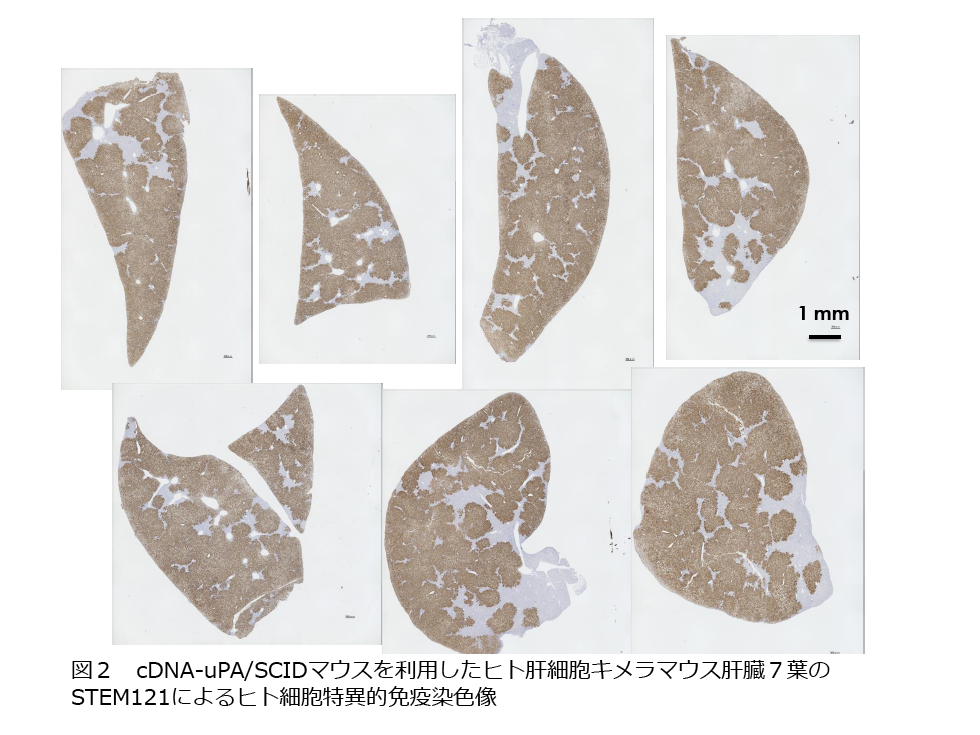
マウスには7葉肝臓があり、パラフィン切片をヒト特異的な抗体STEM121で染色することにより、各葉の置換率と重量比から全体の置換率を求めている。置換率とマウス血中ヒトアルブミン濃度との相関をとることにより、70%以上の置換質を持つマウスを識別することができる(図2)。ホストマウスの生産は、cDNA-uPA/SCIDマウスのホモコロニーを維持し、生産コロニーとしては、ホモ雄とSCID雌を掛け合わせ、cDNA-uPA(+/-)/SCIDをホストマウスとしてヒト肝細胞を移植している。生産コロニーを掛け合わせてから3週目で子マウスが生まれ、3週令の子マウスに脾臓経由でヒト肝細胞を移植するため、マウスが16週令になるのは掛け合わせを開始してから約5か月後になる。私達は、東広島市の(株) フェニックスバイオで2009年から年間3000-4000匹の置換率70%以上のヒト肝細胞キメラマウス(PXBマウス )を生産している。
3. uPA/SCIDマウスの性質
キメラマウスから分離したヒト肝細胞とヒト肝臓組織から分離したヒト肝細胞の遺伝子発現をマイクロアレイ解析で調べたところ、約84%の遺伝子がキメラマウス肝細胞とヒト肝細胞で2倍の範囲内で発現していた9)。また、同じドナー肝細胞を2種のホストマウスuPA/SCIDとcDNA-uPA/SCIDに移植し、肝臓の遺伝子発現を比較したところ、第1相薬物代謝酵素、第2相薬物代謝酵素においてはほぼ同等であった。さらに、異なるドナー肝細胞を同じホストマウスに移植した時の遺伝子発現のピアソンの相関係数はいずれも0.95以上でかなり一致していることがわかった。通常ヒトにおいては異なる体の中に肝細胞が存在しているが、同じホストマウスの体の中に異なるドナー肝細胞が存在すると、多くの遺伝子発現は同等で、遺伝子多型などによる遺伝子発現の違いがより明らかに観察できるのではないかと考えられる8)。
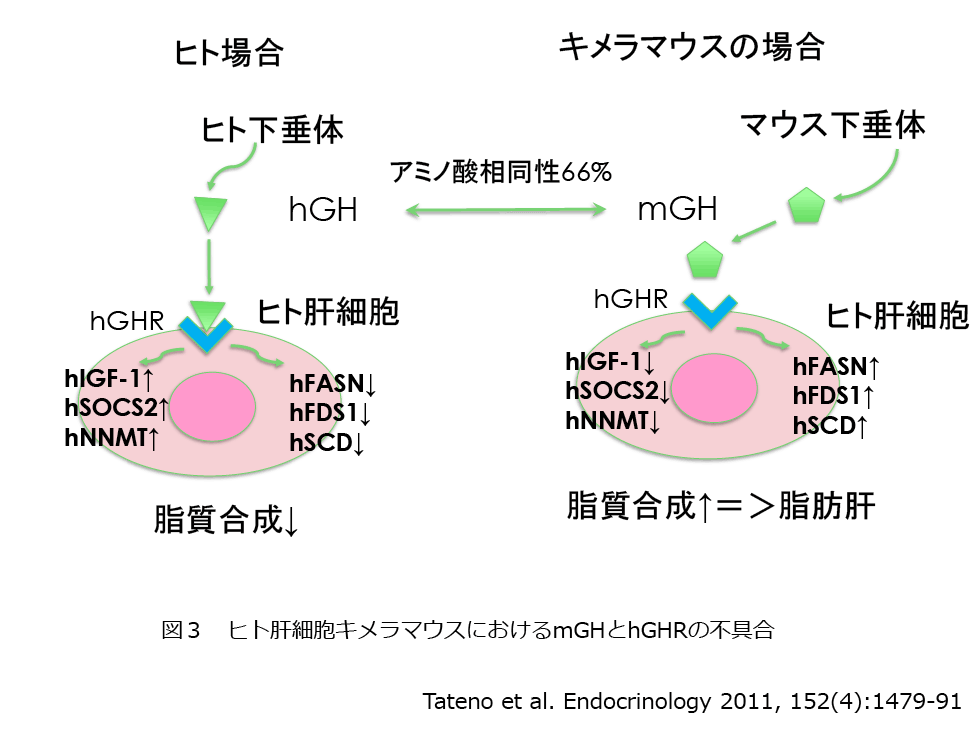
ヒト肝細胞キメラマウスの影の部分を紹介する。キメラマウスでは肝細胞はヒト由来であり、肝細胞以外はマウス由来である。これまで、この種差を起因とした二つの不具合が知られている。一つ目は、マウス下垂体から分泌されるmouse growth hormone(mGH)とヒト肝細胞のhuman GH receptor(hGHR)の不具合である。hGHは下垂体から分泌されヒト肝細胞のhGHRに結合する。その結果、hIGF1, hSOCS2, hNNMTなどが上昇し、脂質の合成酵素、hFASN, hFDS, hSCDなどが抑えられている。キメラマウスの場合、マウスの下垂体から分泌されたmGHはヒト肝細胞のhGHRに結合できないことから、脂質合成遺伝子は上昇し、hGH欠損患者と同様脂肪肝を呈している(図3)。キメラマウスの肝臓は、オイルレッドOで染めると赤く染まる脂肪滴が多く存在するが、hGHを2.5 mg/kgを2週間オスミックポンプで投与すると脂肪肝は改善する10)。最近ではマウス血中でのhGH濃度がよりヒトでの生理的な濃度に近くなるhGHの投与量を検討している。
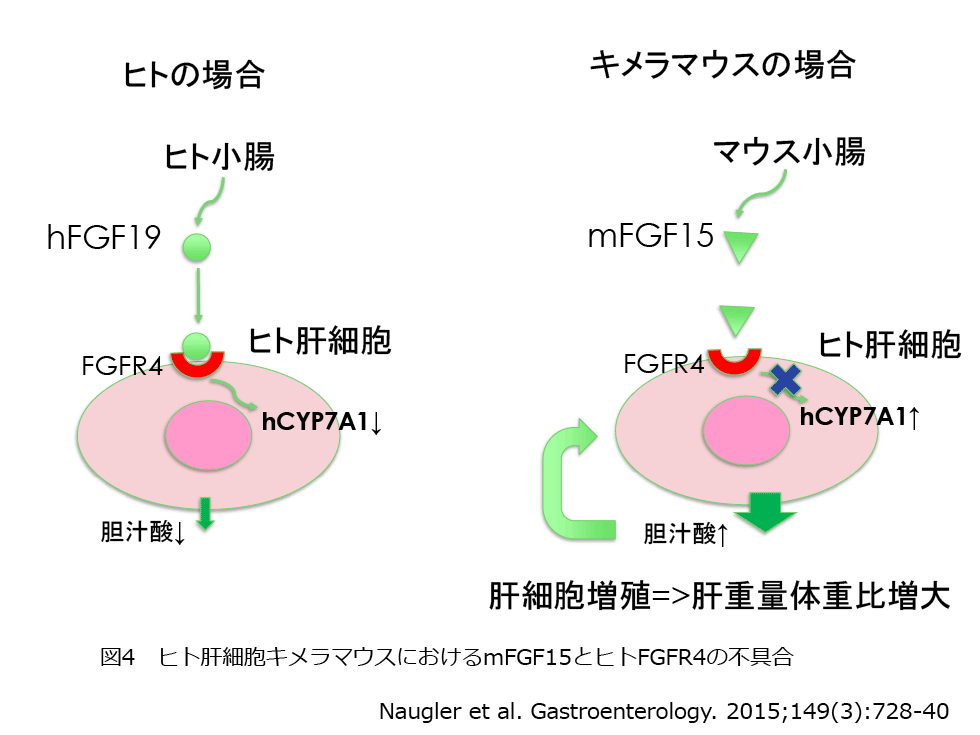
もう一つの不具合はマウス回腸から分泌されるmFGF15とヒト肝細胞のhFGF receptor 4(hFGFR4)の不具合による。キメラマウスは置換率が高くなるにつれて血清中胆汁酸濃度が高くなり、移植日数が経つにつれて胆汁酸合成酵素であるhCYP7A1が上昇する。さらに、置換率の上昇とともに肝重量体重比が高くなる。置換率70%以上のキメラマウスでは、肝臓重量は通常マウスの2倍以上となる。胆汁酸の一種コール酸は肝細胞の増殖を促進することが知られていることから、肝細胞の増殖が刺激され続けると考えられている。このメカニズムはDr. Grompeのグループにより報告された11)。ヒトの場合はヒト回腸からhFGF19が分泌されヒト肝細胞のhFGFR4に結合すると、hCYP7A1の発現が抑制され胆汁酸量が調節されている(図4)。キメラマウスにhFGF19を投与することにより、hCYP7A1の低下、血中胆汁酸の低下、肝重量が正常化することが示されている。現在、キメラマウスのホストマウスにhFGF19を導入する方法が検討されている。
キメラマウスとヒトが一致している点は、血清中のLDL/HDL比12)、胆汁酸の1次、2次比率13)、胆汁酸のグリシン抱合タウリン抱合比13)、多くの遺伝子・タンパク質発現9,14)、肝細胞と非実施細胞の組織構築9)などがあげられる。一致しない点は、影の部分と言えるが、脂肪肝であること、血清中高胆汁酸濃度、肝細胞索が2列であることなど9)があげられる。また、忘れてはならないのは、ヒト肝細胞キメラマウスは免疫不全マウスであるため免疫細胞が存在しない、肝非実質細胞はすべてマウス由来であること、さらに、腸内細菌がマウスであることである。これらの影の部分は、今後のキメラマウスの改良のテーマである。
4. キメラマウスを用いた疾患モデルマウス
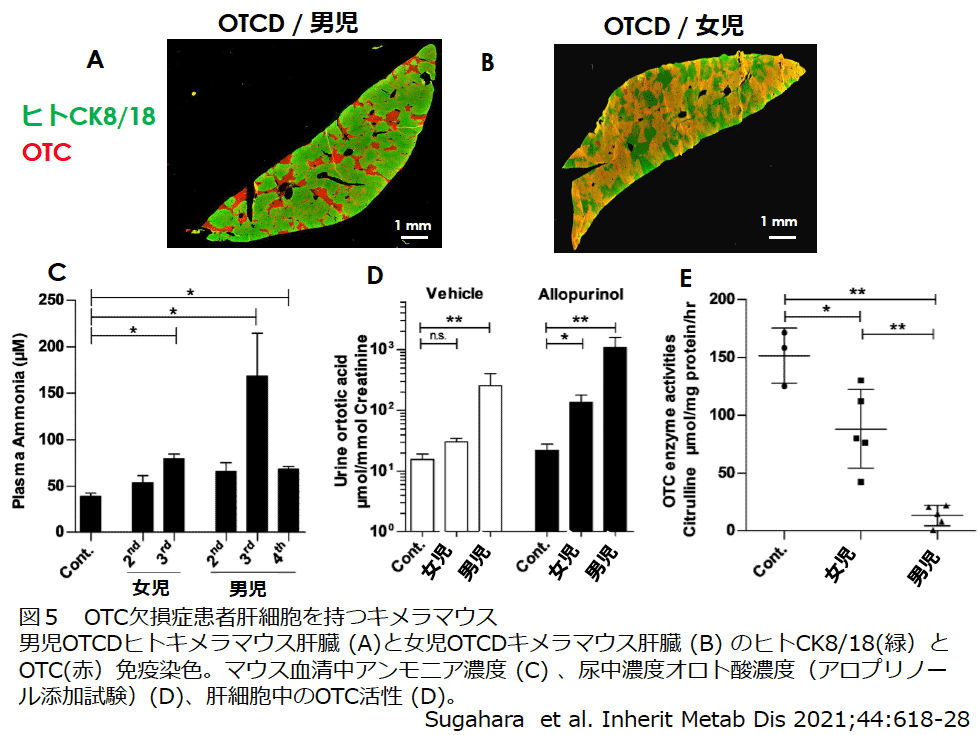
Ornithine transcarbamylase(OTC)欠損症は最も多い尿素代謝異常症で80000人に一人といわれている。根治治療法はなく生体肝移植が多く行われており、患者肝細胞を用いた試験もほとんどない。OTCはX染色体上にあるため、男児はヘミで重篤、女児はヘテロで無症状から重度の症状がみられる。女性では発生初期にライオニゼーションにより、各細胞のX染色体がランダムに不活化するため、マウスの雌のOTC欠損マウスの肝臓におけるOTCの免疫染色ではモザイク状に染まることが示されている15)。
成育医療センターより、男児と女児のOTC欠損患者肝細胞の肝細胞を譲渡いただき、ホストマウスへ移植した。初代の置換率は低かったため、初代マウスよりコラゲナーゼ灌流法により分離した肝細胞を採取した。その後、混入しているマウス肝細胞をマウス肝細胞特異抗体を用いて除去した後、新たなホストマウスへ移植することによりOTCDキメラマウスを作製した16)。その結果、男児、女児OTCDキメラマウスともマウスの血清アンモニア濃度は上昇し、アロプリノール投与後の尿中のオロト酸濃度の上昇も見られ、臨床のデータと近いことが確認された。マウス肝臓免疫染色によると、男児OTCDキメラマウス肝臓ではヒト肝細胞におけるOTCの発現はみられず、女児OTCDキメラマウス肝臓ではOTC欠損雌マウスと同様、OTC陽性領域と陰性領域のモザイク状態が観察された16)(図5)。
OTCDキメラマウスから分離したヒト肝細胞を培養したところ、通常のキメラマウスから分離したヒト肝細胞に比べて、培地中アンモニアが高く、ウレア合成能が低いことが示された。OTCD患者に使われている医薬品の4-phenyl Butylateまたは安息香酸をOTCD肝細胞に添加したところアンモニア濃度の低下が認められたことから、OTCDキメラマウス肝細胞は、新薬の開発にも利用できることが示された。今後、他の疾患モデルマウスも作製したいと考えている。
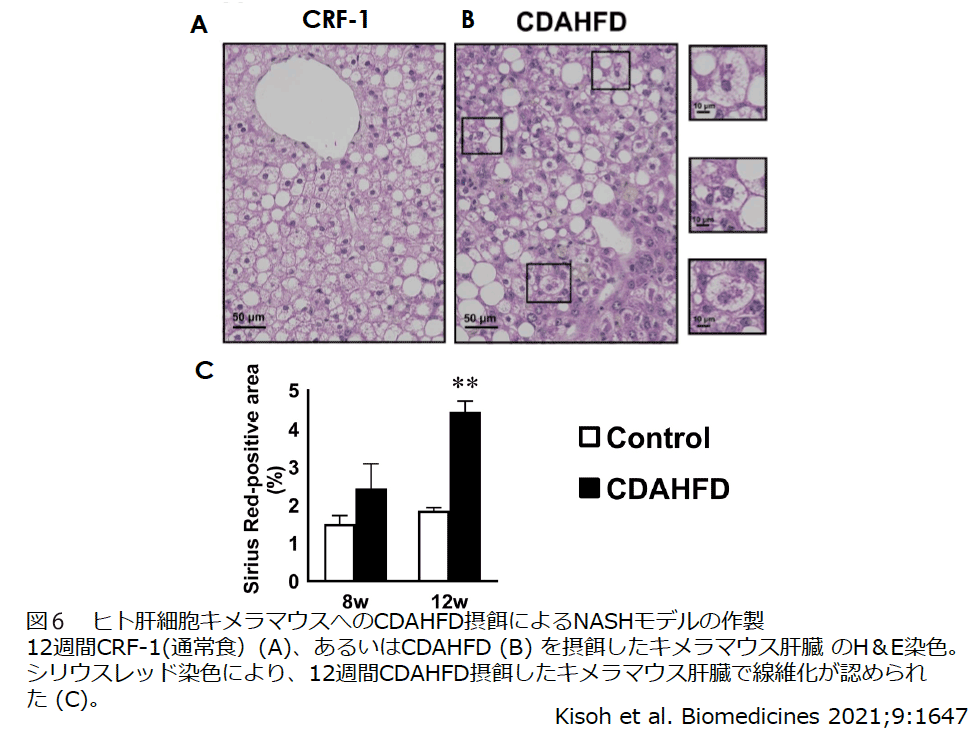
非アルコール性脂肪性肝疾患/肝炎(NAFLD/NASH)は生活習慣病と密接にかかわる疾患であり先進国を中心にその患者数が増加傾向にあり、肝硬変や肝がんの原因となる重大な健康障害の1つである。現在、NASHに対して有用な治療薬は存在せず、多くの製薬会社等でその開発が進められている。私達は、ヒト肝細胞キメラマウスにコリン欠乏メチオニン減量高脂肪食(CDAHFD)を摂餌することによりヒトNASHモデルの作製に成功した。本モデルは、脂肪肝による肝障害から線維化までの一連のNASH病態を発症するのに加え、バルーニングやマロリーデング小体といったヒトNASH患者で見られる所見と同様の形態の肝細胞変性を示していた(図6)。さらに、本モデルにPPAR / agonistのElafibranorを処置したところ、治験と同様の結果が得られたことを報告した17)。
5. さいごに
ヒト肝細胞キメラマウスに関して述べてきたが、将来、肝細胞だけでなく、肝非実質細胞、免疫細胞や腸内細菌などのヒト化の必要性もあると考えている。また、ゲノム編集や遺伝子導入のような手法による疾患モデルマウスの作製をめざした研究を行っている。ヒト肝細胞キメラマウスを作る過程では、キメラマウス体内で正常ヒト肝細胞を何千倍、何万倍に増やすことができる。私達は、キメラマウス肝臓から分離したヒト肝細胞(PXB-cells )も生産している。この細胞は新鮮であるためシャーレへの接着性が極めて高く、コンフルエントな状態で21日以上培養可能であり18)、HBV感染試験19)、薬物代謝試験18)、毒性試験20)、Microphysiological Systems(MPS)21)など多くの製薬企業やアカデミアの先生方に利用されている。また、クリーンな状態で飼育したマウス肝臓から取り出したヒト肝細胞は、ヒトへの移植治療や人工肝臓の材料にも適していると考えられ、大型動物のキメラ化の検討も必要と考えられるが、将来、再生医療に利用できればと期待している。
2007年に私を含め数人の研究者は(株) フェニックスバイオで研究開発に携わることとなった。期せずしてベンチャー企業の研究者となってしまった私達を、肝細胞研究会の先生方はアカデミアと企業の区別なく接してくださったことに深く感謝している。企業での研究は時には問題解決や商品開発に時間がとられることも多々あるが、自分たちが開発したマウスや細胞が新薬や新しい治療法の開発に繋がり、人々の役に立っているという喜びを味わうことができている。この場を借りて、これまで研究にご協力くださいました多くの先生方、(株) フェニックスバイオの研究者に深く感謝いたします。
参考文献
- Tateno C, Yoshizane Y, Saito N, Kataoka M, Utoh R, Yamasaki C, Tachibana A, Soeno Y, Asahina K, Hino H, Asahara T, Yokoi T, Furukawa T, Yoshizato K. Near completely humanized liver in mice shows human-type metabolic responses to drugs. Am J Pathol 2004;165: 901-12.
- Rhim JA, Sandgren EP, Palmiter RD, Brinster RL. Complete reconstitution of mouse liver with xenogeneic hepatocytes. Proc Natl Acad Sci U S A 1995;92: 4942-6.
- Tateno C. Kojima Y. Characterization and applications of chimeric mice with humanized livers for preclinical drug development. Lab Anim Res 2020;36:2.
- Azuma H, Paulk N, Ranade A, Dorrell C, Al-Dhalimy M, Ellis E, Strom S, Kay MA, Finegold M, Grompe M. Robust expansion of human hepatocytes in Fah-/-/Rag2-/-/Il2rg-/- mice. Nat Biotechnol, 2007;25: 903-10.
- Hasegawa M, Kawai K, Mitsui T, Taniguchi K, Monnai M, Wakui M, Ito M, Suematsu M, Peltz G, Nakamura M, Suemizu H. The reconstituted 'humanized liver' in TK-NOG mice is mature and functional. Biochem Biophys Res Commun 2011;405: 405-10.
- Uehara S, Higuchi Y, Yoneda N, Kawai K, Yamamoto M, Kamimura H, Iida Y, Oshimura M, Kazuki Y, Yamazaki H, Hikita H, Takehara T, Suemizu H. An improved TK-NOG mouse as a novel platform for humanized liver that overcomes limitations in both male and female animals. Drug Metab Pharmacokinet 2022;42:100410.
- Heckel JL, Sandgren EP, Degen JL, Palmiter RD, Brinster RL. Neonatal bleeding in transgenic mice expressing urokinase-type plasminogen activator. Cell 1990;62:447-56.
- Tateno C, Kawase Y, Tobita Y, Hamamura S, Ohshita H, Yokomichi H, Sanada H, Kakuni M, Shiota A, Kojima Y, Ishida Y, Shitara H, Wada NA, Tateishi H, Sudoh M, Nagatsuka S, Jishage K, Kohara M. Generation of Novel Chimeric Mice with Humanized Livers by Using Hemizygous cDNA-uPA/SCID Mice. PLoS One 2015;10:e0142145.
- Tateno C, Miya F, Wake K, Kataoka M, Ishida Y, Yamasaki C, Yanagi A, Kakuni M, Wisse E, Verheyen F, Inoue K, Sato K, Kudo A, Arii S, Itamoto T, Asahara T, Tsunoda T, Yoshizato K. Morphological and microarray analyses of human hepatocytes from xenogeneic host livers. Lab Invest 2013;93: 54-71.
- Tateno C, Kataoka M, Utoh R, Tachibana A, Itamoto T, Asahara T, Miya F, Tsunoda T, Yoshizato K. Growth hormone-dependent pathogenesis of human hepatic steatosis in a novel mouse model bearing a human hepatocyte-repopulated liver. Endocrinology 2011;152:1479-91.
- Naugler WE, Tarlow BD2, Fedorov LM3, Taylor M4, Pelz C5, Li B6, Darnell J7, Grompe M8.Fibroblast Growth Factor Signaling Controls Liver Size in Mice With Humanized Livers. Gastroenterology 2015;149: 728-40.
- Ellis EC, Naugler WE, Parini P, Mörk LM, Jorns C, Zemack H, Sandblom AL, Björkhem I, Ericzon BG, Wilson EM, Strom SC, Grompe M. Mice with chimeric livers are an improved model for human lipoprotein metabolism PLoS One 2013;8:e78550.
- Fujino C, Sanoh S, Tamura Y, Ishida Y, Tateno C, Ohta S, Kotake Y. Changes in bile acid concentrations in chimeric mice transplanted with different replacement indexes of human hepatocytes.BPB Reports 2019;2:29-34.
- Ohtsuki S, Kawakami H, Inoue T, Nakamura K, Tateno C, Katsukura Y, Obuchi W, Uchida Y, Kamiie J, Horie T, Terasaki T. Validation of uPA/SCID mouse with humanized liver as a human liver model: protein quantification of transporters, cytochromes P450, and UDP-glucuronosyltransferases by LC-MS/MS. Drug Metab Dispos 2014;42: 1039-43.
- Shiojiri N, Sano M, Inujima S, Nitou M, Kanazawa M, Mori M. Quantitative analysis of cell allocation during liver development, using the spf(ash)-heterozygous female mouse. Am J Pathol 2000;156:65-75.
- Sugahara G, Yamasaki C, Yanagi A, Furukawa S, Ogawa Y, Fukuda A, Enosawa S, Umezawa A, Ishida Y, Tateno C. Humanized liver mouse model with transplanted human hepatocytes from patients with ornithine transcarbamylase deficiencyJ Inherit Metab Dis 2021;44:618-28.
- Kisoh K, Sugahara G, Ogawa Y, Furukawa S, Ishida Y, Okanoue T, Kohara M, Tateno C. Estimating Drug Efficacy with a Diet-Induced NASH Model in Chimeric Mice with Humanized Livers. Biomedicines 2021;9:1647.
- Yamasaki C, Ishida Y, Yanagi A, Yoshizane Y, Kojima Y, Ogawa Y, Kageyama Y, Iwasaki Y, Ishida S, Chayama K, Tateno C. Culture density contributes to hepatic functions of fresh human hepatocytes isolated from chimeric mice with humanized livers: Novel, long-term, functional two-dimensional in vitro tool for developing new drugs PLoS One 2020;15:e0237809.
- Ishida Y, Yamasaki C, Yanagi A, Yoshizane Y, Fujikawa K, Watashi K, Abe H, Wakita T, Hayes CN, Chayama K, Tateno C. Novel robust in vitro hepatitis B virus infection model using fresh human hepatocytes isolated from humanized mice. Am J Pathol 2015;185:1275-85.
- Ishida Y, Yamasaki C, Iwanari H, Yamashita H, Ogawa Y, Yanagi A, Furukawa S, Kojima Y, Chayama K, Kamiie J, Tateno C. Detection of acute toxicity of aflatoxin B1 to human hepatocytes in vitro and in vivo using chimeric mice with humanized livers. PLoS One 2020;15:e0239540.
- Shinha K, Nihei W, Nakamura H, Goto T, Kawanishi T, Ishida N, Yamazaki N, Imakura Y, Mima S, Inamura K, Arakawa H, Nishikawa M, Kato Y, Sakai Y, Kimura H. Kinetic Pump Integrated Microfluidic Plate (KIM-Plate) with High Usability for Cell Culture-Based Multiorgan Microphysiological Systems. Micromachines (Basel) 2021;12:1007.