研究交流
肝疾患治療用細胞シートによる肝硬変治療
板場則子、汐田剛史
鳥取大学医学部 ゲノム再生医学講座 再生医療学分野
要約
末期肝硬変に対し肝移植は優れた治療法となるが、慢性的なドナー不足のため幹細胞を用いた再生医療の確立が期待される。しかし、広範かつ複雑な機能を有する肝臓の再生医療は容易ではなく、むしろ病態を改善する高機能細胞の作製とその効果的な移植法の確立が重要と考えられる。著者らは、間葉系幹細胞の肝細胞系譜への誘導にWnt/β-catenin経路の抑制が重要であるとの知見を基に低分子薬IC-2を創製し、温度応答性培養皿による細胞シート製造技術とのコンビネーションにより肝疾患治療用細胞シートを開発した。本シートの急性肝障害モデルに対する肝再生促進効果については、以前に本ウェブページ上にて紹介した。
本シートの製造に必須の薬剤IC-2は、間葉系幹細胞の肝細胞化を誘導するだけでなく、線維分解酵素となるマトリックスメタロプロテアーゼ(MMP)群の産生亢進に寄与することで、間葉系幹細胞に強力な線維分解作用を賦与する。本シートは肝硬変治療に有用な線維分解作用に特化しており、新規の肝硬変治療法として実用化が期待される。
はじめに
肝疾患は、 肝炎ウイルスなどを原因として、 慢性肝炎、肝硬変、肝細胞癌へと段階を踏んで進行する。肝硬変による死亡者数は毎年約17.000名であるが、肝硬変を背景として発生する肝細胞癌の死亡者数が約30,000名となることから、肝硬変治療がいかに重要であるかが認識される。慢性肝疾患進展には基盤病態として肝線維化があり、予後改善には線維化の治療が重要となる。
近年、C型肝炎ウイルス(HCV)に対するdirect acting agents (DAAs)の導入により、高率にHCV駆除が可能となった。C型肝硬変における肝線維化改善率は1/3〜1/2と報告されているが、進行した肝硬変ほど改善効果が低く、肝線維化治療が必要となる。したがって、C型肝硬変をはじめ、あらゆる病因による肝硬変はいまだ有効な治療法のないunmet medical needの対象となり、その治療法開発が喫緊の課題となる。
肝硬変治療に重要となる線維分解作用
肝硬変で蓄積する線維成分はI型コラーゲンが6〜7割を占め、次いで2〜3割をIII型コラーゲンが占めることから(1)、肝線維化の解消には特にI型コラーゲンの分解が重要と考えられる。I型コラーゲンの分解には、古くよりコラゲナーゼとして知られるマトリックスメタロプロテアーゼ(MMP)-1, -8, 13の他、MMP-2, -9, -12, -14、カテプシンKが作用することが知られている(2)。MMPの活性は阻害因子となるTIMP(tissue inhibitor of matrix metalloproteinase)により阻害されることから、蓄積した線維の分解にはI型コラーゲンを基質とするMMPsの亢進、もしくはTIMPの抑制が必要となる。興味深いことに、我々が見出した低分子薬IC-2(3)は、間葉系幹細胞に対し、MMP-1, -2, -14のmRNA発現亢進作用を示す。タンパクレベルにおいては、MMP-1, -14の発現亢進を認め、同様に酵素活性の上昇が認められる。上清中へは、MMP-1, MMP-14の他、MMP-14により活性化を受けるMMP-2, MMP-13の産生亢進が認められる。IC-2単剤の添加により間葉系幹細胞は、I型コラーゲンの分解活性を示すMMP群を産生する、すなわちIC-2は間葉系幹細胞に肝硬変治療に有用な線維分解活性を賦与する(4, 5)。間葉系幹細胞は、MELDスコアの改善など肝硬変治療に有用であることが様々な臨床試験によりすでに明らかとなっているが(6)、IC-2の添加は間葉系幹細胞をそのまま治療に使用するよりも高い線維化抑制効果を示すと期待された。
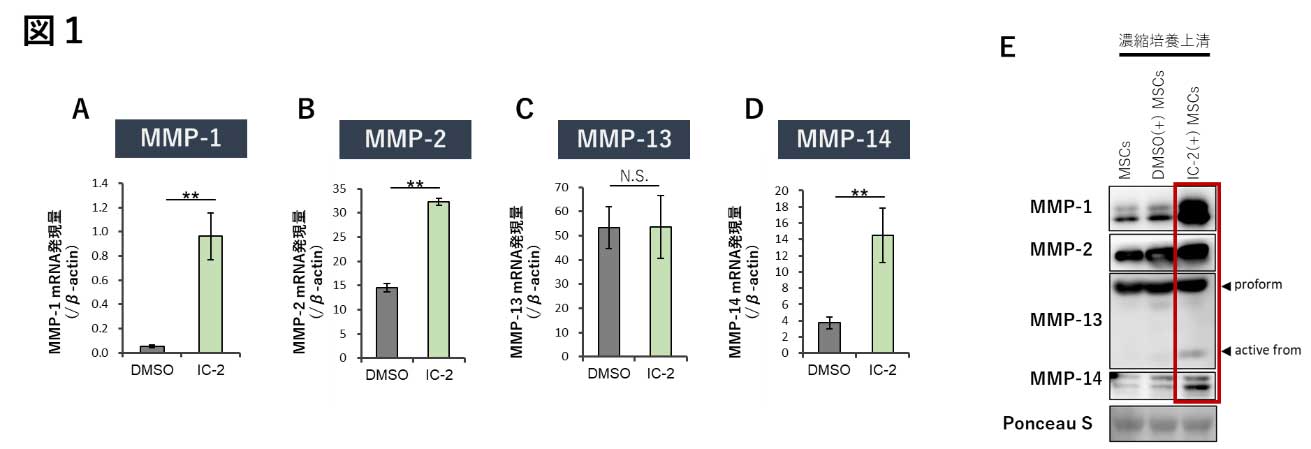
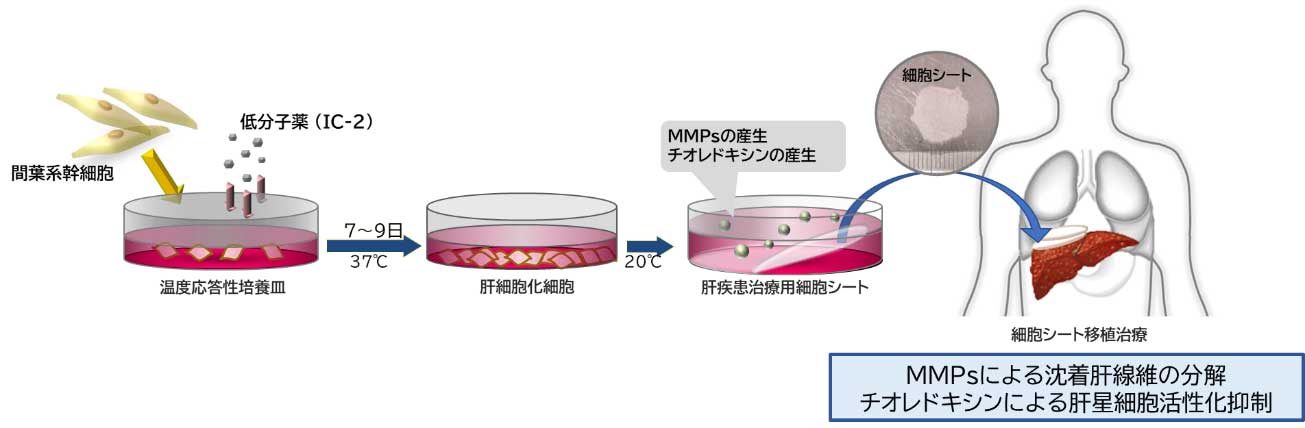
図1. IC-2による間葉系幹細胞でのマトリックスメタロプロテアーゼ(MMPs)の発現亢進
(A-D)IC-2添加1週間後の間葉系幹細胞でのMMP-1, MMP-2, MMP-13, MMP-14のmRNA発現量。(E) IC-2添加1週間後の間葉系幹細胞の培養上清中でのMMP-1, MMP-2, MMP-13, MMP-14のタンパク発現。(文献4を改編し引用)
肝硬変治療における細胞シート移植の重要性
IC-2により、間葉系幹細胞に線維分解活性を賦与することが可能だが、移植に際しては、得られた細胞の機能を最大限発揮する効果的な移植法が重要となる。特にMMPは活性化部位に金属イオン結合部位を有することから、移植前に細胞分散を目的としてキレート剤を含むトリプシン処理を行うと線維分解活性が損なわれると考えられる。そこで我々は、線維分解活性が重要となる肝硬変治療においてこそ、細胞の分散が不要となる温度応答性培養皿による細胞シート作製技術およびその移植が、線維分解作用の機能発現に有用であると考えた。
温度応答性培養皿は、温度応答性高分子のポリN-イソプロピルアクリルアミドを培養皿に固定化した培養皿で、37℃付近では疎水性を示し細胞の接着や増殖を可能とし、32℃以下では親水性を示し細胞の接着を阻害する。20℃に低下させると、細胞は足場を失い、一枚のシート状の組織として回収される。細胞間接着や細胞外基質は回収後も維持されており、この細胞外基質が「のり」として作用し、目的部位へ移植され、侵襲性の低い移植が可能となる(7)。温度変化のみで細胞を組織上に回収可能なことから、MMPによる線維分解作用を失うことなく、機能を維持したまま細胞の回収が可能となる。事実、トリプシン処理により細胞を回収した場合にはMMP活性が顕著に低下するが、細胞シートによる回収ではその活性が維持されていることがわかる(図2)。
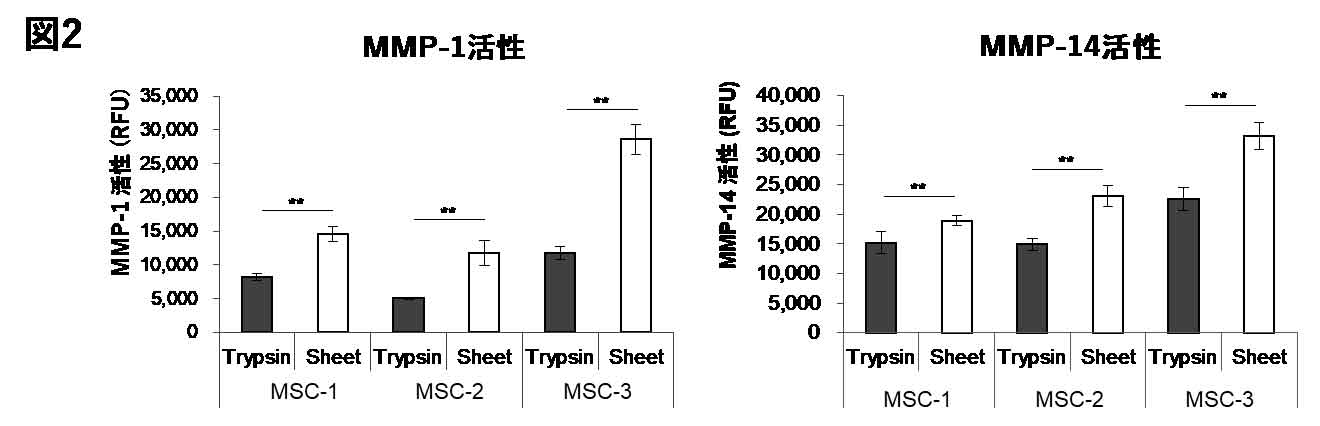
図2. 細胞の回収方法によるMMP活性への影響の比較
温度応答性培養皿上で間葉系幹細胞にIC-2を添加し1週間後、トリプシン処理による分散回収、もしくは温度低下によるシート回収を行った細胞でのMMP-1, MMP-14活性の比較。(文献4を改編し引用)
肝疾患治療用細胞シートによる肝線維化抑制効果
in vitroにおいて十分な線維化抑制効果が期待されることから、本シートの効果を肝硬変モデルマウスで検討した。四塩化炭素を週2回、10週間投与し肝線維化を誘導後、シート貼付をしない偽移植群、IC-2非存在下で作製した間葉系幹細胞シート移植群(MSCシート群)、IC-2存在下で作製したIC-2シート移植群(IC-2シート群)の3群に、四塩化炭素非投与の正常群を検討に加えた。アザン染色、シリウスレッド染色による組織学的解析では、偽移植群と比較しIC-2シート群で約40%の線維陽性面積率の減少を認めた。コラーゲン量を反映する肝ヒドロキシプロリン量は、IC-2シート群では偽移植群と比較し、約47%もの蓄積量の低下を認めた(図3)。また、本シートによる肝線維化抑制効果は、移植した肝葉に留まらず、別の肝葉でも同様に認められ、本シートより分泌される線維化抑制因子が、パラクライン、エンドクラインに作用することを支持すると考えられた。
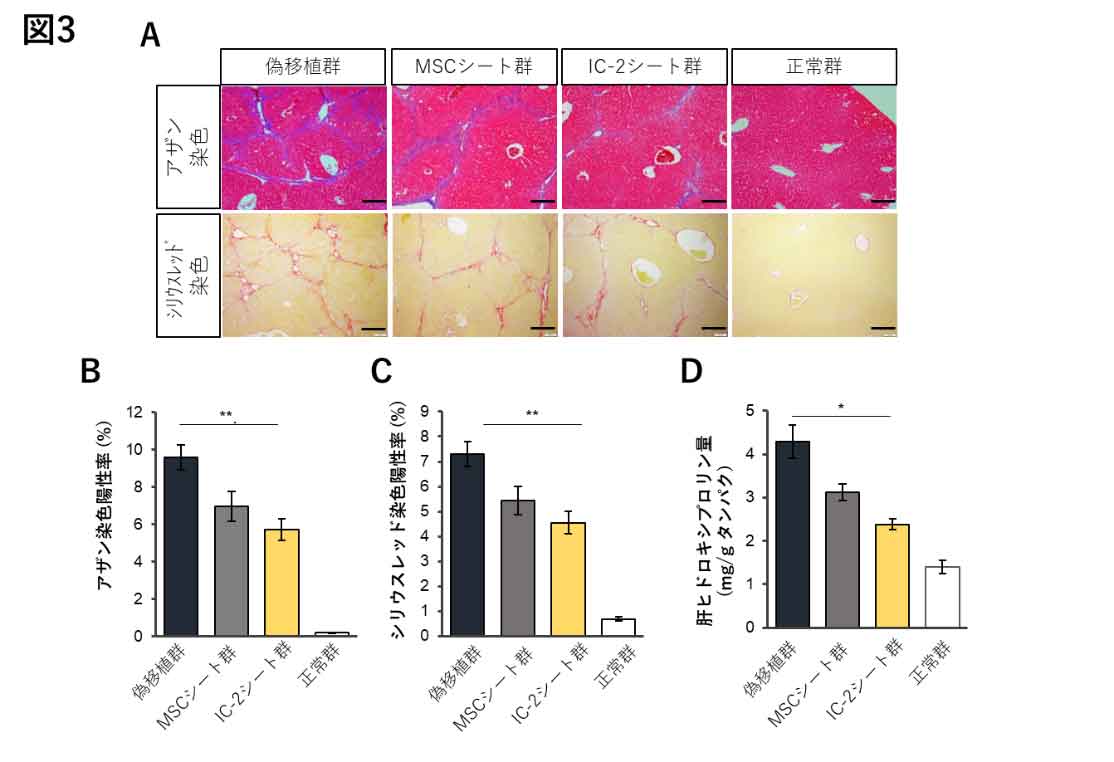
図3. 四塩化炭素誘発性肝硬変モデルマウスでのIC-2シートの肝線維化抑制効果
(A)アザン染色、シリウスレッド染色による組織学的評価。アザン染色では青で膠原繊維、シリウスレッド染色では赤でI型、III型コラーゲンが識別される。(B, C)アザン染色およびシリウスレッド染色の陽性面積率の定量評価結果。(D)コラーゲン量を反映する肝ヒドロキシプロリン量の測定結果を示す。(文献4を改編し引用)
肝硬変抑止に重要となる肝星細胞活性化抑制作用
肝硬変モデルでの線維の減少には、線維分解機序の他に、線維合成の抑制機序が関与する可能性がある。線維合成の抑制には、肝星細胞の活性化抑制を介すると考えられるが、上述の肝硬変モデルでの検討では、顕著な肝星細胞の活性化抑制が認められた。本シートの急性肝障害抑制効果に、チオレドキシンによる酸化ストレス抑制効果が重要であることを見出していたが(8, 9)、IC-2により産生が亢進するチオレドキシンは、肝硬変モデルにおいては肝コラーゲン合成の主要細胞である肝星細胞の活性化抑制に作用することで、線維増生の抑制に寄与すると推察された(図4)。
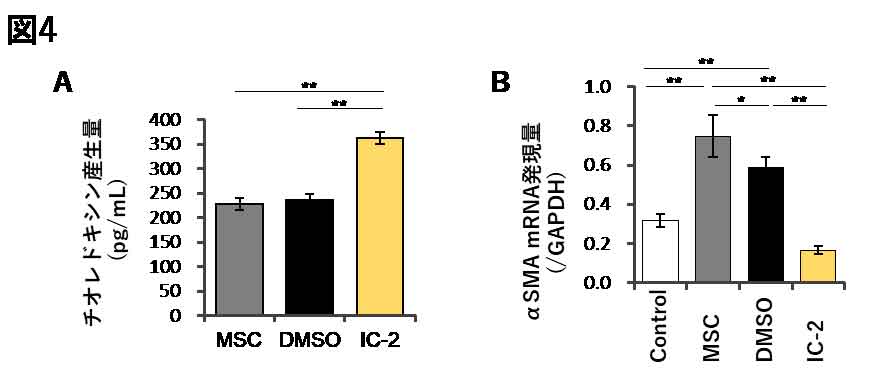
図4. IC-2による間葉系幹細胞でのチオレドキシンの産生亢進
(A)IC-2添加1週間後の間葉系幹細胞の培養上清中でのチオレドキシン産生量。(B)TGF-β処理により活性化を誘導した肝星細胞株LX-2に、IC-2添加1週間後の間葉系幹細胞の濃縮培養上清を添加した際のαSMA発現量。(文献4を改編し引用)
おわりに
著者らは、独自に創出した低分子薬IC-2による間葉系幹細胞の肝細胞化誘導技術と細胞シート工学技術を融合した肝疾患治療用細胞シートを開発した。本シートは、線維化抑制に有効な複数の液性因子を分泌することで、強力な肝線維化抑制作用を発揮する。非代償性肝硬変の新規治療法として、その実用化を進めている。
文献
- Schuppan D. Structure of the extracellular matrix in normal and fibrotic liver: collagens and glycoproteins. Semin Liver Dis 10: 1-10, 1990.
- Amar S, Smit L, et al. Matrix metalloproteinase collagenolysis in health and disease. Biochim Biophys Acta 1864: 1940-1951, 2017.
- Itaba N, Sakabe T, et al. Identification of the small molecule compound which induces hepatic differentiation of human mesenchymal stem cells. Regen Ther 2: 32-41, 2015.
- Itaba N, Kono Y, et al. Reversal of established liver fibrosis by IC-2-engineered mesenchymal stem cell sheets. Sci Rep 9: 6841, 2019.
- Fukushima K, Itaba N, et al. Secreted matrix metalloproteinase-14 is a predictor for antifibrotic effect of IC-2-engineered mesenchymal stem cell sheets on liver fibrosis in mice. Regen Ther 26: 292-301, 2021.
- Shiota G, Itaba N. Progress in stem cell-based therapy for liver disease. Hepatol Res 47: 127-141, 2017.
- Yang J, Yamato M, et al. Cell delivery in regenerative medicine: the cell sheet engineering approach. J Control Release 116: 193-203, 2006.
- Itaba N, Matsumi Y, et al. Human mesenchymal stem cell-engineered hepatic cell sheets accelerate liver regeneration in mice. Sci Rep 5: 16169, 2015.
- Itaba N, Noda I, et al. Hepatic cell sheets engineered from human mesenchymal stem cells with a single small molecule compound IC-2 ameliorate acute liver injury in mice. Regen Ther 24: 45-57, 2018.