研究交流
肝発生や創傷治癒における中皮細胞の系譜と機能
朝比奈欣治
滋賀医科大学・実験実習支援センター
はじめに
光学顕微鏡下で肝臓の切片を見てみると、肝臓表面は中皮(mesothelium)により覆われていることに気がつく。この中皮を構成している中皮細胞(mesothelial cell)は扁平な上皮細胞であり、一層の上皮シートを形成して肝臓表面を覆っている。中皮は肝臓以外にも、腹腔内の小腸や腸間膜、胸腔内の心臓や肺の表面に見られる。また、これら臓器の表面が接する体壁側も中皮に覆われている。中皮細胞はその存在場所から、体腔内に潤滑液を分泌し、臓器表面が擦れ合う際の損傷を防いでいると考えられてきた(1)。近年の研究により、中皮細胞は臓器表面のバリアとして機能するだけでなく、間葉系細胞の前駆細胞として臓器発生や、臓器表面の創傷治癒に関わることが明らかになりつつある。
中皮細胞の形質
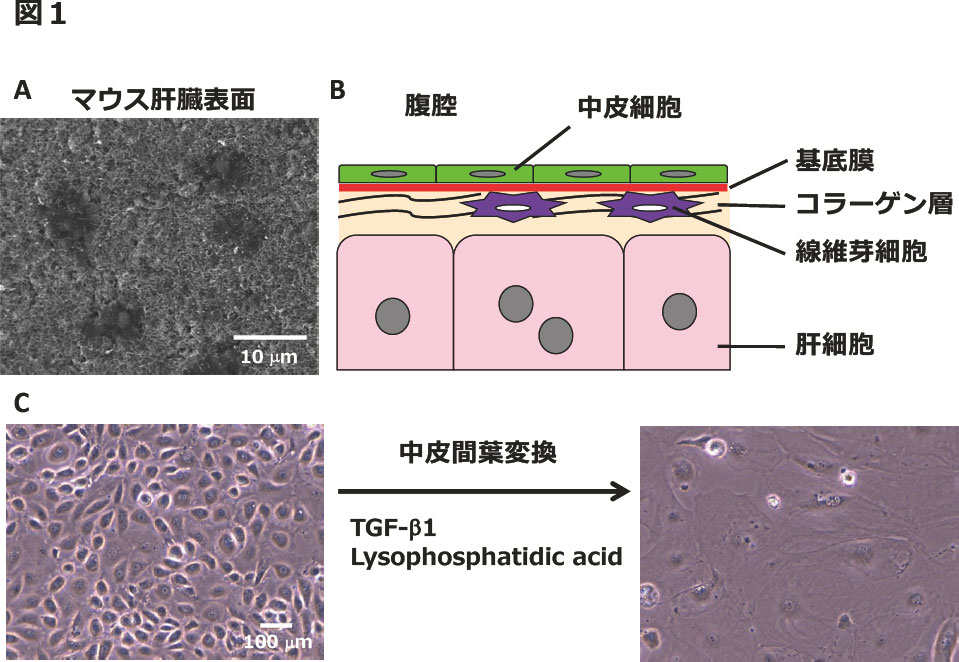
肝臓の中皮細胞は扁平上皮細胞の形態を持ち、腹腔面に多数の微絨毛を持つ(図1A)。核は中皮細胞の中心に位置しており、その直上の細胞表面には微絨毛が発達せず、走査顕微鏡下で黒い領域として観察される。成体マウス肝臓の中皮細胞は、上皮細胞のマーカーであるサイトケラチン19やZO1を発現しているが、E-カドヘリンは発現しない(2)。また、中皮細胞は間葉系細胞のマーカーであるビメンチンを発現する。中皮細胞下にはラミニンやIV型コラーゲンから成る基底膜が形成される(図1B)。中皮の基底膜下には、線維芽細胞とI型コラーゲン層が存在し、肝臓表面でグリソン鞘を形成している(3)。
中皮間葉変換
肝臓の中皮細胞は、GPM6A、MSLN、PDPN、UPK1B、WT1など特徴的なマーカーを発現しており、GPM6Aに対する抗体を用い、肝臓から単離し培養することができる(2)。培養した中皮細胞は、TGF-β やLysophosphatidic acidにより上皮の形質を失い、筋線維芽細胞へと分化する(図1C)(4,5)。このような変化は、上皮間葉変換(epithelial-mesenchymal transition)と類似しているが、中皮細胞ではSnailやTwistの発現に変化がないこと、中皮細胞は中胚葉由来でE-カドヘリンを発現しないことから、中皮間葉変換(mesothelial-mesenchymal transition)と区別されることが多い。
図1 肝臓表面の中皮と中皮細胞
(A)マウス肝臓表面の走査電子顕微鏡観察。中皮細胞の表面に多くの絨毛が観察される。中皮細胞の中央には、絨毛が少ない黒い領域が観察される。(B)肝臓表面の構造。中皮は一層の中皮細胞により構成される。中皮下に基底膜とコラーゲン層がある。コラーゲン層には線維芽細胞が存在する。(C)マウス肝臓から単離した中皮細胞の培養。TGF-β1やlysophosphatidic acidにより中皮間葉変換が誘導され、筋線維芽細胞に分化する。
中皮細胞の由来
中皮細胞は上皮細胞であるが、中胚葉に由来する。動物の胚発生において、体腔は側板中胚葉の内部に形成され、内胚葉側の中胚葉が臓側中胚葉、外胚葉側の中胚葉が壁側中胚葉となる(6)。体腔面の中胚葉細胞は次第に上皮化し、中皮細胞へと分化する(7)。マウスの肝臓では、中皮細胞はMesp1陽性の中胚葉集団に由来することが知られている(8)。転写因子Mesp1は、マウス原腸形成時に一部の中胚葉に発現する。Mesp1-Creマウスを用いた細胞系譜解析では、Mesp1陽性の中胚葉は、内胚葉に由来する肝臓原基表面の中皮細胞(臓側中胚葉)に分化するが、体壁表面の中皮細胞(壁側中胚葉)には分化せず、臓器側と体壁側では中皮細胞の発生由来が異なることが示唆されている。
肝発生における中皮細胞の役割
E8.5日のマウス胎仔では、前腸内胚葉の細胞が周囲の横中隔間充織に侵入し、やがて肝芽が形成される。この横中隔間充織はWT1を発現しており、肝臓原基が形成されると、肝臓表面を覆う中皮細胞と、肝臓内部の肝星細胞へと分化する(9)。胎仔肝臓表面の中皮細胞はWT1を発現しており、肝臓の発生が進むと内部に侵入し、肝星細胞や門脈周囲の線維芽細胞へと分化することから、中皮細胞は間葉系細胞の前駆細胞として機能することが知られている。マウス胎仔肝臓表面の中皮細胞を標識後、成体肝臓を解析した論文では、中皮細胞に由来する肝星細胞と、由来しないものでは性質が異なることが示唆されている(10)。また、肝臓以外の心臓や小腸の発生においても、中皮細胞から臓器内部の間葉系細胞への分化が報告されている(11)。
肝臓の線維化と中皮細胞の変化
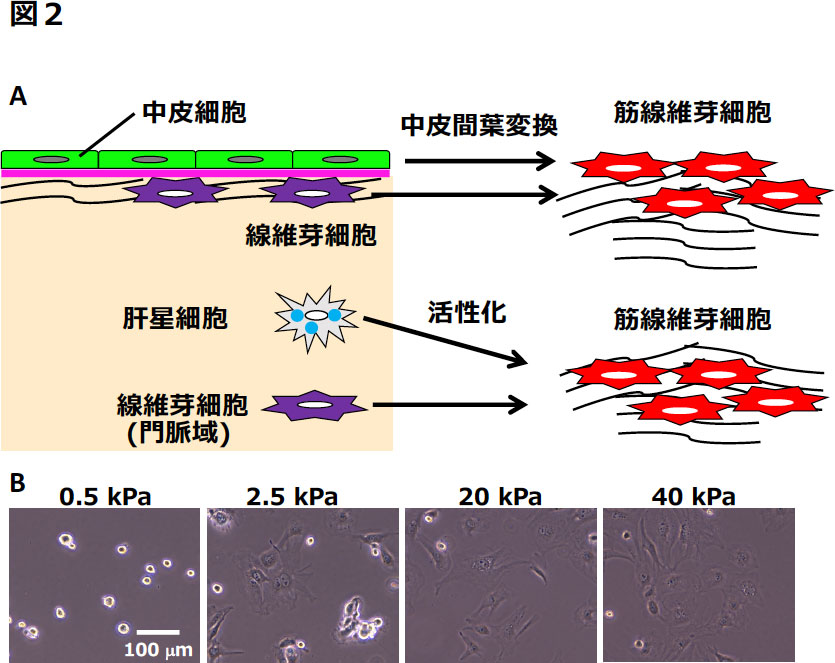
肝硬変では肝臓表面が凹凸となり、厚いコラーゲン線維の蓄積が顕著になる(3)。マウスに四塩化炭素を繰り返し投与すると、肝臓表面下にコラーゲン線維の蓄積と筋線維芽細胞が見られるようになる。このモデルでは、肝臓表面の中皮細胞が上皮の形質を失い、肝臓内部に侵入し筋線維芽細胞に分化することが報告されている(図2A)。中皮細胞から筋線維芽細胞への分化には、少なくともTGF-β が関わっており、TGF-β type II受容体を中皮細胞で欠損させると、筋線維芽細胞への分化が抑制される(4)。また、マウス腹腔内にクロルヘキシジングルコン酸塩を複数回投与し、肝臓表面に線維化を引き起こすと、やはり中皮細胞は筋線維芽細胞に分化する(3)。肝臓表面が線維化すると、中皮細胞下にI型コラーゲンなどの細胞外マトリックスが蓄積する。この線維化した環境を培養下で再現するため、硬さを変化させたハイドロゲル上で肝臓中皮細胞を培養したところ、ゲルの硬さに比例して核内のTAZ/WWTR1の発現が増加し、筋線維芽細胞へと変化した(図2B)(5)。TAZ/WWTR1の発現を抑制すると、中皮細胞から筋線維芽細胞への変化は抑えられた。これらの結果は、肝臓表面の線維化が進行すると、中皮細胞は上皮の形質を維持できなくなることを示唆している。
図2 肝臓表面の線維化における中皮細胞から筋線維芽細胞への分化
(A)マウス肝臓表面における線維化の模式図。肝臓表面が傷害を受けると、中皮細胞は中皮間葉変換を起こし筋線維芽細胞へ分化し、肝臓表面での線維化を促進する。中皮下に存在する線維芽細胞も筋線維芽細胞に分化する可能性が高い。肝臓内部では、肝星細胞と門脈周囲の線維芽細胞が筋線維芽細胞に分化する。(B)中皮細胞のハイドロゲル上の形態変化。硬さ0.5 - 40 kPaのハイドロゲル上で中皮細胞を培養すると、20 kPa以上ではその形態が筋線維芽細胞様に変化する。
肝臓表面と門脈域のグリソン鞘
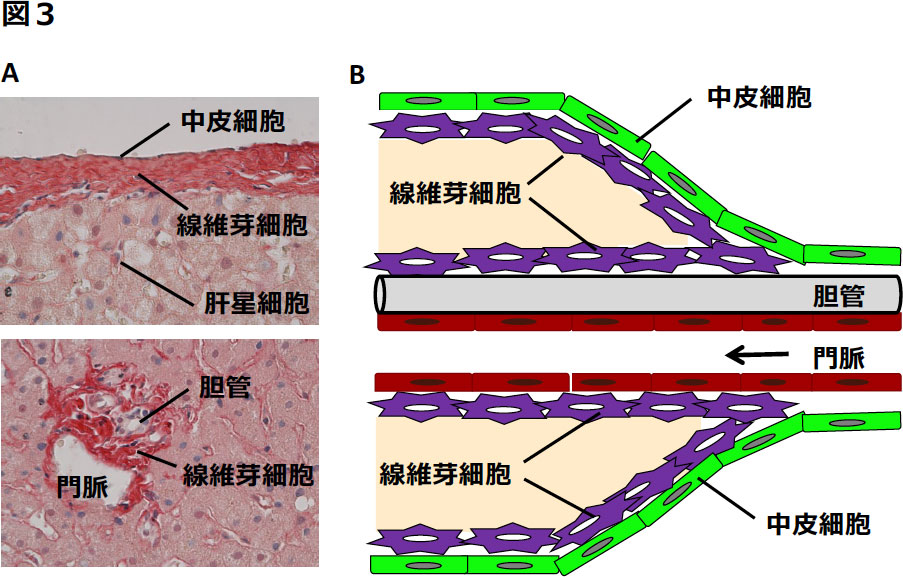
ヒトの肝臓において、肝臓中皮下の結合組織と、胆管、門脈、肝動脈周囲を覆う結合組織は、グリソン鞘と呼ばれる(図3A)。肝臓の門脈流入部位を考えてみると、肝臓表面では中皮細胞下の線維芽細胞がグリソン鞘を形成しており、門脈域では胆管上皮細胞周囲の線維芽細胞がグリソン鞘を形成し、その連続性が理解できる(図3B)。一方、ヒトの肝臓と異なり、マウス肝臓の中皮下の結合組織は乏しく、線維芽細胞もわずかにしか存在しない。マウス肝臓中皮下から、この線維芽細胞を単離すると、肝星細胞と異なりビタミンA脂質を貯蔵せず、培養下で筋線維芽細胞へと分化することから、中皮下の線維芽細胞も線維化に関わることが考えられる(図2A)(3)。また、グリソン鞘という観点から門脈周囲の線維芽細胞と比較すると、中皮下の線維芽細胞は、形態や性質が非常に類似している(3,12)。
図3 肝臓グリソン鞘の構造
(A)ヒト成体肝臓のシリウスレッド染色。上が肝臓表面、下が門脈周囲の写真。ヒト肝臓の中皮下には、線維芽細胞とコラーゲン層から成るグリソン鞘が形成される。肝臓内部の門脈と胆管は、線維芽細胞から成るグリソン鞘に包まれている。(B)肝臓表面と内部のグリソン鞘の連続性。門脈が肝臓に流入する領域では、肝臓表面を中皮細胞(上皮細胞)下に線維芽細胞が存在しグリソン鞘が形成される。門脈域では胆管上皮細胞周囲の線維芽細胞がグリソン鞘を形成する。
臓器癒着における中皮細胞の役割
外科手術後の臓器癒着は大きな問題である。中皮細胞は傷害を受けると、様々な因子を分泌し、好中球や単球を動員し、臓器間癒着を促進する(13)。例えば、マウス臓器表面の中皮が傷害を受けると、EGFにより筋線維芽細胞に分化し、臓器間の癒着が進行する(14)。また、臓器の切除部位は中皮がないため、臓器間の癒着が進行すると考えられている。マウスの肝切除後、胎仔肝臓より作成した中皮細胞シートを用いると、切除面の癒着を防ぐことができる(15)。
おわりに
線維化した肝臓全体で筋線維芽細胞の由来を考えると、類洞のディッセ腔に存在する肝星細胞が主な細胞である。一方、門脈周囲の線維化では線維芽細胞が、肝臓表面での線維化では中皮細胞とその直下の線維芽細胞が筋線維芽細胞に分化し、線維化に関わる。由来の異なる筋線維芽細胞が、線維化においてどのように異なる働きをしているか興味深いところであるが、肝臓の線維芽細胞を解析するツールが限られており、今後の研究課題である。また、中皮細胞は傷害により大きくその性質が変化するため、臓器間癒着を防ぐ医療方法の開発には、中皮細胞の上皮形質の維持機構を明らかにする必要がある。
参考文献
- Mutsaers SE. Mesothelial cells: their structure, function and role in serosal repair. Respirology 2002;7:171-191.
- Li Y, Wang J, Asahina K. Mesothelial cells give rise to hepatic stellate cells and myofibroblasts via mesothelial-mesenchymal transition in liver injury. Proc Natl Acad Sci U S A 2013;110:2324-2329.
- Balog S, Li Y, Ogawa T, Miki T, Saito T, French SW, Asahina K. Development of capsular fibrosis beneath the liver surface in humans and Mice. Hepatology 2020;71:291-305.
- Li Y, Lua I, French SW, Asahina K. Role of TGF-β signaling in differentiation of mesothelial cells to vitamin A-poor hepatic stellate cells in liver fibrosis. Am J Physiol Gastrointest Liver Physiol 2016;310:G262-272.
- Lua I, Balog S, Asahina K. TAZ/WWTR1 mediates liver mesothelial-mesenchymal transition induced by stiff extracellular environment, TGF-β1, and lysophosphatidic acid. J Cell Physiol 2022;237:2561-2573.
- Prummel KD, Nieuwenhuize S, Mosimann C. The lateral plate mesoderm. Development 2020;147:dev175059.
- Thomason RT, Bader DM, Winters NI. Comprehensive timeline of mesodermal development in the quail small intestine. Dev Dyn 2012;241:1678-1694.
- Lua I, Li Y, Pappoe LS, Asahina K. Myofibroblastic conversion and regeneration of mesothelial cells in peritoneal and liver fibrosis. Am J Pathol 2015;185:3258-3273.
- Asahina K, Zhou B, Pu WT, Tsukamoto H. Septum transversum-derived mesothelium gives rise to hepatic stellate cells and perivascular mesenchymal cells in developing mouse liver. Hepatology 2011;53:983-995.
- Kendall TJ, Duff CM, Boulter L, Wilson DH, Freyer E, Aitken S, Forbes SJ, Iredale JP, Hastie ND. Embryonic mesothelial-derived hepatic lineage of quiescent and heterogenous scar-orchestrating cells defined but suppressed by WT1. Nat Commun 2019;10:4688.
- Carmona R, Ariza L, Cano E, Jiménez-Navarro M, Muñoz-Chápuli R. Mesothelial-mesenchymal transitions in embryogenesis. Semin Cell Dev Biol 2019;92:37-44.
- Lua I, Li Y, Zagory JA, Wang KS, French SW, Sévigny J, Asahina K. Characterization of hepatic stellate cells, portal fibroblasts, and mesothelial cells in normal and fibrotic livers. J Hepatol 2016;64:1137-1146.
- Tsai JM, Shoham M, Fernhoff NB, George BM, Marjon KD, McCracken MN, Kao KS, Sinha R, Volkmer AK, Miyanishi M, Seita J, Rinkevich Y, Weissman IL. Neutrophil and monocyte kinetics play critical roles in mouse peritoneal adhesion formation. Blood Adv 2019;3:2713-2721.
- Zindel J, Mittner J, Bayer J, April-Monn SL, Kohler A, Nusse Y, Dosch M, Büchi I, Sanchez-Taltavull D, Dawson H, Gomez de Agüero M, Asahina K, Kubes P, Macpherson AJ, Stroka D, Candinas D. Intraperitoneal microbial contamination drives post-surgical peritoneal adhesions by mesothelial EGFR-signaling. Nat Commun 2021;12:7316.
- Inagaki NF, Inagaki FF, Kokudo N, Miyajima A. Use of mouse liver mesothelial cells to prevent postoperative adhesion and promote liver regeneration after hepatectomy. J Hepatol 2015;62:1141-1147.