研究交流
細胞移植による内在性肝前駆細胞活性化療法の可能性
市戸義久、三高俊広
札幌医科大学医学部附属フロンティア医学研究所 組織再生学部門
1.はじめに
現在、致死的肝疾患患者に対して肝臓移植が行われているが、脳死臓器移植ではドナー不足、生体肝移植ではドナーへの侵襲性等の様々な問題がある。そこで代替医療として細胞移植による再生医療に期待が寄せられている。これまでの細胞移植療法は、ドナー細胞が患者の肝臓に生着・増殖し、臓器全体をドナー細胞で置換することを主な目的としてきたが、移植された細胞の生着率は低く、生着した細胞により置換されるまでに時間がかかることも問題である。一方、iPS細胞など多能性幹細胞からの肝細胞創成に注目が集まり研究が急速に進んでいる。しかしながら、今なお高度な肝機能を有する“肝細胞“を誘導することは困難である。
我々の研究室では、肝前駆細胞の1つである小型肝細胞 (Small hepatocyte; SHs) について研究を行ってきた。肝細胞機能を保持しながらin vitroでも旺盛な増殖能を有することから細胞移植のドナー細胞候補として非常にポテンシャルが高いと考え、SHsを用いた細胞移植治療の有効性について検討してきた。本報告では、ドナー細胞として、高い肝機能を有する成熟肝細胞 (Mature hepatocytes; MHs)、肝細胞への分化方向が決まった肝前駆細胞、肝細胞と胆管上皮細胞への二分化能を有する肝幹細胞、また現在臨床応用されている骨髄間葉系細胞など、分化度の異なる細胞を移植した場合の肝組織修復機序について、これまでの研究成果をまとめてみたい。
2.移植細胞による置換効率
細胞移植治療の細胞源として、増殖能の高い肝幹・前駆細胞と肝機能が高いMHsのどちらが細胞移植治療のドナー細胞として適しているか検討した。D-Galactosamine (GalN)投与による薬剤性急性肝炎ラット肝臓では、GalN投与後2日目に門脈周囲領域にThy1陽性間葉系細胞が出現し、3日目にはThy1/CD44両陽性の細胞が、4日目にはCD44単独陽性の小型肝細胞が出現することが分かっている(1, 2)。一方、Thy1陽性間葉系細胞は4日目には小葉内から消失する。GalN投与後3日目から分離したThy1陽性細胞を培養するとThy1/CD44両陽性の小型肝細胞コロニーが出現する。しかしながら、2日目から分離した細胞からのコロニー出現頻度は低かった。この結果は、GalN投与後に小葉内に出現するThy1陽性間葉系細胞画分に肝幹細胞が含まれていることを示している。GalN投与後3日目から単離した肝幹細胞の分画を含むThy1陽性細胞 (Thy1)と、4日目から単離した肝前駆細胞の分画を含むCD44陽性細胞 (CD44)、そして正常肝由来MHsをRetrorsine(Ret)/ Partial Hepatectomy(PH)処置ラット肝臓に脾臓経由で移植し、生着率を検討した(3)。肝前駆細胞であるCD44が最も生着率が高いことを期待して実験を行った。結果はMHsの生着率が最も高く、置換した細胞の多くは1年以上生存していた一方、Thy1やCD44では生着率が低く、生着した細胞もThy1陽性細胞は2ヶ月以内に細胞老化に陥り消失し、また置換したCD44陽性細胞の多くも細胞老化し、3ヶ月以上生存する細胞は少なかった(図1)。
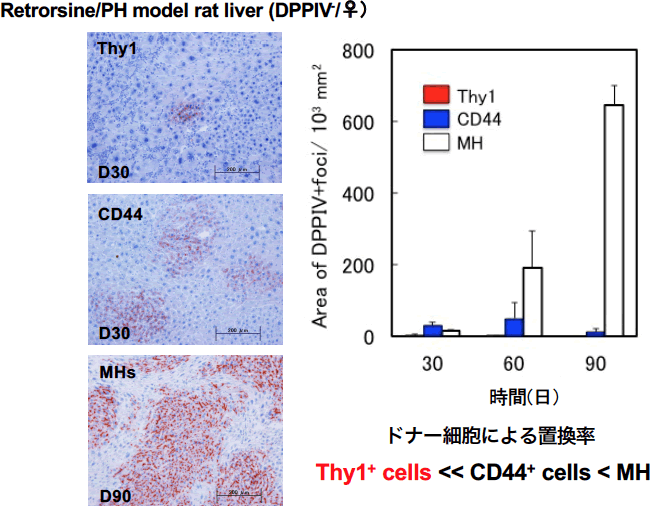
図1 ドナー細胞の選定。ガラクトサミン(GalN)投与後3日目のラット肝臓から肝幹細胞(Thy1)を、4日目から肝前駆細胞(CD44)を分離し、Retrorsine (Ret)/Partial hepatectomy (PH) 処置ラット肝臓に脾臓経由で移植した。成熟肝細胞(MH)をコントロールとした。
この結果は、ドナー細胞による置換を目的とした場合、最も優れているのはMHsであることを示している。しかしながら、MHsは、ドナー不足という問題ばかりではなく、一旦生体外に取り出すと増殖能・分化能が急速に落ちてしまうことから、新鮮な肝細胞をどのように確保するかが問題となる。またMHsは決して均一な細胞ではなく、一部の細胞は微小環境の変化によって胆管上皮細胞へ分化転換を起こすことが分かっている(4)。我々も移植したMHsが胆管に組み込まれることがあることを確認している(5)。治療の観点から考えると一番の問題は置換されるまでに時間がかかるということである。
この細胞移植実験の過程で興味深いことに気が付いた。Thy1細胞を移植した肝臓が肥大し、肝再生が促進していたのである(図2)。
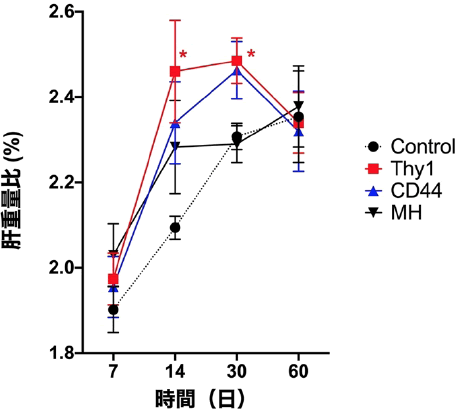
図2 レシピエントラットの肝重量比 * p<0.05
移植したThy1陽性細胞は、ほとんどがマクロファージにより貪食され、生着する細胞はごく少数であった(3)。それにも拘わらず、Thy1細胞移植30日後でも肝臓は有意に肥大していた。一方、置換された細胞が増えているMHにおいて肝肥大を認めないことから、その機序を検討することにした。
3.小型肝細胞様肝前駆細胞(Small hepatocyte-like progenitor cells: SHPCs)
Ret/PHモデルラット肝臓においては、Retは細胞分裂を抑制することから、2度投与するとほとんどの肝細胞は増殖できない。そのためRet投与ラットに肝切除などの増殖刺激を与えるとRetの影響を受けていない肝細胞を選択的に増殖させることができる(6)。生着したドナー細胞が増殖し宿主肝細胞を置換できることから、ドナー細胞による置換を目的とした細胞移植実験によく使われているモデルである。Gordon GJらのグループは、このRet/PH処置ラット肝臓において肝切除後早期に肝細胞の形態を示す小型の細胞がクラスターを形成して出現することを報告した (7) 。彼らはこの小型の肝細胞からなる細胞集団を小型肝細胞様肝前駆細胞(Small hepatocyte-like progenitor cells: SHPCs)と名付けた。SHPCsは肝切除5日後には、クラスターとして識別可能となる。その後増大し、構成細胞も徐々に大型化することから30日以降になると周囲の肝細胞との区別が困難になる。定型的な2/3PHを受けたラットでは10日以内に肝重量比は元に戻るが、Ret投与ラット肝臓では元の大きさに戻るのに30日以上かかる。切除14日後のSHPCsは凍結肝組織のヘマトキシリン染色切片で、細胞内に小脂肪滴を有した小型な肝細胞からなるクラスターとして容易に識別できる。Gordonらは、初期のSHPCsにおいて薬物代謝に関わるCyp2b1などCYPsの発現が低いことを報告している(8)。彼らは、CYP活性が低いためにRetの細胞分裂抑制効果に対する抵抗性を持つ肝細胞が小葉内に存在すると考えた。我々も、SHPCsとその周囲の肝細胞をLaser micro-dissection(LMD)法により回収し遺伝子発現をDNA マイクロアレイを用いて網羅的に解析し、SHPCsでは薬物代謝に関わる遺伝子の発現が低いことを確認している(9)。我々はまた、SHPCsに特異的に発現している遺伝子を探索したが、薬物代謝と細胞増殖に関わる遺伝子以外、特異的に発現している遺伝子は認めなかった。SHPCsの起源については、これまで様々な報告がある。Vig P (10)らとChen YH (11)らは、肝小葉内に存在する肝幹細胞から誘導されると報告するのに対し、Arvil Aらは、MHsの脱分化によると考えている (12)。SHPCsの起源に関して明確に答えられる知見を我々は得ていないが、CD44陽性SHsをRet/PHモデルに移植すると、肝組織内にはドナー細胞が形成した細胞集塊(Foci)とレシピエント由来のSHPCsが混在する (3) 。これらの細胞集団を比較すると、CD44陽性細胞の場合、生着した1細胞が増殖して形成されるが、細胞集団内の類洞構造は未熟でかつ成熟マーカーの1つであるC/EBPαの発現はほとんど認められなかった。それに対し、レシピエント由来のSHPCsクラスター内には類洞構造がしっかりと形成され、かつC/EBPαの発現が高かった。この結果は、SHPCsは特別な肝幹細胞から誘導されたと考えるより、前駆細胞としての能力を持つ形態的にはMHsと同等である細胞が脱分化しSHPCsとなり増殖しクラスターを形成したと考える方が理解しやすい。加えてSHPCsのクラスターは、門脈周囲領域(Zone1)に多く見られるが、小葉間胆管細胞との連続性を認めることはないことから、ヘリング管由来の細胞とは考えにくい。全てのSHPCsがCD44を特異的に発現するわけではないことから、SHPCsがSHs由来であると現時点では明言できない。
4.Thy1陽性細胞移植による肝再生促進
GalN投与肝由来Thy1陽性細胞を移植したRet/PH処置ラット肝臓の組織を検討した(9)。移植していないControl群に比べ、SHPCsクラスター数が約3倍、クラスターを構成する細胞数は約2倍に増大していた(図3)。一方、CD44及びMHを投与した肝臓ではSHPCsクラスターの出現頻度や大きさはコントロールと差がなかった。
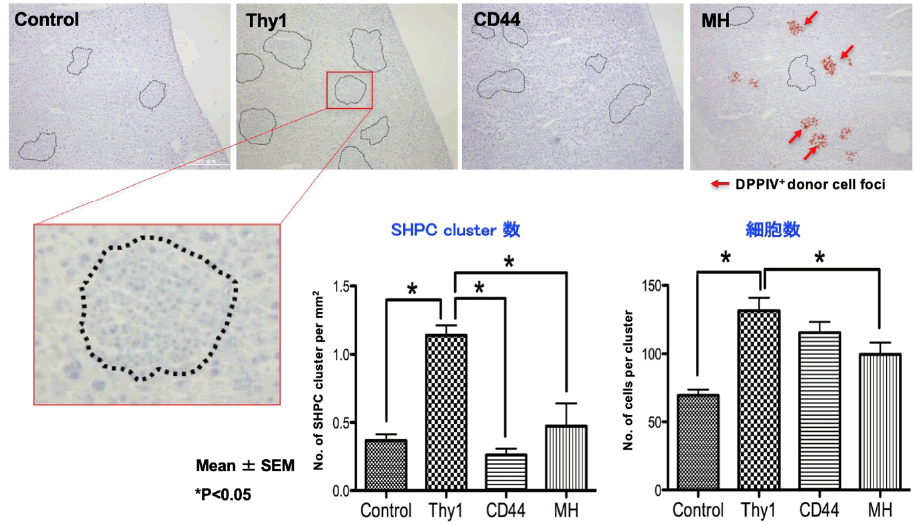
図3 細胞移植によるSHPCsの挙動。GalN投与後3日目の肝臓から分離したThy1陽性細胞(Thy1)、4日目から分離したCD44陽性細胞(CD44)、成熟肝細胞(MH)を脾臓経由でRet/PH処置ラット肝臓に移植し、14日目に肝臓を摘出して検討した。* p<0.05
(Ichinohe N et al, Stem Cells 2017より改変)
Thy1移植によるSHPCs増大メカニズムを解析するため、LMD法でSHPCsを回収し,DNAマイクロアレイで増殖関連因子受容体遺伝子の網羅的解析を行ったところ,Interleukin 17 receptor B(IL17rb)遺伝子の発現が顕著に増加していることが判った(図4)。
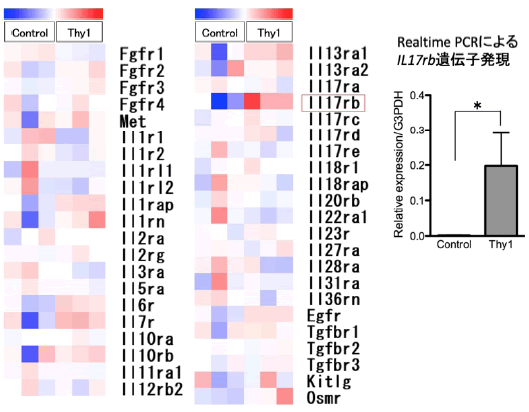
図4 増殖関連因子受容体遺伝子をAgilent社のDNA arrayを用いて網羅的に解析した。Il17rb遺伝子発現をRealtime-qPCRを用いて確認した。*p<0.05
(Ichinohe N et al, Stem Cells2017より改変)
IL17RBに結合するリガンドとして,IL17BとIL25が知られている。移植したThy1陽性細胞やSHPCsに それらの遺伝子発現が認められなかったことから,レシピエント肝に内在する細胞が分泌していると考え、レシピエント肝臓から非実質細胞を分離し解析した。類洞内皮細胞(Sinusoid endothelial cells; SECs)を抗SE-1抗体で、クッパー細胞(Kupffer cells; KCs)を抗CD68抗体で、MACS法を用いてソートし解析したところ、SECsでIl17bが、KCsでIl25遺伝子の発現が誘導されていることを確認した(図5)。
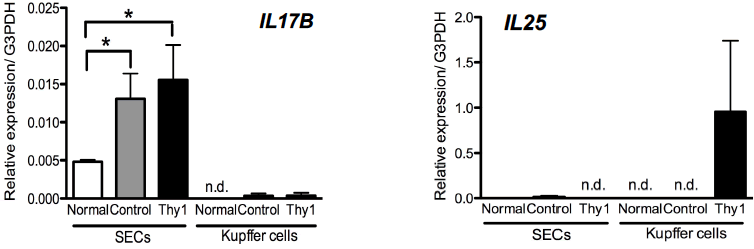
図5 移植14日後の肝臓から分離したSE-1+類洞内皮細胞とCD68+Kupffer細胞のRealtime-qPCRによるIl17b及びIl25遺伝子発現解析。n.d.: not detected. *p<0.05
(Ichinohe N et al, Stem Cells 2017より改変)
近年、細胞間情報伝達物質としての細胞外小胞(Extracellular vesicles; EVs)に関心が集まりつつあり、研究が進んでいる (13)。移植したドナー細胞がEVsを分泌することで、IL17RBシグナルを誘導している可能性が示唆されたため、Thy1陽性細胞の培養上清からEVsを抽出し,成熟ラット肝臓から分離し培養したSECs及びKCsに投与したところ、SECsでIl17bが、KCsでIl25の発現が誘導された(図6)。
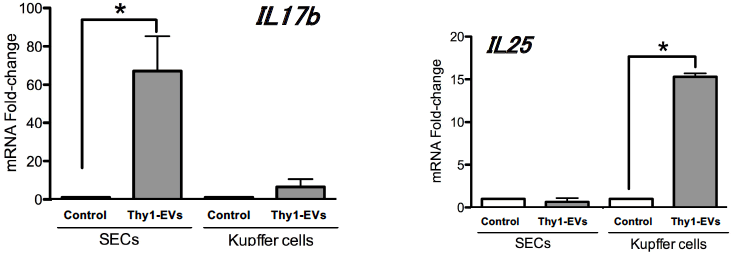
図6 成熟ラット肝臓から分離したSECsとKupffer細胞のIl17b/Il25遺伝子発現。単離したThy1陽性細胞を24時間培養した上清からEVsを分離し、SECs及びKupffer細胞に投与した。24時間後に細胞を回収し、Realtime-qPCRにて遺伝子発現を解析した。*p<0.05
(Ichinohe N et al, Stem Cells 2017より改変)
現在、Thy1陽性細胞由来EVsに含まれているSHPCs増殖促進因子やIL17RBシグナル誘導因子の同定を試みている。
5.骨髄間葉系細胞 (Bone marrow mesenchymal cells: BM-MCs)
Thy1細胞は障害肝から単離した細胞のため臨床応用は困難であるが、同様にThy1を発現する細胞としてBM-MCsがある。BM-MCsは様々な疾患に対して臨床治験が行われている。BM-MCsにも同様にSHPCs増幅作用があるかRet/PH処置ラット肝臓に移植し検討した。ラット大腿骨から骨髄を分離し培養皿に付着し増殖した細胞を移植に用いた。骨髄間葉系幹細胞マーカー遺伝子を発現する細胞を含むThy1陽性細胞であることを確認している。移植後14日目に肝臓を摘出し、その重さを測定したところ、肝臓は肥大し再生が促進されていることが分かった。障害肝由来Thy1陽性細胞と同様の手法でSHPCsの出現頻度と大きさを調べた。
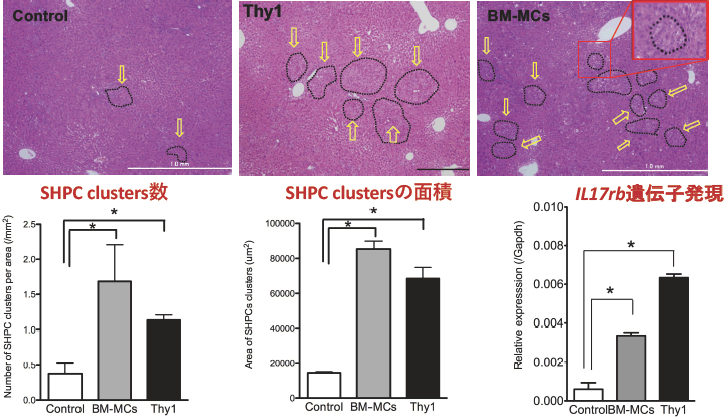
図7 BM-MCs移植によるSHPCsの挙動。初代培養したBM-MCsをRet/PH処置ラット肝臓に脾臓経由で移植し、14日目に肝臓を摘出して組織切片を作成し、SHPCsクラスターの出現頻度と大きさを測定し、障害肝由来Thy1陽性細胞(Thy1)の場合と比較検討した。LMDで採取したSHPCsのIl17rb遺伝子発現をRealtime-qPCRで調べた。*p<0.05
(Ichinohe N et al, Stem Cell Res Ther 2021より改変)
図7で示すように、障害肝由来Thy1陽性細胞より出現頻度は高く、大きなクラスターが形成されることが分かった。しかしながら、SHPCsクラスターのIl17rb遺伝子発現はコントロールに比べると有意に高いが、障害肝由来Thy1陽性細胞と比べると低かった。DNA arrayを用いた網羅的遺伝子発現解析の結果も、明らかに障害肝由来Thy1陽性細胞とBM-MCsでは誘導されたSHPCsの遺伝子発現は異なることが分かった(図8)。この結果は、Thy1とは異なるメカニズムでSHPCsを増幅することを示唆している(14)。
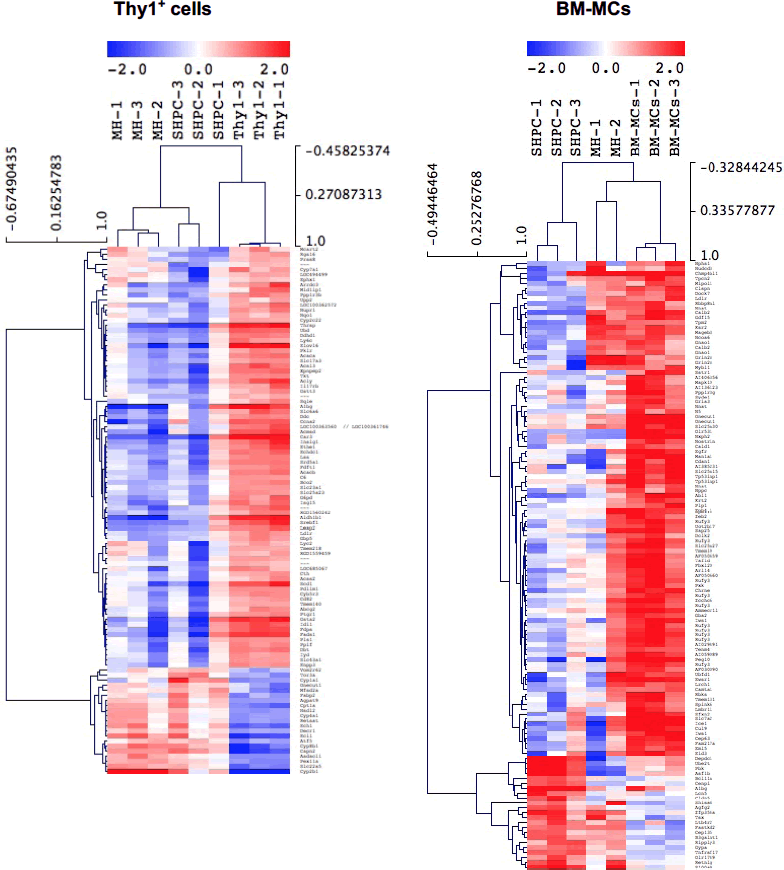
図8 肝細胞の分化機能に関連する遺伝子発現をAgilent社のDNA arrayを用いて網羅的に解析した。BM-MCs移植により誘導されたSHPCsの遺伝子発現パターンは、Thy1陽性細胞移植により誘導されたSHPCsよりMHsの発現パターンに似ていることから、より分化していることが分かる。(Ichinohe N et al, Stem Cell Res Ther 2021より改変)
内在性Kupffer細胞の影響を検討するため、Ret/PH処置ラットに塩化ガドリニウム (Gd)を投与し貪食活性を抑制した後、障害肝由来Thy1細胞とBM-MCsを移植した。障害肝由来Thy1細胞移植群では、Gd投与によるSHPCsの増殖促進作用はみられず、BM-MCs移植群では増殖促進作用が増強された(図9)。この結果は、障害肝由来Thy1細胞移植群ではKupffer細胞がドナー細胞を貪食し活性化されることによりIL25が分泌され、IL17RBシグナルを介してSHPCsを増殖させているのに対し、BM-MCs移植ではKupffer細胞は関与せず、BM-MCsが分泌するEVsの直接作用によりSHPCsの増殖が促進されている可能性を示している。
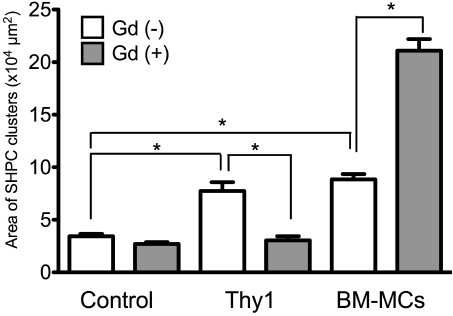
図9 GdCl3投与によるKupffer細胞活性抑制下での細胞移植によるSHPCsの挙動。移植24時間前にGdCl3を投与し、移植14日目に肝臓を摘出し、組織切片を作成した。*p<0.05
(Ichinohe N et al, Stem Cell Res Ther 2021より改変)
BM-MCsのEVsに含まれるmiRNAを網羅的に解析したところ、障害肝由来Thy1陽性細胞とBM-MCsに含まれるmiRNAは異なり、BM-MCsでは有意差を認めたmiRNAは4因子あった。それらのmimicをSHs培養に添加し、増殖活性を検討したところ、miR-146a-5pに増殖促進作用があることが分かった (図10) 。
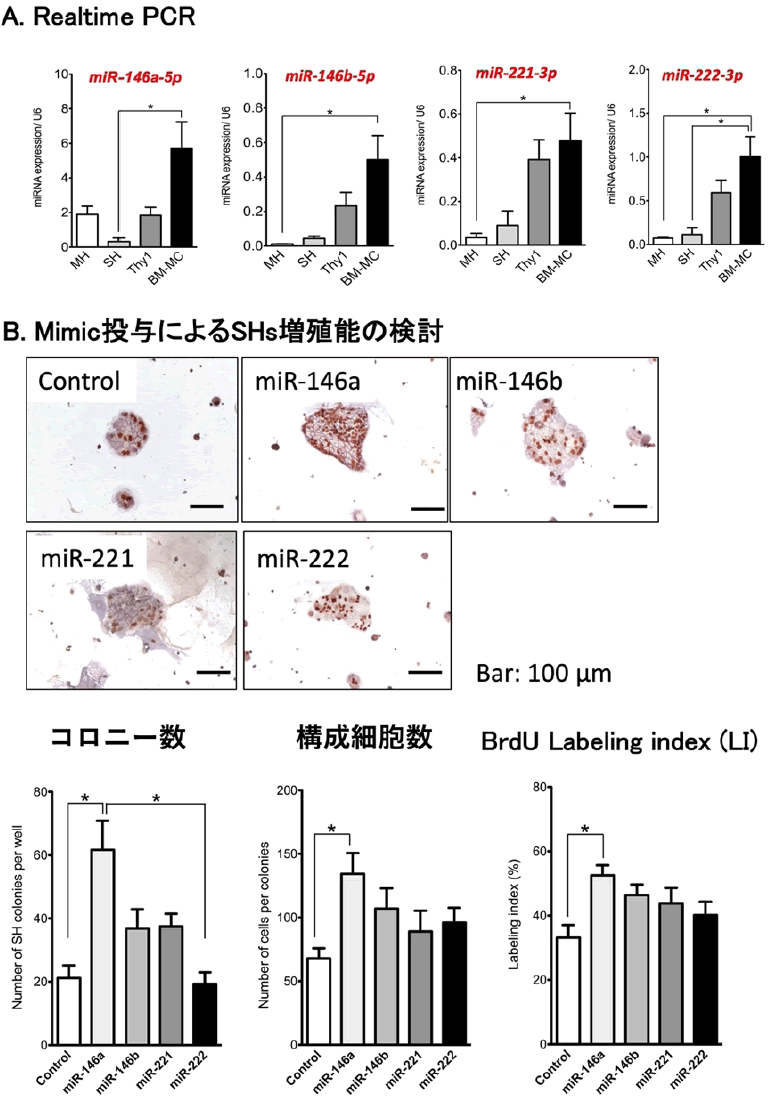
図10. BM-MCs由来EVs内の増殖促進因子の探索。miRNAマイクロアレイから候補因子を抽出し、Realtime-qPCRで有意性を確認し、miR-146a-5p, miR-146b-5p, miR-221-3p, miR-222-3pを選択した。これらのmimicをSHs培養に添加し、増殖活性を検討したところ、miR-146a-5pを投与した場合でSHsの増殖が有意に高まった。(Ichinohe N et al, Stem Cell Res Ther 2021より改変)
miR-146a-5pを、レンチウイルスベクターを用いてBM-MCsに強制発現させると、EVs中に含まれるmiR-146a-5pの発現量が約5倍高まる。このEVsをRet/PH処置ラット肝臓に投与したところ、SHPC cluster数は、Controlに比べて約3倍、cluster当たりの細胞数は約2倍増大した(図11)。これらの結果は、BM-MCs由来EVs中のmiR-146a-5pが内在性肝前駆細胞を増大させる重要因子であることを示している。
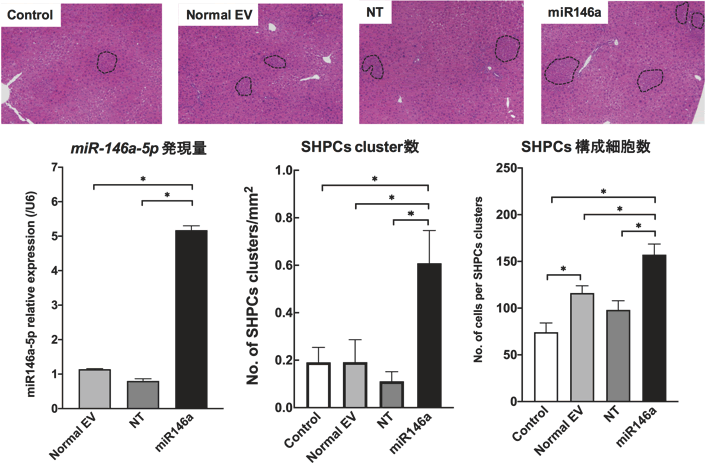
図11 miR-146a-5pを強制発現したBM-MCs由来EVsを投与した肝組織の写真とSHPCsの挙動。レンチウイルスを感染させていないBM-MCs由来EVs (Normal EV)とNegative target miRNAを含んだレンチウイルスを感染させたBM-MCs由来EVs (NT)に比較し、miR-146a-5p を強制発現させたBM-MCs由来EVs (miR-146a)で約5倍強制発現させることが出来た。このEVsをRet/PH処置ラット肝臓に脾臓経由で投与し、投与14日後の肝組織を調べた。SHPC cluster数は、Control、Normal EV、 NTに比べて約3倍、cluster当たりの細胞数はControlに比べて約2倍有意に増大した。 *p<0.05。(Ichinohe N et al, Stem Cell Res Ther 2021より改変)
6.今後の展開と問題点
細胞移植治療のメカニズムとして、ドナー細胞による置換法以外に、内在性肝前駆細胞誘導による肝再生促進治療の可能性を示した。近年、C型肝炎ウイルス(HCV)に対する有効性の高い抗ウイルス薬(Direct Acting Antivirals; DAA)が臨床応用されたことにより、C型肝炎ウイルス患者からのウイルス除去(Sustained virological responses; SVR)が可能になった。SVRによって慢性肝炎から肝硬変症、肝癌へ進行する患者数は激減すると考えられている。しかしながら、SVRにより非代償性肝硬変症肝臓において線維の減少が見られても、肝機能の改善が見られない患者が多いことから、一旦非代償性肝硬変症へ症状の進行した患者の根治は、肝移植を行わなければ現状では難しい。そのような患者の肝臓では残存する肝細胞の分化機能や増殖機能が低下していると考えられ、肝機能を補填するには外部から肝細胞を補充する以外ない。しかしながら、肝細胞を移植しても再生刺激を加えないと生着率が低く置換効率も悪い事、置換までに時間がかかる事は細胞移植のネックである。我々の一連の研究結果は、レシピエント肝臓に内在する肝前駆細胞を活性化し誘導できれば、新たな肝細胞が機能低下した既存の肝細胞を置換し、肝機能の補填が可能であることを示唆している。内在性肝前駆細胞活性化には細胞そのものを移植する必要はなく、細胞が分泌するEVsやmiRNAを内包させた 脂質ナノ粒子(Lipid nano-particle) など新たに開発されたDDS(15)を用いることで可能になるであろう。
参考文献
- Kon J, Ooe H, Oshima H, Kikkawa Y, Mitaka T. Expression of CD44 in rat hepatic progenitor cells. J Hepatol 2006; 45(1): 90-98.
- Kon J, Ichinohe N, Ooe H, Chen Q, Sasaki K, Mitaka T. Thy1-positive cells have bipotential ability to differentiate into hepatocytes and biliary epithelial cells in galactosamine-induced rat liver regeneration. Am J Pathol 2009; 175(6): 2362-2371.
- Ichinohe N, Kon J, Sasaki K, Nakamura Y, Ooe H, Tanimizu N, Mitaka T. Growth ability and repopulation efficiency of transplanted hepatic stem cells, progenitor cells, and mature hepatocytes in retrorsine-treated rat livers. Cell Transplant. 2012; 21(1): 11-22.
- Nishikawa Y, Doi Y, Watanabe H, Tokairin T, Omori Y, Su M, Yoshioka T, Enomoto K. Transdifferentiation of mature rat hepatocytes into bile duct-like cells in vitro. Am J Pathol 2005; 166: 1077-1088.
- Tanimizu N, Nishikawa Y, Ichinohe N, Akiyama H, Mitaka T. Sry HMG box protein 9-positive (Sox9+) epithelial cell adhesion molecule-negative (EpCAM-) biphenotypic cells derived from hepatocytes are involved in mouse liver regeneration. J Biol Chem 2014; 289: 7589-7598.
- Laconi E, Sarma DS, Pani P. Transplantation of normal hepatocytes modulates the development of chronic liver lesions induced by a pyrrolizidine alkaloid, lasiocarpine. Carcinogenesis 1995; 16(1): 139-142.
- Gordon GJ, Coleman WB, Grisham JW. Temporal analysis of hepatocyte differentiation by small hepatocyte-like progenitor cells during liver regeneration in retrorsine-exposed rats. Am J Pathol 2000; 157(3): 771-786.
- Gordon GJ, Coleman WB, Hixson DC, Grisham JW. Liver regeneration in rats with retrorsine-induced hepatocellular injury proceeds through a novel cellular response. Am J Pathol 2000; 156(2): 607-619.
- Ichinohe N, Ishii M, Tanimizu N, Kon J, Yoshioka Y, Ochiya T, Mizuguchi T, Hirata K, Mitaka T. Transplantation of Thy1+ cells accelerates liver regeneration by enhancing the growth of small hepatocyte-like progenitor cells via IL17RB Signaling. Stem Cells 2017; 35(4): 920–931.
- Vig P, Russo FP, Edwards RJ, Tadrous PJ, Wright NA, Thomas HC, Alison MR, Forbes SJ. The sources of parenchymal regeneration after chronic hepatocellular liver injury in mice. Hepatology 2006; 43: 316–324
- Chen YH, Chang MH, Chien CS, Wu SHY, Yu CH, Chen HL. Contribution of mature hepatocytes to small hepatocyte-like progenitor cells in retrorsine exposed rats with chimeric livers. Hepatology 2013; 57(3): 1215–1224.
- Avril A, Pichard V, Bralet MP, Ferry N. Mature hepatocytes are the source of small hepatocyte-like progenitor cells in the retrorsine model of liver injury. J Hepatol 2004; 41(5): 737–743.
- Lemoinne S, Thabut D, Housset C, Moreau R, Valla D, Boulanger CM, Rautou PE. The emerging roles of microvesicles in liver diseases. Nat Rev Gastroenterol Hepatol 2014; 11(6): 350-361.
- Ichinohe N, Ishii M, Tanimizu N, Mizuguchi T, Yoshioka Y, Ochiya T, Suzuki H, Mitaka T. Extracellular vesicles containing miR-146a- 5p secreted by bone marrow mesenchymal cells activate hepatocytic progenitors in regenerating rat livers. Stem Cell Res Ther 2021; 12(1): 312.
- Leung AK, Tam YY, Cullis PR. Lipid nanoparticles for short interfering RNA delivery. Adv Genet 2014; 88: 71-110.










