研究交流
自己完結型肝硬変再生療法(培養自己骨髄間葉系幹細胞肝動脈投与療法)
高見 太郎
山口大学大学院医学系研究科 消化器内科学 教授
【サマリー】
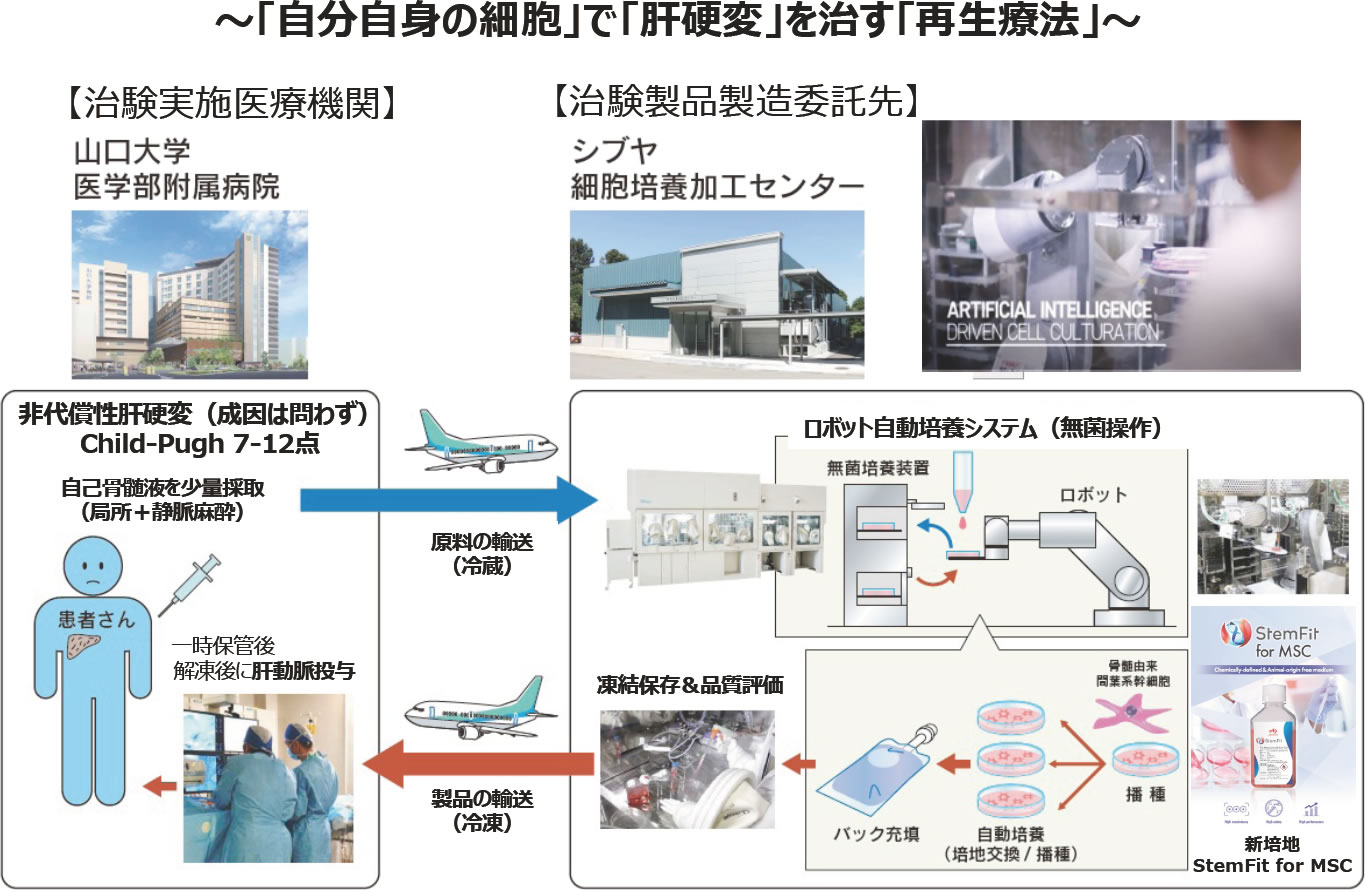
以前より当科では肝硬変に対する自己骨髄細胞を用いた肝臓再生療法の実現に向けた橋渡し研究を行っている. 2003年11月に世界で初めて実施された自己骨髄細胞を用いた肝臓再生療法では, 全身麻酔より採取した約400mLの骨髄液を使用して, 非培養の全骨髄単核球細胞分画を点滴で投与する治療法にて実施し, 本治療は先進医療Bとして承認された. しかし全身麻酔で400mL 採取するのは侵襲度が高いことから, 少量の自己骨髄液から間葉系幹細胞(Mesenchymal stem cell; MSC)を培養して投与する低侵襲な肝臓再生療法の研究に取り組み, 2020年9月より培養自己骨髄間葉系幹細胞を肝動脈投与する自己完結型肝硬変再生療法を医師主導治験(jRCT2063200014)として行っている.
【骨髄間葉系幹細胞について】
1970年代にFriedensteinは,血清を添加した液体培地を用いてモルモットの骨髄細胞をプラスチック培養容器に播種すると,1〜2週後に線維芽細胞様の細胞からなるコロニーが出現することを発見し,colony-forming unit-fibroblasts (CFU-f)と名付けた(1).そして, このCFU-fはin vitroで脂肪細胞,骨芽細胞,軟骨細胞の3系統に分化し,モルモットの腎被膜下に移植すると数週間後には線維組織と骨組織に分化して骨髄微小環境を形成したことを報告した(1, 2).これが間葉系幹細胞(Mesenchymal stem cell; MSC)に関する初期の報告であり,1999年にはPittengerらによりヒト骨髄中にMSCの存在が発見された(3).このMesenchymal stem cellの名称は1991年にCaplanにより提唱され(4),現在も広く用いられているが,MSCの幹細胞性と名称については議論があり,2006年に国際細胞治療学会 (International Society for Cellular Therapy; ISCT)は名称をmultipotent mesenchymal stromal cellsとした上で, ヒトMSCの定義についてガイドラインを示した.この定義では① 標準的な培養条件でプラスチックに接着性を有する,② 細胞表面マーカーとして CD105, CD73,CD90が陽性,CD45,CD34,CD14,またはCD11b, CD79α,または CD19, HLA-DR が陰性,③ 骨芽細胞,軟骨細胞,脂肪細胞への分化能を有することが必要最低限の条件とされている(5).なお,この定義はin vitroで培養したMSCに関するものであり,必ずしもin vivoでのMSCの表現型ではないことに留意が必要である.ヒト骨髄からのMSCの分離に有用な細胞表面マーカーとして,STRO-1 (antigen of the bone marrow stromal-1 antigen, cell surface antigen expressed by stromal elements in human bone marrow-1), vascular cell adhesion molecule 1/CD106, melanoma cell adhesion molecule/CD146などが報告されている(6, 7, 8).
【骨髄間葉系幹細胞の特性と臨床応用】
MSCは中胚葉性組織に由来する体性幹細胞で,骨髄,脂肪,臍帯血,胎盤,歯髄などに存在する.骨,軟骨,脂肪などの中胚葉性組織への分化のみではなく,外胚葉性の神経細胞や内胚葉性の肝細胞にも分化する多分化能を有する.また,免疫原性が低く他家移植が可能であり,培養による増殖と凍結保存が可能であることから,再生医療の細胞源として注目されている. MSC を用いた再生医療では,MSC の多分化能を活かし, 細胞を障害組織に補填する方法と,MSC から分泌される液性因子による免疫制御作用,抗炎症作用,血管新生作用などを利用して障害組織に残存する細胞の再生を促す方法がある.
骨髄MSCは採取が比較的容易であるため,特に基礎研究や臨床応用が活発に行われおり, 日本では再生医療等製品として,骨髄MSCを用いた2製品(造血幹細胞移植後の急性移植片対宿主病を適応とするテムセルHS注,脊髄損傷に伴う神経症候及び機能障害を適応症とするステミラック注)が上市されている. そして我々は,非代償性肝硬変症に対して自己骨髄MSCを投与することで肝機能を改善する肝臓再生療法を開発し,医師主導治験「自己完結型肝硬変再生療法」を実施している(jRCT2063200014).
【当科における自己骨髄細胞投与療法の開発基盤】
当科ではマウス基礎研究成果を基盤に(9, 10), 非代償性肝硬変症を対象として, 2003年 11 月に臨床研究「肝硬変症に対する自己骨髄細胞投与療法」を開始し(11), 2005年からの多施設臨床研究を経て,「C型肝炎ウイルスに起因する肝硬変患者に対する自己骨髄細胞投与療法の有効性と安全性に関する研究(jRCTb060190031)」が先進医療Bとして承認された. この自己骨髄細胞投与療法では, 全身麻酔下に自己骨髄液を約400mL採取し山口大学医学部附属病院 再生・細胞治療センターで骨髄液を洗浄濃縮したうえで非培養の全骨髄単核球細胞を同日中に末梢静脈より点滴投与するものである.
【当科における低侵襲肝臓再生療法の開発 〜自己完結型肝硬変再生療法〜】
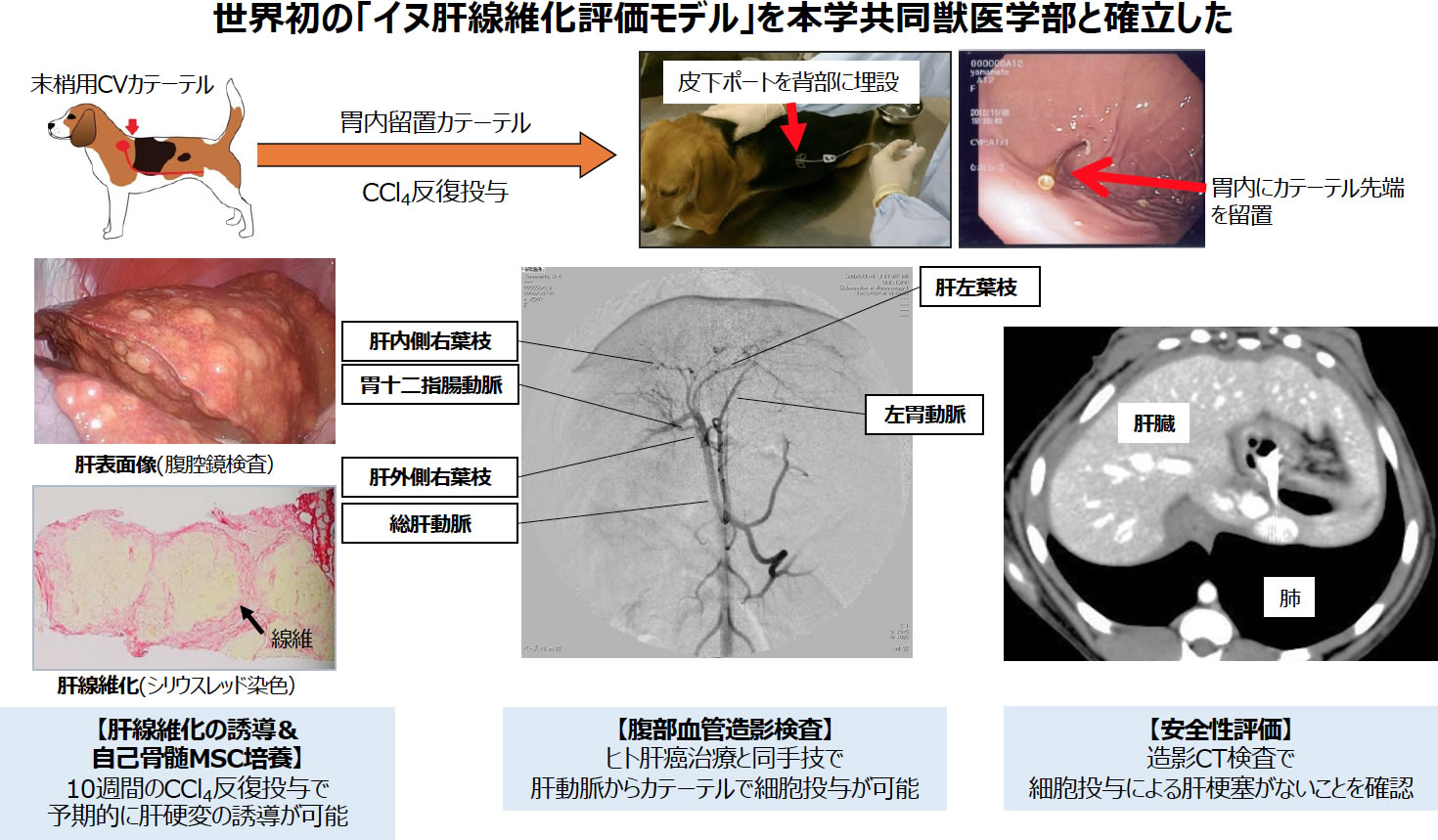
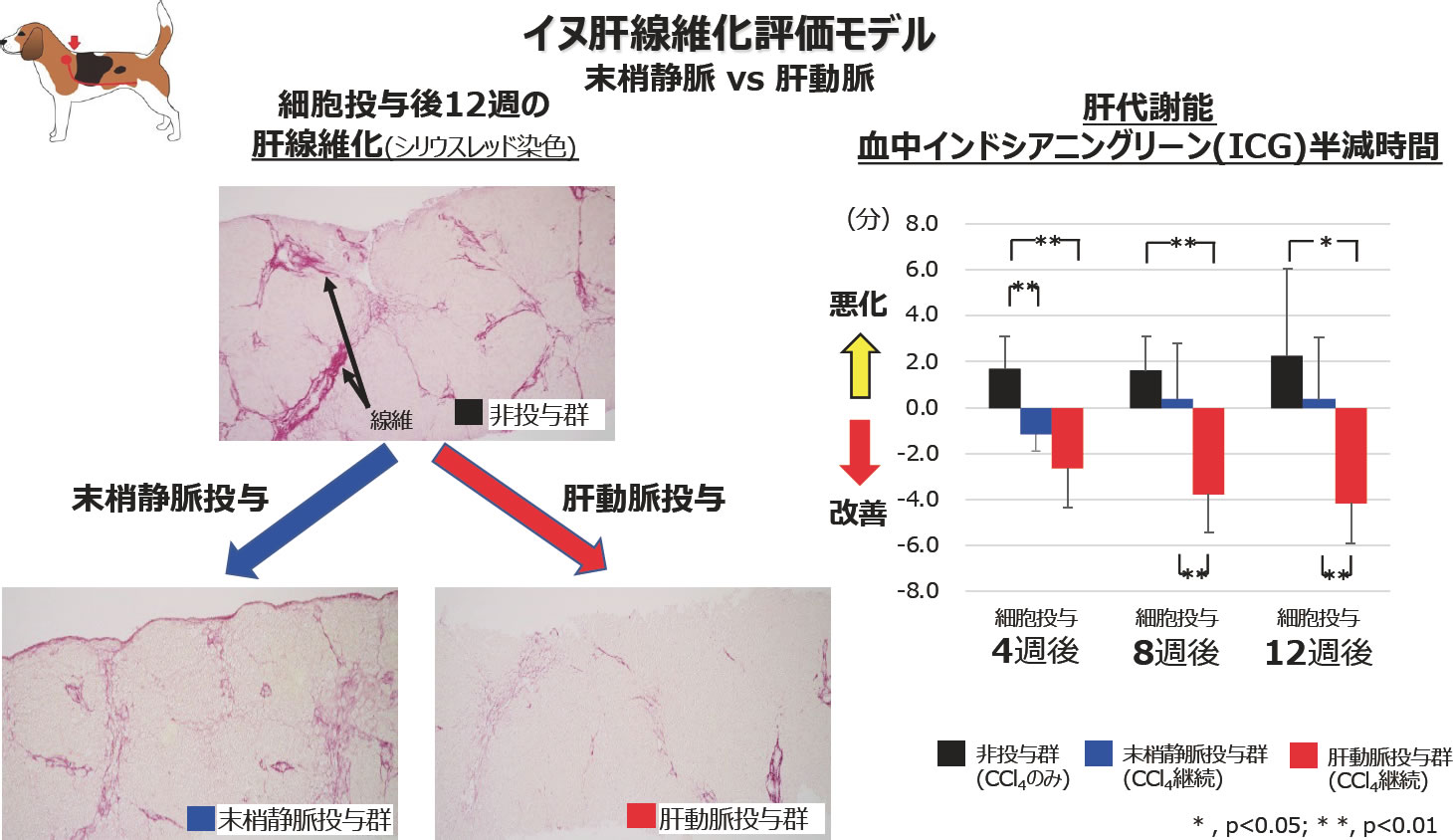
前述の自己骨髄細胞投与療法と並行して, マウス肝硬変モデルに対する骨髄MSC投与の有効性確認を基盤にして, 局所麻酔(静脈麻酔併用)下に採取した少量自己骨髄液から培養した「骨髄MSCを用いた低侵襲肝臓再生療法」の研究開発を行ってきた(12, 13). またその後の「再生医療の実現化ハイウェイ事業(AMED)」では, イヌ肝線維化評価モデル(14, 15, 16)を作出し, 培養自己骨髄MSCの投与経路を検討した. なぜなら, 我々の治療法は自己骨髄液を使用しているので, 採取できる量が限られている. そのため限られた原料で高い有効性を発揮させるには, 品質の良い細胞を多く製造し, より確実に標的臓器に届けることが必要である. そこで, 細胞を標的臓器である肝臓に確実に届けるために, 投与ルートを末梢静脈投与から肝動脈投与に変更することを着想し, この妥当性をイヌ肝線維化評価モデルで検証した(図1). 具体的には, 胃内留置カテーテル四塩化炭素反復投与10週間で肝線維化を誘導した. 10%ウシ胎児血清含有培地で培養した自己骨髄MSCを, 四塩化炭素投与は継続したうえで, 末梢静脈投与群は点滴投与で, 肝動脈投与群は血管造影検査手技を用いて経カテーテル的に動注した. その結果, 肝動脈投与群の肝線維化および血中インドシアニングーリーン値半減時間は, 末梢静脈投与群と比しても有意に改善されており, その安全性と有効性を確認した(図2)(15). その後, PMDA相談を複数回実施し, 生物由来原料基準や品質, 非臨床安全性試験データ, 治験実施計画に関する対面助言を経て, これら合意を得た. 2020年6月には山口大学IRBに治験申請し承認取得し, 同年7月にPMDAへ治験届を提出, 8月の治験届受理を待って, 同年9月から山口大学医学部附属病院で医師主導治験を開始した. 詳しい情報は山口大学医学部附属病院ホームページを参照いただきたい. http://www.hosp.yamaguchi-u.ac.jp/news/news/post_375.html
【化学合成培地(Chemically defined medium)の開発経緯】
細胞培養工程におけるウシ胎仔血清の使用は, 細胞の頻回投与を想定している場合はアレルギー反応の可能性があるため好ましくない. その他にもウシ胎仔血清の抱える課題としては, 安定供給のリスク, ロット間差やそれによる細胞製品のロット間差, 臨床使用時のγ滅菌照射コストなどがある. またウシ胎仔血清には細胞培養に不要な成分が入っている可能性がある. さらに一般にMSCを長期継代すると, 細胞の老化(細胞形態が扁平大型化して増殖性が低下する現象)やMSCが持つ抗炎症作用の低下が認められ, 細胞の質が低下する.これまでの臨床研究ではニュージーランド産のガンマ線滅菌したウシ胎仔血清添加培地を使用してきたが, 今回, 化学合成培地(Chemically defined medium) StemFit® For MSCの共同開発に取り組み, 我々がMSCの特性評価を行う上で重要視している, MSC本来の機能(炎症性サイトカインの発現が低値, 抗炎症性サイトカインの発現が高値, 細胞の老化マーカーが低値)が維持される化学合成培地を開発し, 医師主導治験「自己完結型肝硬変再生療法」で採用している. 現在, StemFit® For MSCとして日本, 米国, 韓国, 台湾, 中国で販売している. 詳しい情報は該当ホームページを参照いただきたい. http://www.ahs.ajinomoto.com/products/bio/stemfit.html#block03
【医師主導治験「自己完結型肝硬変再生療法」の参加条件】
最後に参考情報として, 参加条件を示しています。治験を安全に行うために, この治験に参加いただくには, 決められた条件を満たす方が対象となります.
参加いただける方:以下のすべてがあてはまる方に参加いただけます.
- この説明文書の内容を理解し, 署名により治験への参加に同意いただける方
- 治験への登録時の年齢が20歳以上75歳以下の方
- 検査により, 肝硬変であることが確認されている方
- 肝硬変の重症度を示すスコアが, この治験の参加基準を満たす方
- 妊娠可能な女性の場合, 妊娠検査の結果が陰性の方
- 妊娠可能な女性のパートナーの方, または, 妊娠可能な女性の方で, 私たち担当医師がお願いする避妊法に同意いただける方
- 予定された検査の時期に来院して, 検査を受けることができる方
参加いただけない方:以下のいずれかにあてはまる方は参加いただけません.
- がん(血液がん・固形がん)がある方(がんの治療後の場合, 1年以上経過していない方)
- 破裂の危険性がある食道・胃静脈瘤がある方
- アルコールが原因の肝硬変の場合で, 同意前の6ヵ月間に飲酒された方
- 出血しやすい方
- 他人の血液を輸血することに同意できない方
- 妊娠を希望されている方, 妊娠中または授乳中の方
- 骨髄液を採取することができない方
- 腹部の血管造影検査を受けることができない方
- 局所麻酔または静脈麻酔を受けることができない方
- 治験製品の製造・投与に使用する薬剤に対して, 重度のアレルギーのある方, またはアレルギーを起こしたことのある方
- 他の治験や臨床研究に参加している方, 以前に本治験に参加した方
- なお, これらの基準を満たす場合でも, この他にも様々な基準がありますので, 「スクリーニング検査」の結果や私たち担当医師の判断により参加いただけない場合があります.
【まとめ】
MSC投与経路は末梢静脈や肝動脈が想定される.末梢静脈投与は簡便であるが, 多くの細胞が肺に捕捉される. 一方, 肝動脈投与は血管造影手技が必要であるが肝臓に直接細胞を送達させることが可能で, イヌモデルで高い有効性を確認したため, 自己完結型肝硬変再生療法の医師主導治験実施に至った. 今後も症例を積み重ね早期薬事承認に向けて取り組んでいく.
【謝辞】
小生は令和3年7月に山口大学大学院医学系研究科消化器内科学 第6代教授を拝命いたしました. 本稿の研究内容は, これまでの当教室における一連の肝臓再生療法の橋渡し研究を小生が代表して紹介したものであり皆様に御礼申し上げます. またAMED, 厚生労働省, JST, JSPS, 山口県からの公的資金や寄附講座(肝臓再生基盤学:澁谷工業株式会社)等の支援によるものであり, 御礼申し上げます. 最後になりますが本研究会の世話人にご推薦いただきましたこと, このような研究紹介の機会をご提供いただいた本研究会の諸先生に厚く御礼申し上げます.
文献:
- Friedenstein AJ, Chailakhjan RK, Lalykina KS. The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells. Cell Tissue Kinet. 1970;3(4):393-403.
- Friedenstein AJ, Chailakhyan RK, Latsinik NV, et al. Stromal cells responsible for transferring the microenvironment of the hemopoietic tissues. Cloning in vitro and retransplantation in vivo. Transplantation. 1974;17(4):331-40.
- Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284(5411):143-7.
- Caplan AI. Mesenchymal stem cells. J Orthop Res. 1991;9(5):641-50.
- Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006;8(4):315-7.
- Simmons PJ, Torok-Storb B. Identification of stromal cell precursors in human bone marrow by a novel monoclonal antibody, STRO-1. Blood. 1991;78(1):55-62.
- Gronthos S, Zannettino AC, Hay SJ, et al. Molecular and cellular characterisation of highly purified stromal stem cells derived from human bone marrow. J Cell Sci. 2003;116(Pt 9):1827-35.
- Sacchetti B, Funari A, Michienzi S, et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment. Cell. 2007;131(2):324-36.
- Terai S, Sakaida I, Yamamoto N, et al. An in vivo model for monitoring trans-differentiation of bone marrow cells into functional hepatocytes. J Biochem. 2003;134(4):551-8.
- Sakaida I, Terai S, Yamamoto N, et al. Transplantation of bone marrow cells reduces CCl4-induced liver fibrosis in mice. Hepatology. 2004;40(6):1304-11.
- Terai S, Ishikawa T, Omori K, et al. Improved liver function in patients with liver cirrhosis after autologous bone marrow cell infusion therapy. Stem Cells. 2006;24(10):2292-8.
- Tanimoto H, Terai S, Takami T, et al. Improvement of liver fibrosis by infusion of cultured cells derived from human bone marrow. Cell Tissue Res. 2013;354(3):717-28.
- Quintanilha LF, Takami T, Hirose Y, et al. Canine mesenchymal stem cells show antioxidant properties against thioacetamide-induced liver injury in vitro and in vivo. Hepatol Res. 2014;44(10):E206-17.
- Matsuda T, Takami T, Sasaki R, et al. A canine liver fibrosis model to develop a therapy for liver cirrhosis using cultured bone marrow-derived cells. Hepatol Commun. 2017;1(7):691-703.
- Nishimura T, Takami T, Sasaki R, et al. Liver regeneration therapy through the hepatic artery-infusion of cultured bone marrow cells in a canine liver fibrosis model. PLoS One. 2019;14(1):e0210588.
- Takami T, Tani K, Taura Y, et al. Canine Liver Fibrosis Model to Assess the Functions of Infused Autologous Bone Marrow-Derived Cells. Methods Mol Biol. 2019;1905:201-9.