研究交流
TRAF3-NIK経路を介した肝細胞分化転換による肝内胆管がん発症機序の解明
大阪大学大学院医学系研究科 消化器内科学
小玉尚宏、竹原徹郎
はじめに
原発性肝がんに分類される肝内胆管がん(ICC)は、発症原因に不明な点が多く予後不良ながんである(1)。がんゲノム解析により明らかとなった遺伝子異常の多くは創薬が困難であり、進行例における治療の中心はいまだ殺細胞性の抗がん剤であることから、分子病態のさらなる解明と新規治療標的の発見が望まれている。我々はこれまで、変異原性を有するSleeping Beauty(SB)トランスポゾンを用いてランダムな遺伝子変異をマウス体内で誘発する技術により、任意の臓器において発がんを誘導し、その原因となるがん関連遺伝子を多数同定してきた(図1)(2-5)。今回このシステムを用いることで、ICCの新たながん抑制遺伝子としてTRAF3を同定し、肝細胞においてこの遺伝子の機能が喪失した結果、胆管細胞への分化転換を介してICCの発症に至ることを明らかにした(6)。そこで本稿では、この新規ICC発症機序を紹介し、ICCに対する新たな創薬の可能性についても言及する。
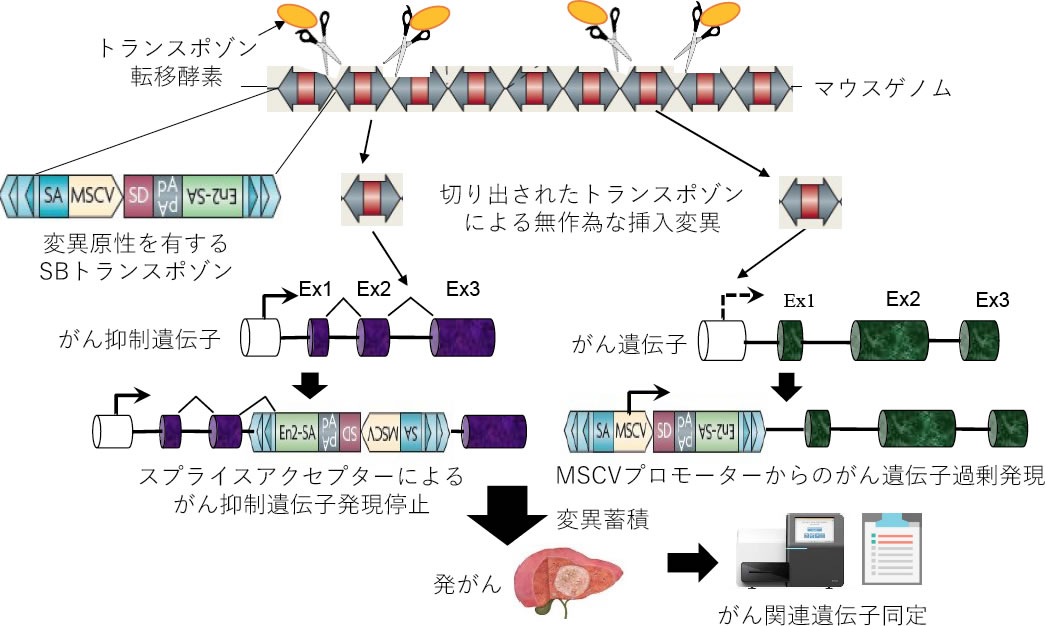
図1.SBトランスポゾンを⽤いたがん関連遺伝⼦スクリーニング
変異原性を有するSBトランスポゾンを過剰発現したマウスでは、トランスポゾン転移酵素の働きで切り出されたトランスポゾンが無作為な挿⼊変異を誘発し、がん関連遺伝⼦に変異が蓄積することで発がんに⾄る。トランスポゾン挿⼊部位を次世代シークエンサーにより網羅的に解読することで、がんの発症に寄与した遺伝⼦の同定が可能となる
トランスポゾンを用いたがん遺伝子スクリーニングによるICCの新規がん抑制遺伝子TRAF3の同定
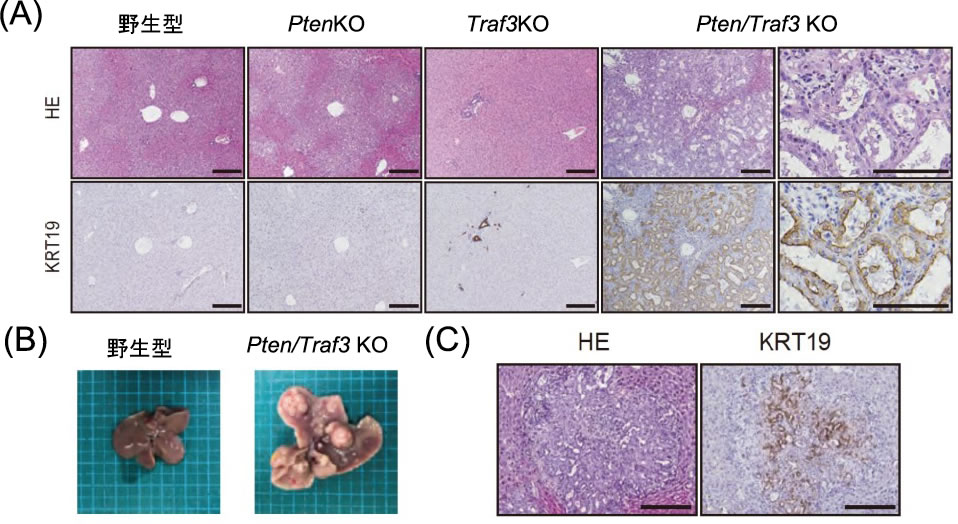
我々は、ICCの発症に関する分子を探索するため、SBトランスポゾンを用いたがん遺伝子スクリーニングを実施した。長期飼育により肝細胞がん(HCC)やICCを自然発症する肝特異的Pten KOマウス(Alb-Cre;Pten flox/flox)を用いて、SBトランスポゾンによる挿入変異を誘発した結果、肝腫瘍形成が有意に促進された。そこで、KRT19陽性の胆管がん成分を有する肝腫瘍からゲノムDNAを抽出し、トランスポゾンの挿入により変異が生じた遺伝子を次世代シークエンサーで網羅的に検出した結果、Traf3遺伝子に最も高頻度に不活性化型の変異が生じていることを見出した。スクリーニング結果を検証するため、肝特異的Traf3KOマウス(Alb-Cre;Traf3flox/flox)とAlb-Cre;Pten flox/floxマウスとの交配により肝特異的Traf3/Pten両欠損マウス(Alb-Cre;Pten flox/flox;Traf3flox/flox)を作成した結果、このマウスは早期から著しい肝内胆管の増生が生じ、ICCを自然発症した(図2A-C)。また、ICC症例において高頻度に活性化型変異が認められるKrasが肝特異的に恒常活性化するマウス(Alb-Cre; KrasG12D/+)においてTraf3を欠失させた結果(Alb-Cre;KrasG12D/+;Traf3flox/flox)、同様の表現型が認められた。以上から、TRAF3はICCの新規がん抑制遺伝子であることが明らかになった。
図2.肝特異的Traf3/Pten両欠損マウスは著しい肝内胆管の増生が生じ、肝内胆管がんを自然発症する
(A)肝組織HE染色、KRT19染色、(B)肝マクロ像、(C)腫瘍部HE染色、KRT19染色、文献6より改変
ICCはTRAF3の欠損した肝細胞から発症する
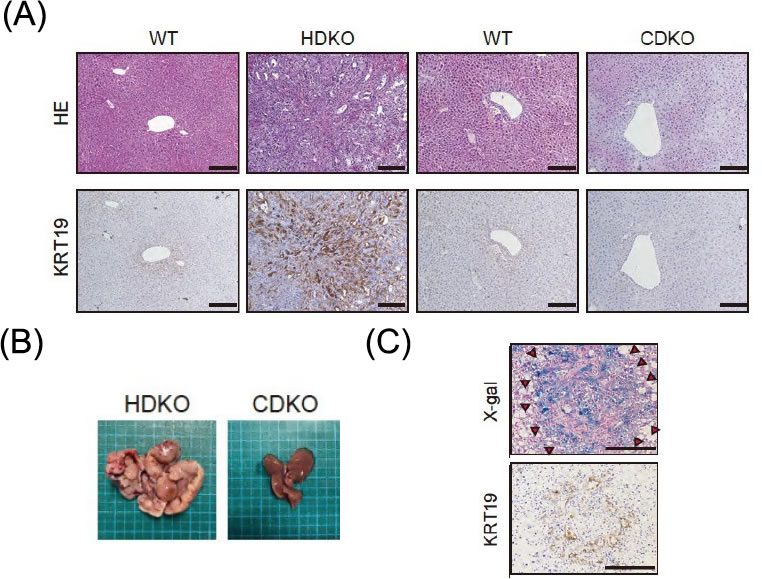
次に、ICCの起源細胞の探索を行った。肝細胞(Alb-CreERT2)もしくは胆管細胞(K19-CreERT2)においてタモキシフェン誘導性にCreを発現するマウスを用いて、Traf3/Pten遺伝子を各細胞特異的に欠失させた結果、肝細胞特異的欠損マウスにおいてのみICCが発症することを見出した(図3A,B)。そこでRosa26 Creレポーターマウス(Rosa26-LacZ)を用いて細胞系譜解析を実施した結果、肝細胞特異的Traf3/Pten欠損マウスで生じた増殖胆管細胞やICCはX-gal染色で陽性となり、肝細胞に由来すると考えられた(図3C)。この結果を更に検証するため、Pten flox/flox;Traf3flox/floxマウスに対してCre発現ベクターを尾静脈急速静注法やアデノウイルス関連ベクター(AAV8)により肝内に導入し、肝細胞特異的にTraf3/Pten遺伝子を欠損させた結果ICCの発症が認められた。以上から、ICCはTRAF3の欠損した肝細胞から発症することが明らかになった。
図3.肝細胞におけるTRAF3の欠損により肝内胆管がんが発症する
(A)肝組織HE染色、KRT19染色、(B)肝マクロ像、 (HDKO:肝細胞特異的Traf3/Pten両欠損マウス、CDKO:胆管細胞特異的 Traf3/Pten両欠損マウス) (C)肝細胞特異的Traf3/Pten両欠損・Rosa26 Creレポーターマウスにおける肝腫瘍X-gal染色、KRT19染色、文献6より改変
TRAF3はNIKを負に制御することで肝細胞から胆管細胞への分化転換を介したICCの発症を抑制する
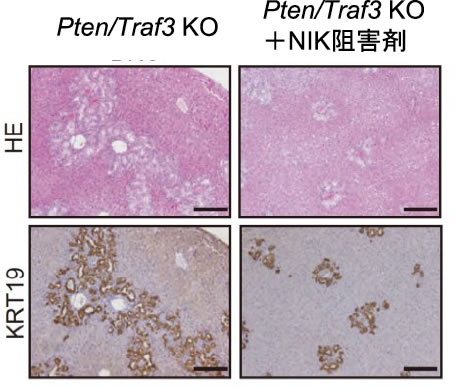
そこで、肝細胞からのICC発症機序の詳細について検討を行った。肝細胞特異的Traf3/Pten欠損マウスを用いて肝内のシングルセルRNAシークエンス解析を実施した結果、増殖胆管細胞は肝細胞と胆管細胞の両マーカーを発現しており、また疑似時系列解析においてこの細胞集団は成熟肝細胞からの分化転換により発生したと考えられた(図4A)。次にin vitroにおいて、ヒト肝がん細胞株(HepG2)のTRAF3とPTENをsiRNAにより抑制した結果、種々の肝細胞マーカーの発現低下、胆管細胞マーカーの発現上昇(図4B)と共に、細胞増殖能の有意な亢進が認められた。この結果から、TRAF3/PTENの抑制は肝細胞から増殖性胆管細胞への分化転換を促進させていると考えられた。この分化転換の表現型はマウス肝オルガノイド由来肝細胞やヒト初代培養肝細胞においても同様に認められた。さらに我々は、この分化転換の責任分子として、非古典的NF-kB経路に関するリン酸化酵素であるNF-kB inducing kinase(NIK、遺伝子名MAP3K14)を同定した。マウス肝オルガノイド、ヒト肝細胞、肝がん細胞株いずれにおいてもTRAF3/PTENの抑制によりMAP3K14の発現が有意に上昇し、阻害剤やsiRNAによりNIKを阻害した結果、上述の分化転換が抑制された。また、肝特異的Traf3/Pten 欠損マウスにおける肝内胆管増生もNIK阻害剤投与により有意に抑制された(図5)。以上より、TRAF3はNIKを負に制御することで肝細胞から胆管細胞への分化転換を抑制していることが明らかとなった。
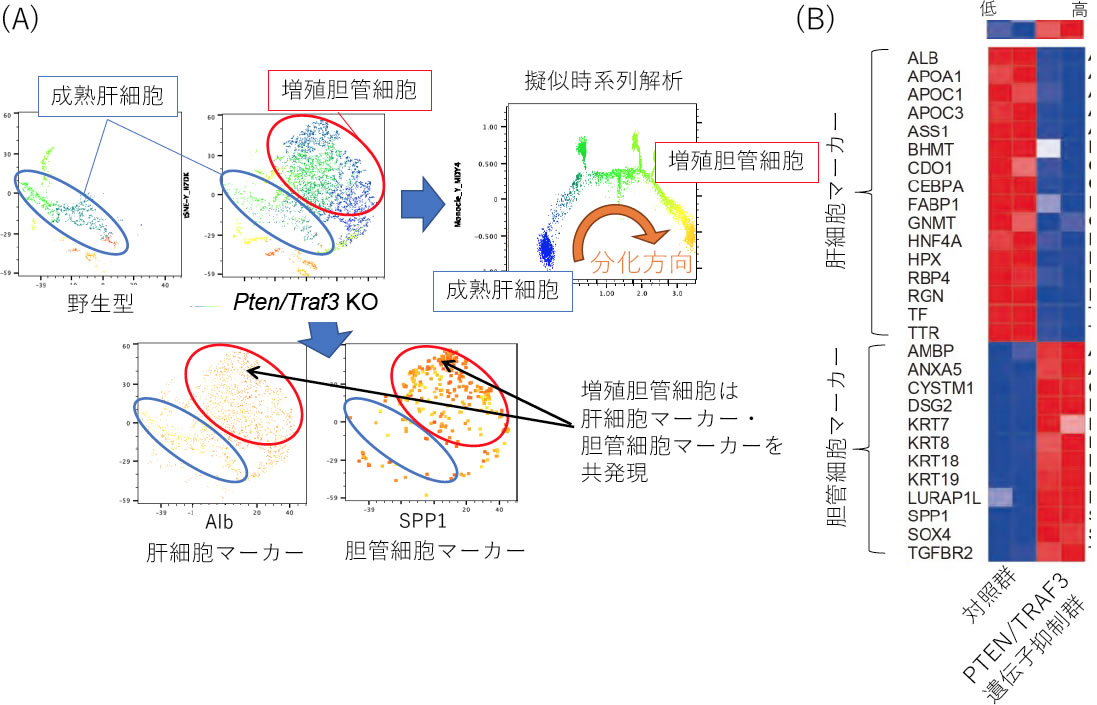
図4.Traf3の⽋損は肝細胞の胆管細胞への分化転換を促進させる
(A)肝細胞特異的Traf3/Pten両⽋損マウスの肝臓におけるシングルセル遺伝⼦発現解析、(B)肝癌細胞株における各種マーカー遺伝⼦発現、⽂献6より改変
TRAF3-NIK経路の制御異常が悪性度の高いICCの発症に寄与している可能性
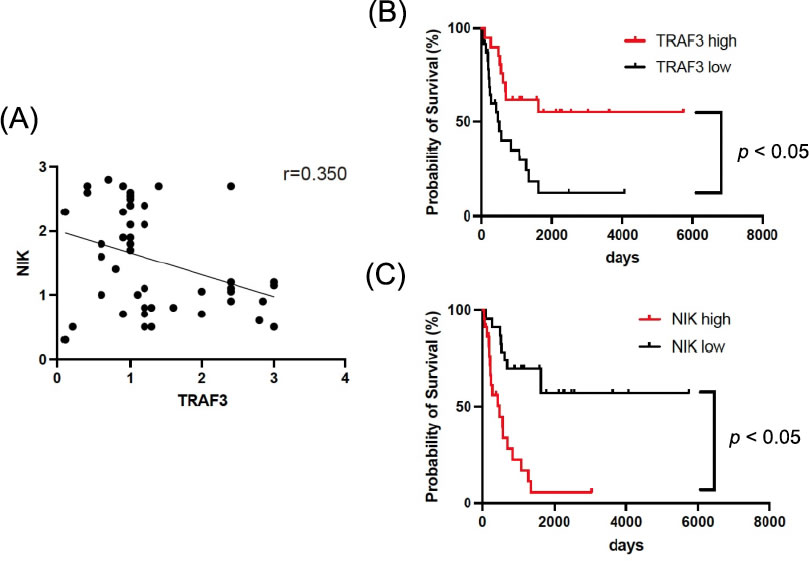
TRAF3-NIK経路と臨床因子との関連を検討するため、外科切除を受けたICC46症例を対象に腫瘍部におけるTRAF3とNIKの発現を免疫染色により検討した。その結果、TRAF3とNIK発現には負の相関が認められ(図6A)、TRAF3低値例またはNIK高値例はより病期が進行し、切除後の無再発生存期間や全生存期間が有意に短縮していた(図6B、C)。以上から、TRAF3-NIK経路の制御異常は悪性度の高いICCの発症に寄与している可能性が示唆された。
図6.TRAF3-NIK経路の制御異常は悪性度の高い肝内胆管がん発症に寄与している可能性
(A)肝内胆管がん46例における腫瘍部TRAF3、NIK蛋白発現の相関、(B)腫瘍部TRAF3発現別生存曲線、(C)腫瘍部NIK発現別生存曲線、文献6より改変
NIKがICCの新たな治療標的となる可能性
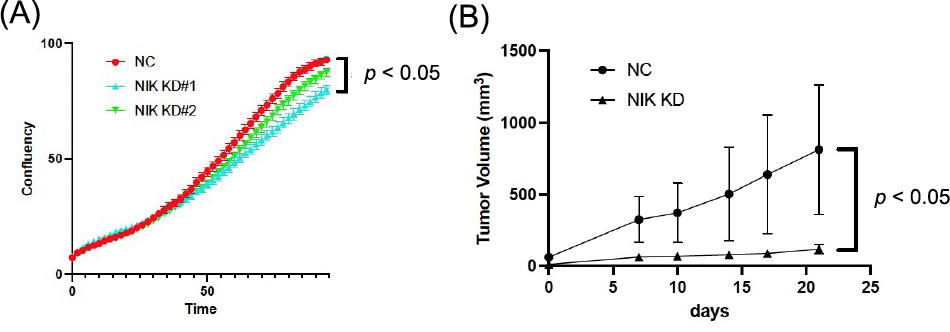
最後に、TRAF3-NIK経路のICC新規治療標的としての可能性を検討した。3種類のヒトICC株を用いて、siRNAや阻害剤によりNIKを抑制した結果、細胞増殖が有意に抑制された(図7A)。そこでヒトICC株(HuCCT1)のゼノグラフトモデルを用いて、shRNAや阻害剤によりNIKを抑制した結果、腫瘍増殖は有意に抑制された(図7B)。以上から、NIKはICCの新たな治療標的となる可能性が示唆された。
図7.NIKが肝内胆管がんの新たな治療標的となる可能性
(A)ヒト肝内胆管がん細胞株(HuCCT1)における細胞増殖曲線(NC:非標的siRNA、NIK KD:NIK siRNA)(B) HuCCT1株のゼノグラフトにおける腫瘍増殖曲線(NC:非標的shRNA、NIK KD:NIK shRNA) 、文献6より改変
おわりに
肝細胞と胆管上皮細胞は発生過程において共に肝芽細胞から枝分かれして分化成熟するが、成体肝臓においては「肝実質組織」と「胆管」という異なる役割を有した組織として機能する。肝細胞はその高次機能のゆえに、最終分化するとその表現型が固定されると長く信じられてきたが、近年成熟肝細胞が胆管上皮細胞へと分化転換する能力を保持していることが動物モデルを用いた細胞系譜解析などにより様々報告され、肝細胞の分化可塑性と肝病態との関連は近年非常に注目を集めている(7-9)。本研究において、新たにTRAF3-NIK経路が肝細胞から胆管細胞への分化転換やICCの発症に重要な役割を果たすことが明らかになった。今後、益々この領域の研究が発展し、肝細胞の可塑性の制御機構や分化異常を介した発癌機構が解明されることで、新たな創薬へと繋がることを期待したい。
参考文献
- Rizvi S, Khan SA, Hallemeier CL, Kelley RK, Gores GJ. Cholangiocarcinoma - evolving concepts and therapeutic strategies. Nat Rev Clin Oncol 2018;15:95-111.
- Kodama T, Bard-Chapeau EA, Newberg JY, Kodama M, Rangel R, Yoshihara K, Ward JM, et al. Two-Step Forward Genetic Screen in Mice Identifies Ral GTPase-Activating Proteins as Suppressors of Hepatocellular Carcinoma. Gastroenterology 2016;151:324-337 e312.
- Kodama T, Newberg JY, Kodama M, Rangel R, Yoshihara K, Tien JC, Parsons PH, et al. Transposon mutagenesis identifies genes and cellular processes driving epithelial-mesenchymal transition in hepatocellular carcinoma. Proc Natl Acad Sci U S A 2016;113:E3384-3393.
- Kodama T, Yi J, Newberg JY, Tien JC, Wu H, Finegold MJ, Kodama M, et al. Molecular profiling of nonalcoholic fatty liver disease-associated hepatocellular carcinoma using SB transposon mutagenesis. Proc Natl Acad Sci U S A 2018;115:E10417-E10426.
- Mann KM, Newberg JY, Black MA, Jones DJ, Amaya-Manzanares F, Guzman-Rojas L, Kodama T, et al. Analyzing tumor heterogeneity and driver genes in single myeloid leukemia cells with SBCapSeq. Nat Biotechnol 2016;34:962-972.
- Shiode Y, Kodama T, Shigeno S, Murai K, Tanaka S, Newberg JY, Kondo J, et al. TNF receptor-related factor 3 inactivation promotes the development of intrahepatic cholangiocarcinoma through NF-kappaB-inducing kinase-mediated hepatocyte transdifferentiation. Hepatology 2022. in press, doi: 10.1002/hep.32317
- Wang J, Dong M, Xu Z, Song X, Zhang S, Qiao Y, Che L, et al. Notch2 controls hepatocyte-derived cholangiocarcinoma formation in mice. Oncogene 2018;37:3229-3242.
- Yimlamai D, Christodoulou C, Galli GG, Yanger K, Pepe-Mooney B, Gurung B, Shrestha K, et al. Hippo pathway activity influences liver cell fate. Cell 2014;157:1324-1338.
- Schaub JR, Huppert KA, Kurial SNT, Hsu BY, Cast AE, Donnelly B, Karns RA, et al. De novo formation of the biliary system by TGFbeta-mediated hepatocyte transdifferentiation. Nature 2018;557:247-251.