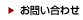研究交流
B型肝炎ウイルス培養系の確立と展望
村上周子1、田中靖人1,2
1. 名古屋市立大学大学院医学研究科 病態医科学講座 ウイルス学分野
2. 熊本大学大学院生命科学研究部 生体機能病態学分野 消化器内科学講座
1.はじめに
B型肝炎ウイルス(Hepatitis B Virus:HBV)が発見されてから半世紀が経過した現在もなお、全世界で約2億4千万人、わが国で約150万人の感染者がいると推定されている。近年、ウイルス排除を最終ゴールとするHBV感染症新規治療薬、特にウイルスの増殖に直接作用する分子標的薬の開発が精力的に行われている。しかし実験室でHBVが再感染できる長期持続感染を培養系で再現することは難しく、新薬開発の妨げになっていた。これまでにHBVの感染効率を上げるため細胞を3次元立体培養する試みや、ヒト肝細胞置換キメラマウスの肝臓より単離したヒト成熟肝細胞を用いたHBV培養系の構築がなされてきた。そして遂に、2012年にHBVが肝細胞に侵入し感染を成立させるための受容体ナトリウム-タウロコール酸共役輸送分子NTCP(Na+ Taurocholate Co-transporting Polypeptide)が発見され、その受容体を人為的に発現させた培養細胞を用いてHBVの増殖サイクルを簡便に解析できる技術が開発された。これらの技術によりHBVの感染成立過程、複製メカニズムの研究が進展するとともに、大量の抗ウイルス薬候補を簡便に評価することが可能となった。本稿では、これらHBV培養系について紹介する。
2.HBVの複製と生活環(図1)
HBVは3.2 kbpの不完全2本鎖DNAを持つウイルスで、そのゲノムはヌクレオキャプシドに格納され、さらに外側をエンベローブが取り囲んでいる。肝細胞へHBVが侵入するとまずエンベロープからヌクレオキャプシドが放出され、核へ移行する。核に入ったHBVゲノムは宿主細胞のさまざまな酵素によりcccDNAに変換される。このcccDNAは子孫ウイルスのゲノムやタンパクを生成するために必須な鋳型であるが、一度形成されたcccDNAはきわめて安定であり感染肝細胞の核内に長期間存在し続ける。近年、HBV既往感染者をドナーとする肝移植や、既往感染者に対する免疫抑制剤、抗がん剤治療の際、肝臓内にわずかに残存するcccDNAからHBVが再活性化し重篤な肝炎を発症する例が問題となっている。つまりB型肝炎の根治とは、このcccDNAを排除することを意味する(1, 2)。
3.B型肝炎創薬研究における培養系の重要性
新たなB型肝炎治療薬の探索には、HBVの培養系は欠かせないツールである。HBVは種特異性が高いためにヒト以外ではチンパンジーなどの霊長類でしか感染感受性が認められず、倫理面・コスト面の双方においてHBV培養系の確立が求められていた。しかし長い間、HBVを効率的に感染させる細胞株はなく、HBVの受容体も同定されず、培養系の確立は解明するべき多くの謎によって阻まれてきた。唯一、ウイルス発現コンストラクトを作製し、Huh-7細胞やHepG2細胞といった肝癌細胞株にトランスフェクトを行うHBVの一時的な培養は可能であった。これまで我々はトランスフェクションの手法を駆使して世界中にあるHBVの各遺伝子型と変異株のウイルスを培養し、薬剤の抗ウイルス効果や薬剤耐性変異の検証を行ってきた(3-6)。この手法は、新規のウイルス変異の再現や、ウイルス粒子を大量に得ることが可能であり、今日の研究においても非常に有用である。その一方でトランスフェクションによる培養系はHBVの生活環を再現するものではなく、肝細胞株は形態変化を示さず、長期培養も難しいため、ウイルスが自然に近い形で細胞に感染し、さらに複製されたウイルスが再感染を繰り返す持続感染を再現する培養系の確立は課題とされてきた。
2012年(平成24年)より、B型肝炎創薬研究事業が始まった。この研究事業を成功させるにはHBV培養系がカギであった。研究の推進に重要となる培養系は、2つに大別できた。1つは、創薬研究として新規薬剤を探索するための薬剤スクリーニングに適したHBV培養系である。そしてもう1つは、先述したHBVの生活環を再現する長期持続感染培養系で、ウイルスの肝細胞への侵入経路や急性、慢性感染などの病態を解析し、治療法を探索するものである。
HBV複製を再現する細胞株として、肝癌細胞株にHBVゲノムを組み込んだHepG2.2.15細胞やHepAD38細胞が知られている。国立感染症研究所の渡士らは、これらの細胞株からHBV-DNA産生が高く薬剤感受性が高いHepG2.2.15.7細胞およびHepAD38.7-Tet細胞のクローニングに成功した(7, 8)。これにより、96 well plateや384 well plateを用いて抗HBV製剤の候補化合物をスクリーニングできるハイスループットな培養系が確立された。また、HBVを恒常的に産生しているHepG2.2.15.7細胞の培養上清に含まれるウイルス粒子は、培養実験の感染源に用いたり、ウイルスゲノムの解析に使用したりと非常に応用範囲が広く、多くの研究者に重用されている。
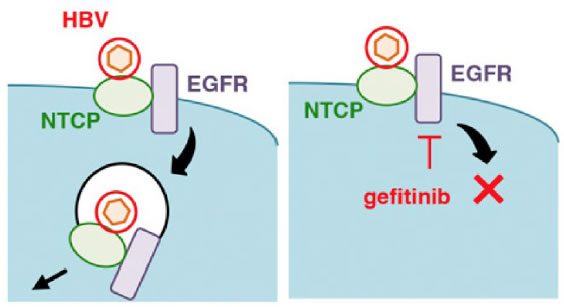
HBVが肝細胞へ侵入する受容体は長い間不明であったが、2012年Yanらにより肝細胞表面に発現しているNTCPが細胞への侵入時にHBVが利用するレセプターであることを報告した(9)。この報告を受け、多くの研究者によりNTCPを強制発現させた細胞株が樹立された。岩本、渡士らにより樹立されたHepG2細胞にNTCPを発現させたHBV感染許容性細胞株HepG2-hNTCP-C4細胞は、HBVの侵入、複製、放出、再感染のサイクルを再現した。この細胞株を用いたHBV感染培養系により、HBV増殖サイクルの各ステップを阻止する治療薬候補のスクリーニングが可能となった(10)。特にHBVの侵入を阻害する分子が複数同定されている。また岩本らは、NTCPと上皮成長因子受容体(EGFR)の複合体がNTCPに結合したHBVの細胞内侵入を媒介することを明らかにした。EGFRを欠損させた細胞ではNTCPと結合したHBVが細胞内へと侵入することができず細胞表面に留まること、EGFR阻害剤によりHBVが細胞内へ侵入できず感染が防御されることを明らかにしている(11, 12)(図2)。これらの細胞株の樹立によりB型肝炎の研究は大きく加速することとなった。
4.ヒト肝細胞置換キメラマウス由来の初代ヒト肝細胞によるHBV培養系
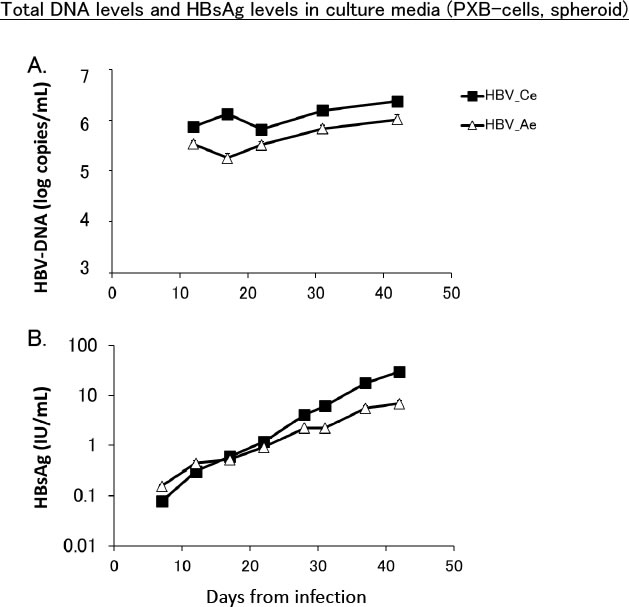
ヒト肝細胞置換キメラマウスは、ヒト肝炎ウイルス感染モデル動物として今日では一般に周知されているが(13)、さらにこのキメラマウス肝臓からコラゲナーゼ灌流により分離した初代新鮮ヒト肝細胞は長期培養が可能である(PXB-cells; 株式会社フェニックスバイオ)。石田、立野らはキメラマウス由来の肝細胞を3次元培養や、培養プレートへ隙間なく高密度に播いた平面培養において長期間の培養が可能であり、感染源としてHBV感染キメラマウス血清を用いた感染実験でHBVが感染しウイルスが複製されること、さらに抗HBsヒト免疫グロブリン(HBIG)により細胞間の感染拡大はブロックされHBVが細胞間で水平感染することを見出した(14)(図3)。このPXB-cellsを用いて、我々はHBV genotype AとCの異なる遺伝子型のウイルスが感染すること、B型肝炎患者の血清を感染源としても感染が成立することを確認した(15)。PXB-cellsは96 wellや384 well plateによる培養でも安定しており、初代肝細胞による治療薬候補の薬効および安全性スクリーニングにも利用できる。さらには、B型肝炎患者の血清を感染として、有効な治療薬・治療法を探索する個別化治療への展開も期待される。
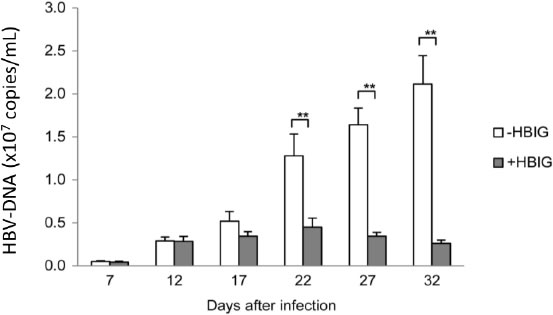
図3. PXB-cells単層培養によるHBV培養系
ヒト肝細胞キメラマウスの肝臓より単離した初代ヒト肝細胞(PXB-cells)によるHBV培養実験。単層培養でHBVの複製が認められた。長期培養も可能である(文献14; Ishida et al. 2015より転載)。
5.肝細胞の3次元培養系
培養細胞の性質は平面培養と3次元培養で異なることが知られており、肝細胞は立体構造をとることでアルブミン産生の促進や微小管形成が見られ、肝組織に近い環境となることが報告されている(16-18)。3次元培養には、増殖の足場となるプレート底部の特殊コーティングや足場のインサート、ゲル状の培地による3次元化、中空糸の内腔に充填して立体化するなど種々の手法がある。肝細胞の3次元培養は、実験室で肝組織に近い環境を再現したHBV感染モデルとなることが期待された。我々は中空糸モジュールに細胞を充填し立体化する方法と(18)、特殊なナノレベルの加工を底面に施した培養プレートでスフェロイドと呼ばれる細胞塊を形成する方法を用いて(19, 20)、HBV持続感染を試みた(図4)。
肝細胞株としては、不死化ヒト正常肝細胞株のHuS-E/2細胞を用いた。京都大学の土方らによって樹立されたHuS-E/2細胞は緩やかに増殖し、長期間の3次元培養に適している(21)(断面、図5)。一般的なHepG2細胞のように増殖が活発な細胞株では、3次元構造を形成した状態でも増殖速度が抑制されることはなく培養が長期間になると細胞が中空糸から溢れることや、スフェロイド形成を維持できず平面化してしまう問題があり、3次元培養には不向きであった。また、初代肝細胞としてPXB-cellsでも同様の検討を行った。これらの細胞を、中空糸に充填またはスフェロイド形成をすることにより3次元構造を構築し、HBV感染源を105 copies/wellとなるように培地に添加して細胞とウイルスを接触させた。感染源にはHBV感染キメラマウス血清とB型肝炎患者の血清を用いた。培養上清中のHBV-DNAおよびHBs抗原、細胞内のHBV core関連抗原を測定し、HBVの感染・複製を確認した。
中空糸による培養系(TESTLIVER™-Human-; TOYOBO)では約1ヶ月間の長期培養が可能であった(18)(図6)。アルブミンの産生も認められ、肝組織に近い環境が再現できた。また、中空糸に充填したHuS-E/2細胞にHBVを含む血清を接触させた培養上清をヒト肝細胞キメラマウスに接種したところHBV感染が成立し、細胞株においても3次元培養により感染性のあるウイルス粒子を複製することが確認できた。
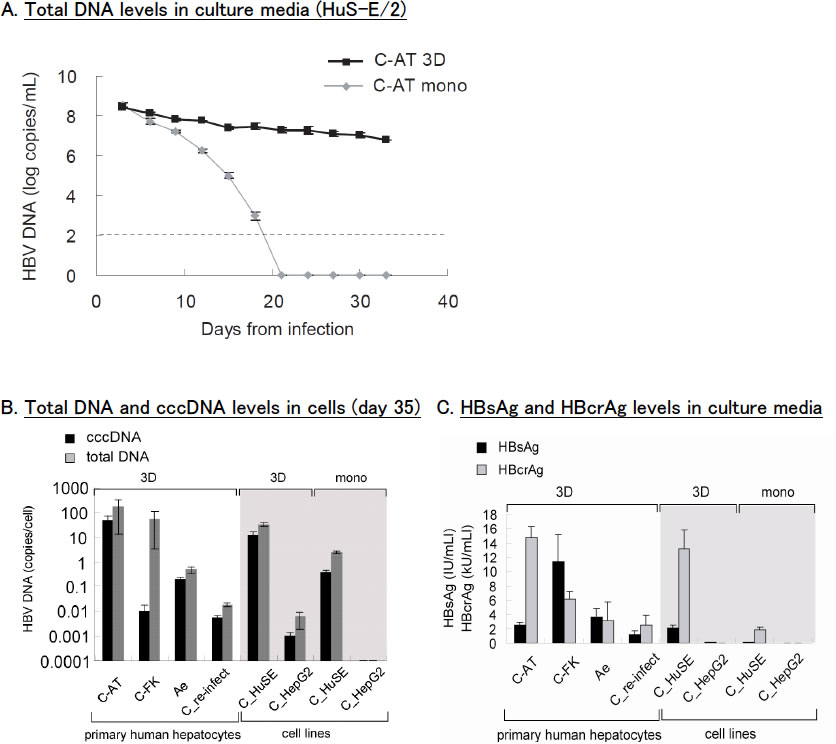
図6. 中空糸によるHBV培養系(TESTLIVER™-Human-; TOYOBO)
中空糸内に肝細胞を充填した3次元培養により、約1ヶ月間の長期培養が可能。
(A)HuS-E/2細胞によるHBV培養実験。単層と3次元で培養し、培養上清中のHBV-DNA量を測定した(C-AT: HBV genotype C)。
(B)(C)初代ヒト肝細胞と肝細胞株によるHBV培養実験。(B)HBV-DNAおよびcccDNA、(C)HBs抗原およびHBコア関連抗原。
スフェロイド培養系には細胞アレイ三次元培養システムのCell-able®(東洋合成工業株式会社)を用い、2週間〜1ヶ月間安定して3次元環境が維持された。HBV感染源を培地に添加した感染実験では、培養上清中にHBV-DNAやHBs抗原、細胞内と上清中にHBV core関連抗原が検出された。上清中のHBV-DNA量が培養期間を通じて104-106 copies/mLで継続的に検出され、少なくとも1ヶ月間は培養の継続が可能であった。特にPXB-cellsをスフェロイド化した培養系では、HBs抗原量の経時的な増加を認めた(22)(図7)。
HuS-E/2細胞は正常肝細胞株であり安定した条件下での検討ができ、初代新鮮肝細胞であるPXB-cellsはより生体に近い状態を再現していると考えられる。3次元培養系による長期培養は、肝炎ウイルス感染実験のみならず、他の慢性肝疾患や肝臓の機能解析など今後の活用が期待される。
6.新薬の開発
現在承認されている核酸アナログ型逆転写酵素阻害剤やPEG-IFNαを用いた治療のみでHBVを排除できる率は依然として低い。精力的な基礎研究によりHBVの複製機構およびHBV排除における宿主免疫系の役割が明らかとなり、既存薬とは異なるプロセスを標的とした新規抗HBV治療薬の開発が世界的に進んでいる。図1に示すようにウイルス自体を標的としたDirect-acting antiviral agents(DAAs)と免疫を含む宿主因子を標的としたHost-targeting antiviral agents(HTAs)の2つのストラテジーがあり、HBV感染症治癒の究極的目標である肝細胞内の残存cccDNAの排除を目指している。Direct-acting antiviral agents(DAAs):ウイルスを標的とした治療法として、①HBV侵入阻害剤(Myrcludex-B, Vanitaracin Aなど)、②cccDNA標的薬、③ウイルスRNA阻害薬(JNJ-3989, ARB-1467, GSK836/404など)、④キャプシド(コア蛋白)集合阻害薬(GLS4, RG-7907, JNJ-6379など)、⑤強力な新規逆転写酵素阻害薬(CFCPなど)、⑥HBs抗原分泌阻害薬(Rep2139, Rep2165)などが開発中であり、我々もHBV感染培養系を用いて、HBV RNA を不安定化する化合物を同定し、前臨床試験を進めている。また、Host-targeting antiviral agents(HTAs):宿主因子を標的とした治療法として、①免疫修飾物質(免疫チェックポイント阻害剤, TLR7/8アゴニスト, RIG-I/NOD2アゴニストなど)、②治療ワクチン(Therapeutic vaccination)などが開発中である。
おわりに
B型肝炎を実験室で再現するHBV持続感染培養系の確立とHBVレセプターの探索は、長らく研究の進行を阻む高い壁であった。現在はその壁がクリアされ、HBVのレセプターとウイルスのエントリー機構は次々と明らかになり、HBV培養系は目的に合わせて選択できるほど多様な細胞と手法が開発されている。これは世界中の研究者たちによる日々の研鑽の成果に他ならない。2016年に世界保健機関(WHO)が掲げた2030年までにウイルス性肝炎の根絶を目指す目標を達成する上でHBV培養系は大いに貢献するであろう。
謝辞
本稿における研究は、厚生労働科学研究費補助金および日本医療研究開発機構 肝炎等克服緊急対策研究事業、B型肝炎創薬実用化等研究事業を中心に行われました。共同研究者の皆様に御礼申し上げます。また多くのサポートスタッフの方々にも深く感謝いたします。最後に研究紹介の機会をご提供いただきました本研究会の役員各位に御礼申し上げます。
引用文献
- 飯島沙幸, 田中靖人. B型肝炎ウイルス(HBV)のリバースジェネティックス. ウイルス. 2013;63(1):23-32.
- 堤進, 新海登, 田中靖人. B型肝炎創薬研究の最前線. 肝臓. 2017;58(4):217-27.
- Orito E, Ichida T, Sakugawa H, Sata M, Horiike N, Hino K, et al. Geographic distribution of hepatitis B virus (HBV) genotype in patients with chronic HBV infection in Japan. Hepatology. 2001;34(3):590-4.
- Sugauchi F, Orito E, Ichida T, Kato H, Sakugawa H, Kakumu S, et al. Hepatitis B virus of genotype B with or without recombination with genotype C over the precore region plus the core gene. J Virol. 2002;76(12):5985-92.
- Sugiyama M, Tanaka Y, Kato T, Orito E, Ito K, Acharya SK, et al. Influence of hepatitis B virus genotypes on the intra- and extracellular expression of viral DNA and antigens. Hepatology. 2006;44(4):915-24.
- Hayashi S, Khan A, Simons BC, Homan C, Matsui T, Ogawa K, et al. An Association Between Core Mutations in Hepatitis B Virus Genotype F1b and Hepatocellular Carcinoma in Alaskan Native People. Hepatology. 2019;69(1):19-33.
- Watashi K, Sluder A, Daito T, Matsunaga S, Ryo A, Nagamori S, et al. Cyclosporin A and its analogs inhibit hepatitis B virus entry into cultured hepatocytes through targeting a membrane transporter, sodium taurocholate cotransporting polypeptide (NTCP). Hepatology. 2014;59(5):1726-37.
- Iwamoto M, Cai D, Sugiyama M, Suzuki R, Aizaki H, Ryo A, et al. Functional association of cellular microtubules with viral capsid assembly supports efficient hepatitis B virus replication. Sci Rep. 2017;7(1):10620.
- Yan H, Zhong G, Xu G, He W, Jing Z, Gao Z, et al. Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus. Elife. 2012;3.
- Iwamoto M, Watashi K, Tsukuda S, Aly HH, Fukasawa M, Fujimoto A, et al. Evaluation and identification of hepatitis B virus entry inhibitors using HepG2 cells overexpressing a membrane transporter NTCP. Biochem Biophys Res Commun. 2014;443(3):808-13.
- Iwamoto M, Saso W, Sugiyama R, Ishii K, Ohki M, Nagamori S, et al. Epidermal growth factor receptor is a host-entry cofactor triggering hepatitis B virus internalization. Proc Natl Acad Sci U S A. 2019;116(17):8487-92.
- Iwamoto M, Saso W, Nishioka K, Ohashi H, Sugiyama R, Ryo A, et al. The machinery for endocytosis of epidermal growth factor receptor coordinates the transport of incoming hepatitis B virus to the endosomal network. J Biol Chem. 2020;295(3):800-7.
- Tateno C, Yoshizane Y, Saito N, Kataoka M, Utoh R, Yamasaki C, et al. Near completely humanized liver in mice shows human-type metabolic responses to drugs. Am J Pathol. 2004;165(3):901-12.
- Ishida Y, Yamasaki C, Yanagi A, Yoshizane Y, Fujikawa K, Watashi K, et al. Novel robust in vitro hepatitis B virus infection model using fresh human hepatocytes isolated from humanized mice. Am J Pathol. 2015;185(5):1275-85.
- Hamada-Tsutsumi S, Iio E, Watanabe T, Murakami S, Isogawa M, Iijima S, et al. Validation of cross-genotype neutralization by hepatitis B virus-specific monoclonal antibodies by in vitro and in vivo infection. PLoS One. 2015;10(2):e0118062.
- Funatsu K, Ijima H, Nakazawa K, Yamashita Y, Shimada M, Sugimachi K. Hybrid artificial liver using hepatocyte organoid culture. Artif Organs. 2001;25(3):194-200.
- Funatsu K, Nakazawa K. Novel hybrid artificial liver using hepatocyte organoids. Int J Artif Organs. 2002;25(2):77-82.
- Fukuda J, Mizumoto H, Nakazawa K, Kajiwara T, Funatsu K. Hepatocyte organoid culture in elliptic hollow fibers to develop a hybrid artificial liver. Int J Artif Organs. 2004;27(12):1091-9.
- Otsuka H, Hirano A, Nagasaki Y, Okano T, Horiike Y, Kataoka K. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 2004;5(6):850-5.
- Ikeda Y, Jomura T, Horiuchi U, Saeki J, Yoshimoto K, Ikeya T, et al. Long-term survival and functional maintenance of hepatocytes by using a microfabricated cell array. Colloids Surf B Biointerfaces. 2012;97:97-100.
- Aly HH, Qi Y, Atsuzawa K, Usuda N, Takada Y, Mizokami M, et al. Strain-dependent viral dynamics and virus-cell interactions in a novel in vitro system supporting the life cycle of blood-borne hepatitis C virus. Hepatology. 2009;50(3):689-96.
- Murakami S, Watanabe T, Omagari K, Inoue T, Iijima S, Hamada-Tsutsumi S, et al. A novel three-dimensional long-term culture system of primary human hepatocytes isolated from chimeric mice with humanized liver for hepatitis B virus infection. International HBV Meeting on The Molecular Biology of Hepatitis B Viruses; Shanghai: Hepatitis B Foundation; 2013.