研究交流
薬物性肝障害誘発リスクの予測を可能とするin vitro評価系の構築
竹村 晃典、伊藤 晃成
千葉大学大学院 薬学研究院 生物薬剤学研究室
1. はじめに
薬物性肝障害(drug-induced liver injury; DILI)は新薬開発時の中断ならびに上市後の市場撤退の主要因として知られているため(1)、DILIリスクを適切に予測することは重要である。肝障害に至るメカニズムとして様々な報告がなされているが、このうち反応性代謝物、胆汁酸排泄トランスポーター(bile salt export pump; BSEP)阻害能およびミトコンドリア毒性を指標とし、これらの組み合わせによって比較的高い精度でDILIリスク予測が行えることが示されている(2-4)。しかしながら、その評価法には一部問題がある。例えばBSEP阻害能の評価としては細胞膜ベシクルを用いた評価がなされている。これは簡便に評価できる上では有用なツールであるが、非細胞系であるため薬物代謝の影響は含まれていない。実際にこれまでに、フルタミドやトルバプタンはcytochrome P450で代謝を受けることでBSEP阻害能が変化することが知られている(5,6)。このような問題点を解決するため、我々はこれまでに細胞ベースのin vitro毒性評価系を構築してきた。本稿では各評価法のコンセプト、およびそれらを用いた薬物のDILIリスク予測への応用(7)について紹介する。
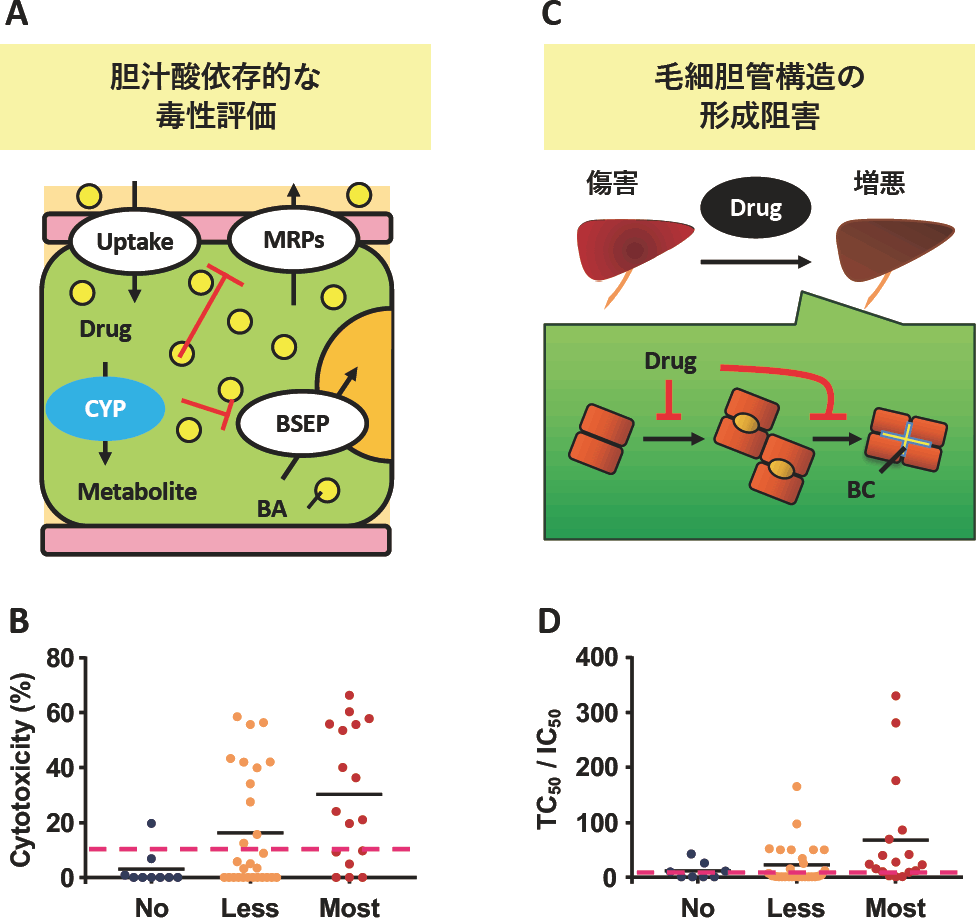
2. 胆汁うっ滞に関わる毒性評価法の構築(図1)
胆汁うっ滞型DILIの主たる要因として、薬物がBSEPを阻害し肝細胞内に胆汁酸を蓄積することが挙げられる。このような環境をin vitroにて模倣し、胆汁酸依存的な毒性評価系の構築を行った。評価系の構築にあたり、肝細胞をコラーゲンやマトリゲルなどの細胞外マトリクスで挟んで培養する手法(サンドイッチ培養法)を用いた。これにより、従来法では培養とともに発現が低下する薬物代謝酵素活性やトランスポーターを介した方向性輸送を維持することができる(8)。また、in vitroで培養した際には胆汁酸の総量が非常に微量である。そのため、BSEP阻害能を有する薬物を肝細胞に曝露しても毒性に至る量の胆汁酸が肝細胞内に蓄積されない。そこで、至適な量の胆汁酸を外部から添加することにより初めて薬物による胆汁酸依存的な毒性を検出可能とした(9、図1A)。実際にサンドイッチ培養した凍結ヒト肝細胞に対して、米国食品医薬品局がDILIリスクの重篤度別に3分類(Most, Less, No concern)したLiver Toxicity Knowledge Base(LTKB, https://www.fda.gov/science-research/bioinformatics-tools/liver-toxicity-knowledge-base-ltkb)中に記載がある53薬物を評価したところ、25薬物で胆汁酸依存的な毒性が見られ、特にDILIリスクが高い薬物群において多く検出された(図1B)。
胆汁うっ滞の要因として、薬物によるトランスポーター阻害に加え、その発現の場である毛細胆管構造の形成・維持に対する影響もあり得る(10)。そこで我々はまず、サンドイッチ培養ラット肝細胞の培養初期(2-3日目)に薬物を曝露し、毛細胆管構造の形成・伸長に対する阻害を評価する系を考案した(図1C)。種々薬物についてこの阻害を調べたところ、特に重症度の高いDILIリスク薬物において阻害が強い傾向を認めた(11)。この手法をサンドイッチ培養したHepG2細胞に適用し、毛細胆管形成阻害のIC50値と直接的な細胞毒性(TC50値)の比を算出したところ、ここでもDILIリスクが高い薬物群を中心に強い毛細胆管形成の抑制を認めた(図1D)。
| A. | 胆汁酸依存的な毒性評価法のコンセプト。サンドイッチ培養した肝細胞に薬物のみを添加しても、細胞内の胆汁酸量は極微量のため、それによる毒性発現が見えない。そこで、至適な胆汁酸と薬物を併用することで、細胞内に胆汁酸が蓄積し、毒性発現に至る。BA, bile acid; CYP, cytochrome P450; BSEP, bile salt export pump;MRP, multidrug resistance-associated protein |
| B. | サンドイッチ培養した凍結ヒト肝細胞にて胆汁酸と薬物(53種)を評価した。DILIリスク分類はLiver Toxicity Knowledge Base(LTKB)に従った。実線は平均値を示し、点線はROC解析により得られた閾値を示す。 |
| C. | 毛細胆管形成の抑制の評価コンセプト。胆汁排泄の起点となる毛細胆管構造を薬物が阻害することで、胆汁うっ滞に関わると仮説だてた。BC: bile canalicular |
| D. | サンドイッチ培養したHepG2に薬物を濃度依存的に曝露し、毛細胆管形成抑制のIC50と、細胞毒性のTC50の比を算出しプロットした。 |
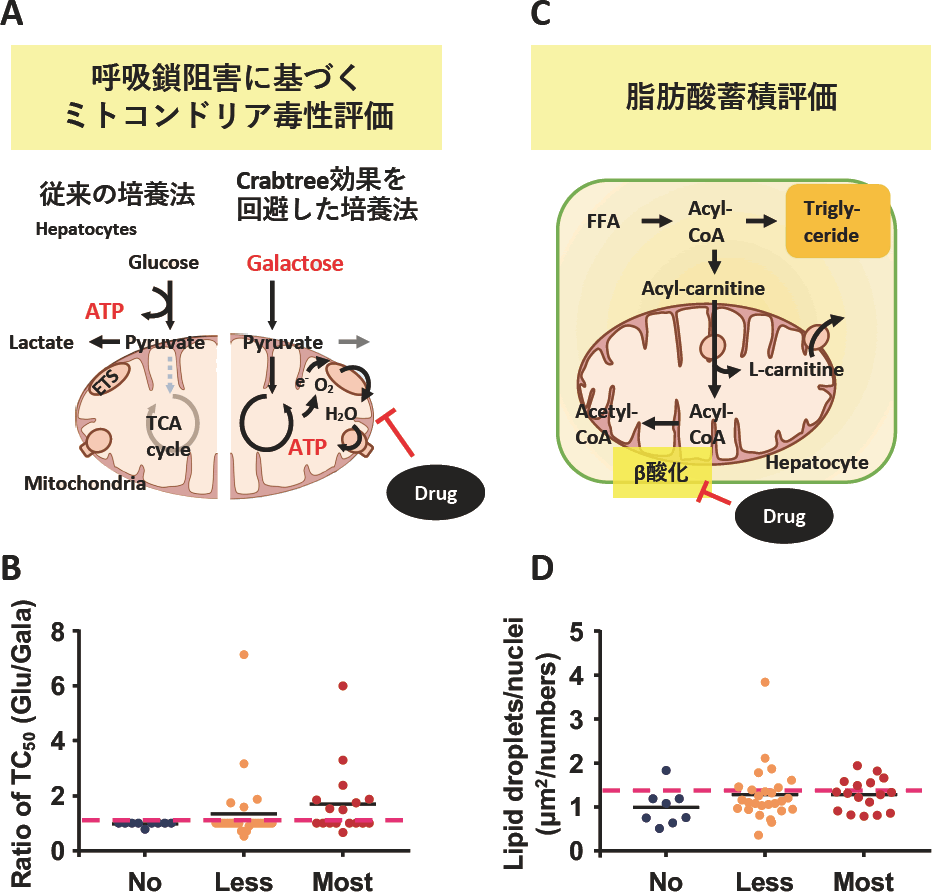
3. ミトコンドリア障害に関わる毒性評価法の構築(図2)
DILIリスク予測に重要なファクターであるミトコンドリア毒性を捉えられる細胞評価系も構築してきた。通常培養下では肝細胞の持つ高い酸素要求性に見合った酸素供給ができておらず、結果としてin vitro評価に用いる肝細胞はそのエネルギー産生の大部分を解糖系に依存する(12、Crabtree効果)。このことはin vitroにおけるミトコンドリア毒性の過小評価として問題となる。そこで、培養液中の糖源をグルコースからガラクトースに置換することでCrabtree効果を回避し、ここに被験薬物を曝露することで主に呼吸鎖阻害によるミトコンドリア毒性を鋭敏に検出可能とする系を構築してきた(13,14、図2A)。実際に、HepG2細胞をグルコース培地およびガラクトース培地条件下で培養し、各条件での細胞毒性のTC50値の比からミトコンドリア毒性の有無を表した結果を図2Bに示す。その他に、ミトコンドリア毒性の指標として脂質蓄積がある。これの評価においても先と同様に、Crabtree効果を回避したHepG2細胞にて脂肪酸と薬物を共曝露し、細胞内に残存する脂肪酸を蛍光物質であるBODIPYにて評価する方法を構築した(図2CおよびD)。
| A. | ミトコンドリア毒性(主に呼吸鎖阻害)の毒性評価法のコンセプト。従来の培養条件(グルコース培地)では細胞内のエネルギー代謝が解糖系にシフトしてしまうが、ガラクトース培地にて培養することで酸化的リン酸化を介したエネルギー代謝にシフトし、ミトコンドリア機能の賦活化が見られる。 |
| B. | HepG2細胞をグルコース/ガラクトース培地で培養し、各条件でのTC50値の比を評価した。 |
| C. | 脂肪酸蓄積の評価コンセプト。ガラクトース培地で培養した細胞にFFA(遊離脂肪酸)と薬物を併用し、細胞内に残存する脂肪滴をBODIPYで評価した。 |
| D. | ガラクトース培地で培養したHepG2に薬物を濃度依存的に曝露し、直接的な細胞毒性が認められない最高濃度における蛍光値を算出し、視野内に存在した核数(Hoechst33342で染色)で除した値をプロットした。 |
4. 当研究室で構築した肝毒性予測法を組み合わせたDILIリスク予測(7)
上述のようにDILIリスク評価系をいくつか構築してきたが、冒頭でも述べたようにDILIリスク予測にはこれら評価結果の組み合わせが有効である。そこで、得られた結果を統合することでDILIリスク予測がどの程度可能かについて検証した。各評価系にて陽性・陰性となる閾値を決め、加点法にて臨床でのDILIリスクの予測能を評価したところ、その正確度は48.1%であった(図3A)。組み合わせ評価の有用性は一定程度認められたが、十分ではなかったため、さらなる予測能向上のためディープラーニングの1種である人工ニューラルネットワーク(ANN)解析を行った。ANNは、入力層、中間層、出力層の3層で構成され、入力層に予測に必要な説明変数(この場合はin vitro試験データ)を入力し、出力層に予測したい目的変数(この場合は臨床でのDILIリスク)を提示させると、ANNが説明変数と目的変数との関係性を学習しながら、各説明変数に適切な重みづけを設定する。最終的に本手法で得られたDILIリスク予測モデルの正確度は62.3%で、先の加点法から向上した(図3B)。
| A. | 加点法における予測能評価。各評価系で得られた結果をROC解析を行い、しきい値を算出した。陽性と判断された場合を1 pointとし、合計点をin vitro scoreとした。この値から臨床におけるDILIリスクを予測したところ、正確度(accuracy)は48.1%と判定された。 |
| B. | 人工ニューラルネットワーク(ANN)解析における予測能評価。入力層(input layer)に各試験系の評価結果を入力し、出力層(output layer)に臨床におけるDILIリスクを設定したところ、accuracyは62.3%と判定された。 |
4. おわりに
医薬品開発現場における活用という観点では、現時点でのDILIリスク予測精度は未だ不十分である。予測精度の改善には、1)DILI発症・増悪のメカニズムの理解、2)各メカニズムに対応する適切なin vitro評価系の構築、3)評価に用いる細胞の最適化、に向けた取り組みがさらに必要である。例えば、現在は凍結ヒト初代肝細胞がゴールデンスタンダードとして各種評価に用いられている。しかし、一部の評価では凍結による細胞機能の低下や、細胞ロットの違いが予測精度に与える影響が問題となる。これについては、iPS細胞から作製した高機能な肝細胞が代替として利用できる可能性があるだろう。上述した取り組みを継続することで予測精度がさらに向上し、医薬品開発現場におけるGo/No-Goの判断に使えるほどのレベルに到達することを期待している。
5. 謝辞
本研究では当研究室に在籍された旧スタッフ・卒業生の皆様によって行われました。共同研究者の皆様にお礼を申し上げます。
6. 引用文献
- Watkins PB. Drug safety sciences and the bottleneck in drug development. Clin Pharmacol Ther 2011;89(6):788-790.
- Schadt S, Simon S, Kustermann S, et al. Minimizing DILI risk in drug discovery - A screening tool for drug candidates. Toxicol In Vitro 2015;30(1 Pt B):429-437.
- Williams DP, Lazic SE, Foster AJ, et al. Predicting Drug-Induced Liver Injury with Bayesian Machine Learning. Chem Res Toxicol 2020;33(1):239-248.
- Aleo MD, Shah F, Allen S, et al. Moving beyond Binary Predictions of Human Drug-Induced Liver Injury (DILI) toward Contrasting Relative Risk Potential. Chem Res Toxicol 2020;33(1):223-238.
- Iwanaga T, Nakakariya M, Yabuuchi H, et al. Involvement of bile salt export pump in flutamide-induced cholestatic hepatitis. Biol Pharm Bull 2007;30(4):739-744.
- Slizgi JR, Lu Y, Brouwer KR, et al. Inhibition of Human Hepatic Bile Acid Transporters by Tolvaptan and Metabolites: Contributing Factors to Drug-Induced Liver Injury? Toxicol Sci 2016;149(1):237-250.
- Kawaguchi M, Nukaga T, Sekine S, et al. Mechanism-based integrated assay systems for the prediction of drug-induced liver injury. Toxicol Appl Pharmacol 2020;394:114958.
- Swift B, Pfeifer ND, Brouwer KL. Sandwich-cultured hepatocytes: an in vitro model to evaluate hepatobiliary transporter-based drug interactions and hepatotoxicity. Drug Metab Rev 2010;42(3):446-471.
- Susukida T, Sekine S, Nozaki M, et al. Prediction of the Clinical Risk of Drug-Induced Cholestatic Liver Injury Using an In Vitro Sandwich Cultured Hepatocyte Assay. Drug Metab Dispos 2015;43(11):1760-1768.
- Gissen P, Arias IM. Structural and functional hepatocyte polarity and liver disease. J Hepatol 2015;63(4):1023-1037.
- Takemura A, Izaki A, Sekine S, et al. Inhibition of bile canalicular network formation in rat sandwich cultured hepatocytes by drugs associated with risk of severe liver injury. Toxicol In Vitro 2016;35:121-130.
- Rodríguez-Enríquez S, Juárez O, Rodríguez-Zavala JS, et al. Multisite control of the Crabtree effect in ascites hepatoma cells. Eur J Biochem 2001;268(8):2512-2519.
- Liu C, Sekine S, Ito K. Assessment of mitochondrial dysfunction-related, drug-induced hepatotoxicity in primary rat hepatocytes. Toxicol Appl Pharmacol 2016;302:23-30.
- Ikeyama Y, Sato T, Takemura A, et al. Successful energy shift from glycolysis to mitochondrial oxidative phosphorylation in freshly isolated hepatocytes from humanized mice liver. Toxicol In Vitro 2020;65:104785.