研究交流
低分子化合物を用いた成熟肝細胞からの肝前駆細胞の作製
勝田 毅1,落谷孝広2
1 Gastroenterology Division, Perelman School of Medicine, University of Pennsylvania
2 東京医科大学 医学総合研究所 分子細胞治療研究部門
1. はじめに
移植用のヒト肝細胞の安定供給は肝再生医療における最重要課題の一つであるが,依然として解決策が確立されていない.肝細胞を生体外で増やすことが極めて難しいからである.そのため,初代肝細胞に替わってES・iPS細胞から肝細胞を創ろうとする試みが精力的に進められてきた.しかし,これらのいわゆる “lab-made hepatocyte”は十分な肝機能をもつには至らず,移植時の治療効果は初代肝細胞のそれに比べ著しく低い(1).一方で,肝臓が慢性的な障害に陥った際に現れる肝前駆細胞(liver progenitor cell: LPC)を移植に用いるというアイディアも提案されている.実際に,げっ歯類のLPCを肝障害マウスに移植し,ホスト肝臓の置換に成功している例が報告されているが(2),ヒトのLPCを用いた研究はほとんど進んでいない.これらのアプローチとは別に我々は最近,低分子化合物を用いて成熟肝細胞をLPC様細胞(chemically induced liver progenitor: CLiPと命名)の状態に戻して生体外で増殖させる技術を開発した.この技術は当初げっ歯類の実験で見出したものであったが(3),その後ヒト肝細胞にも応用可能であることを明らかにした(4).本稿では,このCLiP技術について紹介する.
2. 低分子化合物を用いたげっ歯類成熟肝細胞のin vitroリプログラミング
我々の研究室では以前,lab-made hepatocyteの作製に精力的に取り組んでいたが (5–9),実用化を目指すうえでより現実的な細胞ソース,すなわちより高い肝機能を発揮しうる細胞ソースの供給を目的とし,小型肝細胞を標的とすることにした.肝細胞のsubpopulationである小型肝細胞は形態学的・機能的には成熟肝細胞とほぼ同等でありながら,in vitroで増殖能を有するため,再生医療の細胞ソースとして期待されている(10).小型肝細胞は数回なら継代培養できるが,長期間安定に培養することは難しく,倍加時間も50-750時間と決して速くはない(11).そこで我々は,小型肝細胞をより長期間にわたって,かつより高い増殖能をもって増やせるようにしたいと考えた.
このように考えた背景には,我々の研究室で取り組んでいた低分子化合物を用いた幹・前駆細胞の培養研究の経験がある.2000年代から,低分子化合物シグナル阻害剤がES細胞のstemness維持において有効であることが,多くの論文で報告された(12, 13).我々の研究室でも,4つの低分子化合物,Y-27632(ROCK阻害剤),PD0325901(MEK阻害剤),A 83-01(TGFβ阻害剤),CHIR99021(GSK3 阻害剤)のカクテル(YPACと命名)を用いることで,ラットES細胞の未分化能を高く維持し,かつgermline transmissionの効率を著しく向上させることに成功した(14, 15).興味深いことに, その後の研究でYPACはES細胞だけでなく,ラットの乳腺幹細胞および乳がん幹細胞の多能性・自己複製能の維持にも寄与することが判明した(16).また他の研究グループの報告でも,YPACに含まれる化合物が,LPCを含む組織幹・前駆細胞の維持培養に用いられている(17–21).これらの事実から,肝細胞の前駆細胞と考えられる小型肝細胞も(22),低分子化合物を用いることでより安定に増殖させられるのではないかと考えた.
そこでまず,成熟ラットから小型肝細胞を採取し,Y, P, A, Cの4つの化合物の全ての組み合わせを加えて培養することで,増殖能を指標としたミニスクリーニングを行った.この結果,AとCを含む複数の組み合わせ,特にYACの組み合わせで最も活発な小型肝細胞の増殖が確認できた(未発表データ). 驚いたことに,小型肝細胞だけでなく,生体外では増殖できないとされている成熟肝細胞までもが,YAC存在下で顕著に増殖することが確認された(3).さらに,増殖した細胞はSox9やKrt19といった,LPCとBECに共通するマーカー を発現しており,成熟肝細胞が前駆細胞の状態へと戻っていることが示唆された.実際に,肝分化誘導刺激を加えると再び肝細胞へと再分化することが確認できた.一方,低濃度の Matrigelを加えた培養条件下では,胆汁輸送能をもつ胆管様のシスト構造を形成することが確かめられた.これらの観察から我々は,YACの存在下で誘導されるこのLPC様細胞をchemically induced liver progenitor: CLiPと命名した.さらに,CLiPは複数回の継代を経てもおよそ15時間の倍加時間で安定に培養できることがわかった.最も重要なことは ,ラットCLiPを肝障害モデル動物であるcDNA-uPA/SCIDマウスの肝臓に移植すると,高い再現性をもって肝臓の再生に寄与することが認められたことである.移植8週間後にはホスト肝臓の75-90%がラット細胞によって置換されており,これは成熟ラット肝細胞の移植時と同等の置換率であった.なお,マウスの成熟肝細胞を用いた実験でも同様の現象を確認できていることから,げっ歯類においては,YACがCLiP誘導剤として有効であることが明らかとなった(図1).
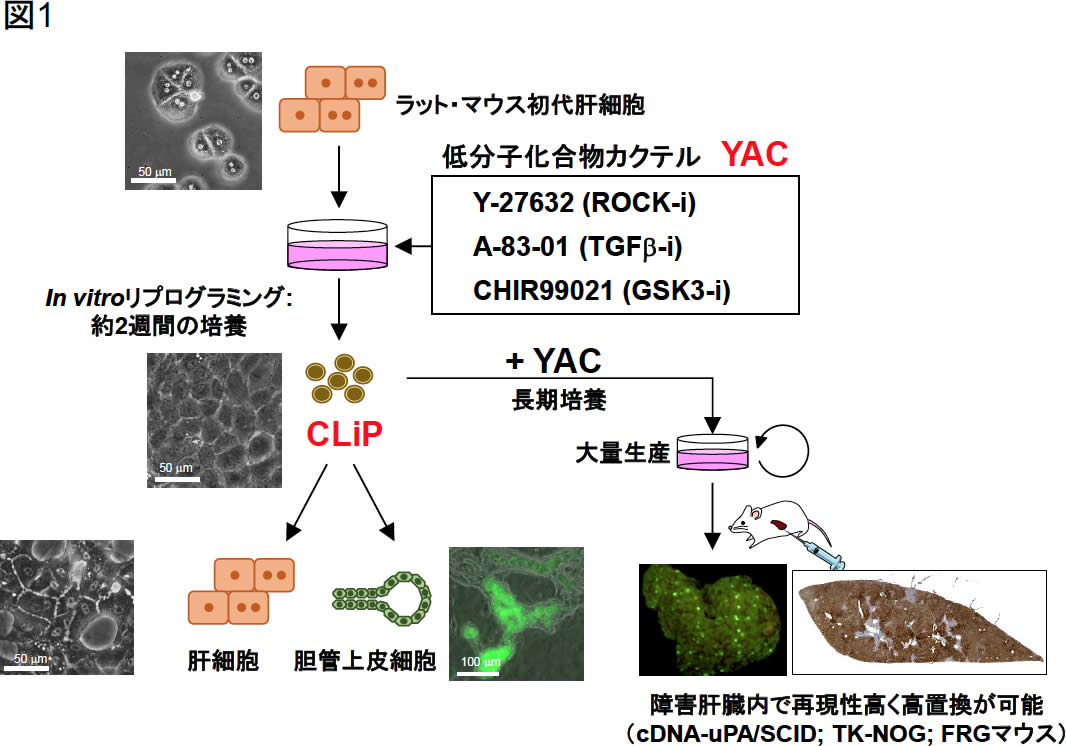
図1. ラット・マウスCLiPの概要
ラット・マウスの成熟肝細胞を,3つの低分子化合物カクテルYACの存在下で1-2週間培養すると,高い増殖能を持つchemically induced liver progenitor (CLiP)へとリプログラミングできる.CLiPはoncostatin M, dexamethasone, Matrigelの刺激により,肝細胞へと再分化させることが可能である.また,低濃度のMatrigelを含むmTeSR™1培地で培養すると,胆汁輸送能をもつ胆管様管腔構造が構築される.さらに,YACを添加している限り,CLiPは事実上無制限に継代培養することが可能であり,かつ肝障害マウスへの移植において高い確率で高置換に至る.
3. ヒトCLiPの作製
げっ歯類CLiP樹立後,我々はこの技術のヒト肝細胞リプログラミングへの応用に取り組み,部分的にはこれに成功し,最近論文として報告することができた(図2,図3)(4).「部分的に」と述べたように,残念ながらヒトでのCLiP技術は現時点ではまだ完成形とは言えないのが実情である.今後の課題解決を願って,以下にげっ歯類CLiPとの比較から,現時点でのヒトCLiPの能力の限界を列挙しておく.
| ① | 乳幼児の肝細胞からはヒトCLiPの誘導に成功しているが,成人肝細胞からは成功していない. |
| ② | 免疫不全の肝疾患マウスへの移植実験では,継代数の少ないヒトCLiPであれば(継代数0-2),高置換(30%以上)の可能性があることを確認している.一方で継代数が4を超えると,少なくとも移植後2か月以内での高置換は見られない.また継代数が少ない場合でも,全く生着が見られない個体が半数以上を占め,げっ歯類CLiPに比べるとホスト肝臓への生着能・再生能は明らかに低い(ラットCLiPの移植では,移植後生存したマウスの100%で高置換が確認できている(未発表データ).マウスCLiP移植においても,ラットほどではないものの同様の結果が得られている(未発表データ)). |
| ③ | げっ歯類のCLiP誘導は無血清培地で可能であったのに対し,ヒトCLiPの誘導には血清の添加が必須である. |
上記の制約①は,乳幼児肝細胞のドナー不足問題や,他家移植よりも自家移植が望まれることを考えると,今後の解決が必須である.成人の肝細胞でも部分的に増殖コロニーの出現を認めているものの(4),成人肝細胞で十分な増殖能を誘導するためには,現在の増殖誘導刺激に加えてより強力な刺激が必要であると考えられる.なお,低分子化合物の濃度を上げても成人肝細胞の増殖誘導にはつながらなかったため(未発表データ,n = 1),Tgfβ経路の阻害とWnt経路の促進だけでは成人肝細胞の増殖誘導刺激としては不十分なようである.
制約②に関しては,肝細胞置換が以下のような多段階で起こる現象であると想定すると,どの段階が高置換の妨げとなっているのかを理解することが解決の糸口になるになるかもしれない.すなわち,まず移植されたCLiPが類洞にトラップされ,そこから無事に血管壁を超えて肝細胞索に取り込まれ,細胞分裂を繰り返しながらホスト肝細胞との競合を経てこれらの細胞を徐々に置き換えていくという多段階プロセスが考えられる.しかし,肝細胞移植によるホスト肝臓の再生メカニズムの理解は決して進んでいるとはいえず,まずこのメカニズムの理解そのものが重要ともいえる.またCLiP移植の場合は初代肝細胞の移植とは異なり,どこかのタイミングで成熟化する必要もあり(置換後のヒトCLiPは肝細胞として完全に成熟化している(4)),この成熟化プロセスが律速段階となっている可能性もある.ラットCLiP移植にあたっての予備試験では,肝細胞への分化誘導の有無にかかわらず高置換が可能であったが(未発表データ),ヒトCLiPの場合はあらかじめ肝成熟化誘導しておくことで高置換に至る確率が高くなるかもしれない.
制約③も臨床応用の実現に向けて解決しなければならない課題である.当初我々は,CLiP技術を臨床に応用することを念頭に置き,無血清培地の利用に強くこだわっていたが,残念ながら現段階では胎児ウシ血清に頼らざるを得ない状況となっている.課題解決に向けて,今後も研究を進めていくつもりである.
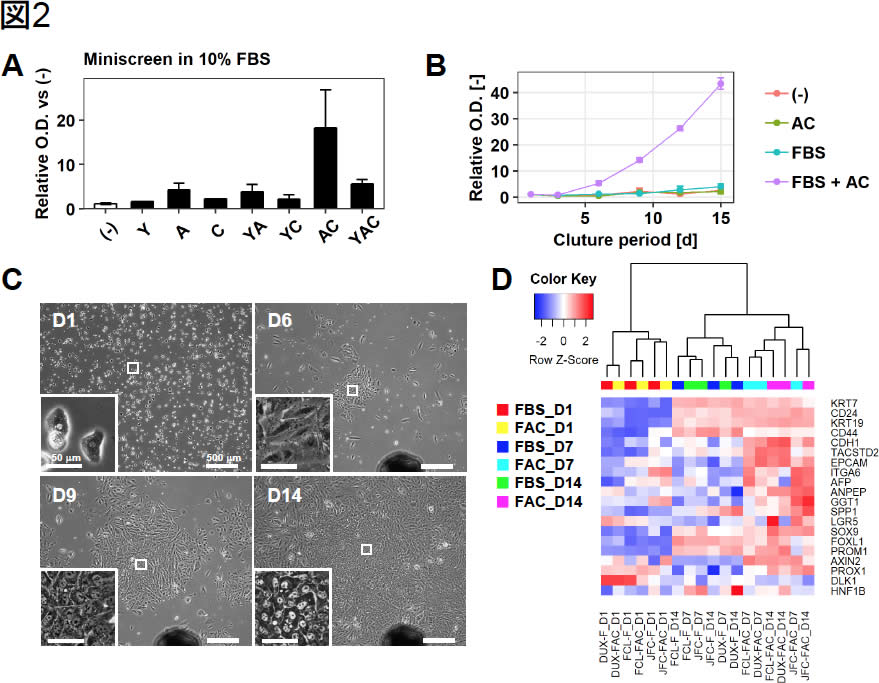
| 図2. ヒトCLiPの誘導 | |
| (A) | ラット・マウスと異なり,ヒト肝細胞の増殖誘導には,AとC二つの化合物の方がYACよりも有効であることがわかった. |
| (B) | ACとFBSの両方を添加することで初めてヒト肝細胞の増殖が見られる. |
| (C) | 増殖細胞,すなわちヒトCLiP(D6, D9)は播種直後(D1)の肝細胞とは異なる形態を呈するが,コロニーの細胞密度が高くなると自発的に肝細胞様形態を呈するようになる(D14). |
| (D) | FBS + ACの条件で培養した細胞では,KRT19,EPCAM,CD24などの胆管上皮細胞とLPCに共通するマーカー遺伝子の発現が確認できる. |
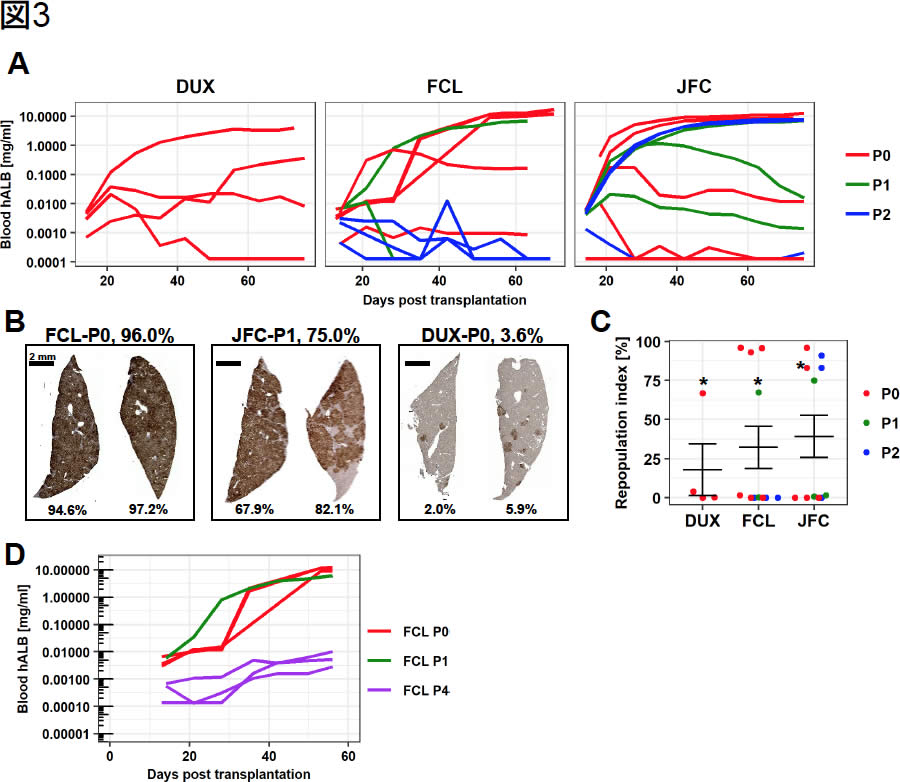
| 図3. 肝障害マウスにおけるヒトCLiPの再生能 | |
| (A) | cDNA-uPA/SCIDマウスへの移植実験での,マウス血中ヒトアルブミン濃度の経時変化.3ドナー(DUX, FCL, JFC)のヒトCLiP移植実験の結果を示す.線の色は継代数を示す. |
| (B) | 移植後10-11週でのマウス肝臓をヒトCYP2C特異的抗体を用いて免疫染色した結果.画像の上のパーセンテージは置換率を示す.左二例は高置換を,右一例は低置換の例を示す.なお,パネル(C)を見ればわかるように,実際には置換率ゼロの個体も多くみられる. |
| (C) | 移植後10-11週間での個体別の置換率.点の色は継代数を示す. |
| (D) | 継代数4(P4)のヒトCLiP移植での血中ヒトアルブミン濃度を,継代数0,1での高置換個体と比較した.高置換時にはヒトアルブミン濃度が10 mg/mlを超えているのに対し,P4のヒトCLiP移植では,移植後にヒトアルブミン濃度の上昇は見られるものの,最大でも0.01 mg/ml程度にとどまっていることがわかる. |
4. おわりに
臨床応用に向けてまだ課題は多く残っているものの,「肝細胞は生体外で増やせない」という長らくの認識が,CLiP研究によって変わりつつあることも確かである.最近の国際学会などでは,肝細胞を増やすという難題に挑むグループが次々と出てきており,ヒト肝細胞の増殖研究がにわかに盛んになっていることが実感できる.また我々のヒトCLiP論文と前後して,同様の論文がいくつか報告されている(23–27).中でもZhangらの報告は特に印象深く,継代数4-6のヒト細胞を用いて平均で30-60%,最大では80%以上という高い置換率を得ることに成功している(26).ただし,彼らの細胞の再生能力も継代とともに低下していくことが認められており,我々と同様の課題が潜んでいることも見受けられる.一方,Zhangら の報告で注目すべきなのは,乳幼児肝細胞に比べると効率は低いものの,成人の肝細胞を用いた実験でも増殖誘導に成功していることである.Zhangらと我々の報告以外では30%を超える高置換に成功した報告はなく,やはりヒト増殖肝細胞を用いた高置換は難しいという印象が残る.しかし,いずれの報告も異なる培地組成でそれぞれ独自にヒト肝細胞の増殖誘導に成功しており,これら複数の研究から得られた知見を活かして培養条件の最適化に取り組めば,今後、よりロバストな培養手法が確立できる可能性もある.これからの研究に期待したい.
謝辞
本研究は元国立がん研究センター,分子細胞治療研究分野(現東京医科大学,分子細胞治療研究部門)を中心に行われました.共同研究者の皆様にお礼申し上げます.また移植実験にあたって相談に乗ってくださった株式会社フェニックスバイオの皆様にもこの場をお借りしてお礼申し上げます.
引用文献
- M. Rezvani, A. A. Grimm, H. Willenbring, Assessing the therapeutic potential of lab-made hepatocytes. Hepatology. 64, 287–294 (2016).
- M. Oertel, D. A. Shafritz, Stem cells, cell transplantation and liver repopulation. Biochim Biophys Acta. 1782, 61–74 (2008).
- T. Katsuda et al., Conversion of Terminally Committed Hepatocytes to Culturable Bipotent Progenitor Cells with Regenerative Capacity. Cell Stem Cell. 20, 41–55 (2017).
- T. Katsuda et al., Generation of human hepatic progenitor cells with regenerative and metabolic capacities from primary hepatocytes. Elife. 8 (2019), doi:10.7554/eLife.47313.
- T. Teratani et al., Direct hepatic fate specification from mouse embryonic stem cells. Hepatology. 41, 836–46 (2005).
- Y. Yamamoto et al., Recapitulation of in vivo gene expression during hepatic differentiation from murine embryonic stem cells. Hepatology. 42, 558–67 (2005).
- A. Banas et al., Adipose tissue-derived mesenchymal stem cells as a source of human hepatocytes. Hepatology. 46, 219–28 (2007).
- T. Ishikawa et al., Human Induced Hepatic Lineage-Oriented Stem Cells: Autonomous Specification of Human iPS Cells toward Hepatocyte-Like Cells without Any Exogenous Differentiation Factors. PLoS One. 10, e0123193 (2015).
- T. Katsuda, T. Teratani, M. M. Chowdhury, T. Ochiya, Y. Sakai, Hypoxia efficiently induces differentiation of mouse embryonic stem cells into endodermal and hepatic progenitor cells. Biochem. Eng. J. 74, 95–101 (2013).
- T. Mitaka, M. Mikami, G. L. Sattler, H. C. Pitot, Y. Mochizuki, Small cell colonies appear in the primary culture of adult rat hepatocytes in the presence of nicotinamide and epidermal growth factor. Hepatology. 16, 440–7 (1992).
- T. Mitaka, The current status of primary hepatocyte culture. Int. J. Exp. Pathol. 79, 393–409 (1998).
- W. Li, K. Jiang, S. Ding, Concise review: A chemical approach to control cell fate and function. Stem Cells. 30, 61–68 (2012).
- R. C. Schugar, P. D. Robbins, B. M. Deasy, Small molecules in stem cell self-renewal and differentiation. Gene Ther. 15, 126–135 (2008).
- M. Kawamata, T. Ochiya, Generation of genetically modified rats from embryonic stem cells. Proc. Natl. Acad. Sci. U. S. A. 107, 14223–14228 (2010).
- M. Kawamata, T. Ochiya, Two distinct knockout approaches highlight a critical role for p53 in rat development. Sci. Rep. 2, 945 (2012).
- M. Kawamata, T. Katsuda, Y. Yamada, T. Ochiya, In vitro reconstitution of breast cancer heterogeneity with multipotent cancer stem cells using small molecules. Biochem. Biophys. Res. Commun., 1–8 (2016).
- J. Huang, M. Nguyen-Mccarty, E. O. Hexner, G. Danet-Desnoyers, P. S. Klein, Maintenance of hematopoietic stem cells through regulation of Wnt and mTOR pathways. Nat. Med. 18, 1778–1785 (2012).
- H. Mou et al., Dual SMAD Signaling Inhibition Enables Long-Term Expansion of Diverse Epithelial Basal Cells. Cell Stem Cell, 1–15 (2016).
- A. Kamiya, S. Kakinuma, Y. Yamazaki, H. Nakauchi, Enrichment and clonal culture of progenitor cells during mouse postnatal liver development in mice. Gastroenterology. 137, 1114–26, 1126.e1–14 (2009).
- T. Sato et al., Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262–5 (2009).
- M. Huch et al., In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature. 494, 247–50 (2013).
- J. Kon, H. Ooe, H. Oshima, Y. Kikkawa, T. Mitaka, Expression of CD44 in rat hepatic progenitor cells. J. Hepatol. 45, 90–98 (2006).
- Y. Kim et al., Small molecule-mediated reprogramming of human hepatocytes into bipotent progenitor cells. J. Hepatol. 70, 97–107 (2019).
- G.-B. Fu et al., Expansion and differentiation of human hepatocyte-derived liver progenitor-like cells and their use for the study of hepatotropic pathogens. Cell Res. 29, 8–22 (2019).
- H. Hu et al., Long-Term Expansion of Functional Mouse and Human Hepatocytes as 3D Organoids. Cell. 175, 1591-1606.e19 (2018).
- K. Zhang et al., In Vitro Expansion of Primary Human Hepatocytes with Efficient Liver Repopulation Capacity. Cell Stem Cell, 1–14 (2018).
- W. C. Peng et al., Inflammatory Cytokine TNFα Promotes the Long-Term Expansion of Primary Hepatocytes in 3D Culture. Cell, 1607–1619 (2018).