研究交流
脱細胞化肝臓骨格における類洞様構造の再構築
須藤 亮
慶應義塾大学理工学部システムデザイン工学科
1. はじめに
重篤な肝障害は生命の危機につながるが、その患者数はドナー臓器の数を大きく上回っており、唯一の治療法である肝移植が満足に実施できていない。このことから、生体外で移植可能な肝臓を構築することの重要性が認識されており、1993年にLangerとVacantiらが提唱した組織工学のコンセプト (1)に基づき、細胞、細胞の足場、増殖因子を組み合わせることにより生体外で機能的な肝組織を構築する様々な手法が報告されてきた (2-4)。特に、2010年にUygunらが報告した、臓器単位で肝組織を構築する手法によって、生体外で移植可能な肝臓を構築することがさらに現実味を帯びてきた (5)。この研究では、ラットから摘出した肝臓に酵素や界面活性剤を含む脱細胞化溶液を灌流することで、細胞を除去して残った細胞外マトリックス(ECM)から成る脱細胞化肝臓骨格を作製している。さらに、この骨格を足場として再び肝臓の構成細胞を充填することで、臓器サイズの肝組織を構築できる可能性が示された。脱細胞化肝臓骨格は、①臓器特異的な立体構造の保持、②ECM成分の適切な配置、③低い免疫原性、といった利点を有しており、肝細胞や血管内皮細胞を再充填することで、生体内の肝臓に類似した組織構造や肝機能を示すことが確認されている (6-9)。
移植可能な臓器を再生する方法として脱細胞化肝臓骨格を用いた手法が期待されているが、その一方で、脱細胞化肝臓骨格を用いて作製した肝臓には依然として課題が残されている。特に、細胞を再充填して構築した肝臓を動物に移植すると、臓器内に流入してきた血液が内部で血栓を形成するため、生体内での長期的な維持が極めて難しい (10-12)。このことは、再構築した肝臓内において、抗血栓性を有する血管内皮層の形成が不完全であることを示唆している。実際、従来研究の報告では直径50 μm以上の血管ネットワークの形成は確認されているのに対し、直径10 μm程度の類洞サイズの血管構造の再生は確認されてこなかった。したがって、血栓形成の問題を解決するためには、脱細胞化肝臓骨格内において類洞サイズの血管を再構築することが重要である。本稿では、脱細胞化肝臓骨格内における類洞構造の再生に焦点をあて、これまでに得られた知見と成果について簡単に紹介する。
2. 生体外における毛細血管の再生
私たちはこれまでに生体工学の立場から、細胞のような個々の要素から肝臓のようなシステムを構築できないかと考え、研究に取り組んできた。当初は、肝臓の主要な機能を司る肝細胞を生体外で培養するための手法を検討してきたが、その過程において肝組織を維持するためには、組織内部に酸素や栄養を供給する血管構造の導入が必須であると認識するに至った。それ以来、肝組織の構築だけでなく、血管系の構築にも着目して組織工学の研究を進めてきた。具体的には、平行平板流路やマイクロ流体チップといった培養プラットフォームに、生体由来のコラーゲンゲルや血管内皮細胞を配置し、ゲル内部で形成される血管の形態や性質などを調査してきた (13-15)。これらの研究を通じて、生体外においても、血管内皮細胞の自己組織化を誘導することで、微小血管の再構築が可能であることを見出した。
平行平板流路を用いた従来研究では、血管内皮細胞(ウシ肺微小血管内皮細胞)に血行力学的な刺激(せん断応力)を負荷することにより、血管新生が促進されることが分かっている (16)。また、コラーゲンゲルの硬さをコントロールすることにより、血管ネットワークの太さや伸長距離を調節できることが報告されている (17)。これらの研究は、生体外において機械的な刺激が、血管の形態制御や血管形成に有効であることを示唆している。また、マイクロ流体チップを用いた研究では、血管内皮細胞(ヒト臍帯静脈内皮細胞HUVEC)にヒト間葉系幹細胞を加えて共培養を行うことで、直径10 μm程度の連続した内腔を有する毛細血管を再生可能であり (18)、組織構造やバリア機能の観点からも生体内の毛細血管に類似していることを確認している (19)。さらに、間質流といった微小な流れと増殖因子の供給をコントロールすることで、形成される血管ネットワークの形態を制御しうることを見出している (20)。これらの研究は、生体外で毛細血管を再構築するためには、機械的な刺激や生化学的な因子が重要であることを示唆している。以上より、これらの知見を応用することによって、脱細胞化肝臓骨格内における類洞様構造の再構築を促進できるのではないかと考え、脱細胞化肝臓骨格を用いた臓器サイズの血管ネットワークの再生に着手した。
3. 脱細胞化肝臓骨格における類洞周囲の構造破壊
脱細胞化肝臓骨格を利用した従来研究では、直径50 μmより太い血管の再生は確認されているが、類洞と同等のサイズの微小血管を再生するには至っていない。類洞サイズの血管が再生されない原因として、脱細胞化の工程において肝臓内部における微細構造が破壊されていることが疑われた。そこで、私たちの研究では、まず脱細胞化後におけるECMの微細構造に着目し、特に類洞周囲のECMの組織構造が保持されているかどうか調査した。
脱細胞化肝臓骨格は、従来研究で報告されている手法に基づいて作製した (5)。具体的には、分解酵素であるトリプシンや界面活性剤(Triton X-100)が含まれる脱細胞化溶液を、摘出したラット肝臓の門脈から灌流し、16〜24時間かけて臓器内の全ての細胞を除去し、最終的に半透明な臓器骨格を作製した(図1左)。作製した脱細胞化肝臓の切片を作製し、免疫蛍光染色によってECMの微細構造を観察した結果、正常肝臓ではI型、III型コラーゲン、およびフィブロネクチンが血管を中心に放射状に分布する様子が見られ、従来研究とも一致して (21, 22)、類洞に沿って分布していることが確認された(図1右、正常肝臓)。一方で、脱細胞化肝臓骨格では、これらのECM構造が放射状に分布する様子は見られなかった(図1右、脱細胞化肝臓)。これらの結果は、脱細胞化溶液を灌流したことによって、類洞周囲におけるECMの微細構造が破壊されてしまったことを示唆している。すなわち、本手法により作製した脱細胞化肝臓骨格では、類洞を再構築するために必要な足場が失われていることが考えられた。
実際、脱細胞化肝臓骨格の門脈から血管内皮細胞(GFP-HUVEC: GFPを遺伝子導入したHUVEC)を再充填した条件では、臓器全体に広がる階層的な血管ネットワークが再生されることが確認された一方で、4日間培養しても直径10 μm程度の類洞サイズの血管の再生には至らなかった(図2)。これらの結果より、脱細胞化肝臓骨格内において類洞様構造を再構築する必要があることがわかった。そこで、血管内皮細胞の自己組織化を利用して、類洞様構造の形成を誘導することを考えた。
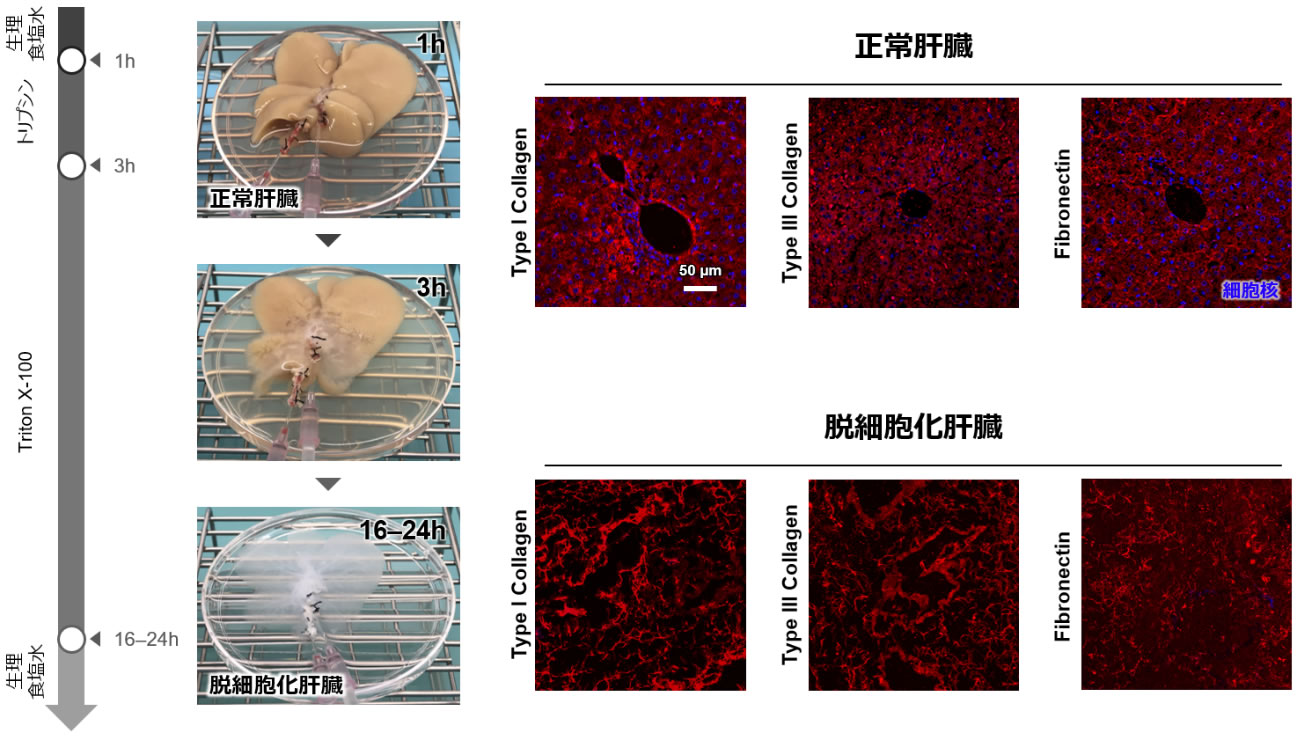
図1 脱細胞化肝臓の作製
左:脱細胞化肝臓の作製工程。トリプシンや界面活性剤を灌流することにより細胞が除去され、16〜24時間後には半透明な脱細胞化肝臓骨格が作製される。
右:正常肝臓と脱細胞化肝臓の組織構造。正常肝臓では、類洞に沿ってECMが放射状に分布している様子が見られた一方で、脱細胞化肝臓骨格では類洞周囲のECM構造が保持されていないことがわかった。
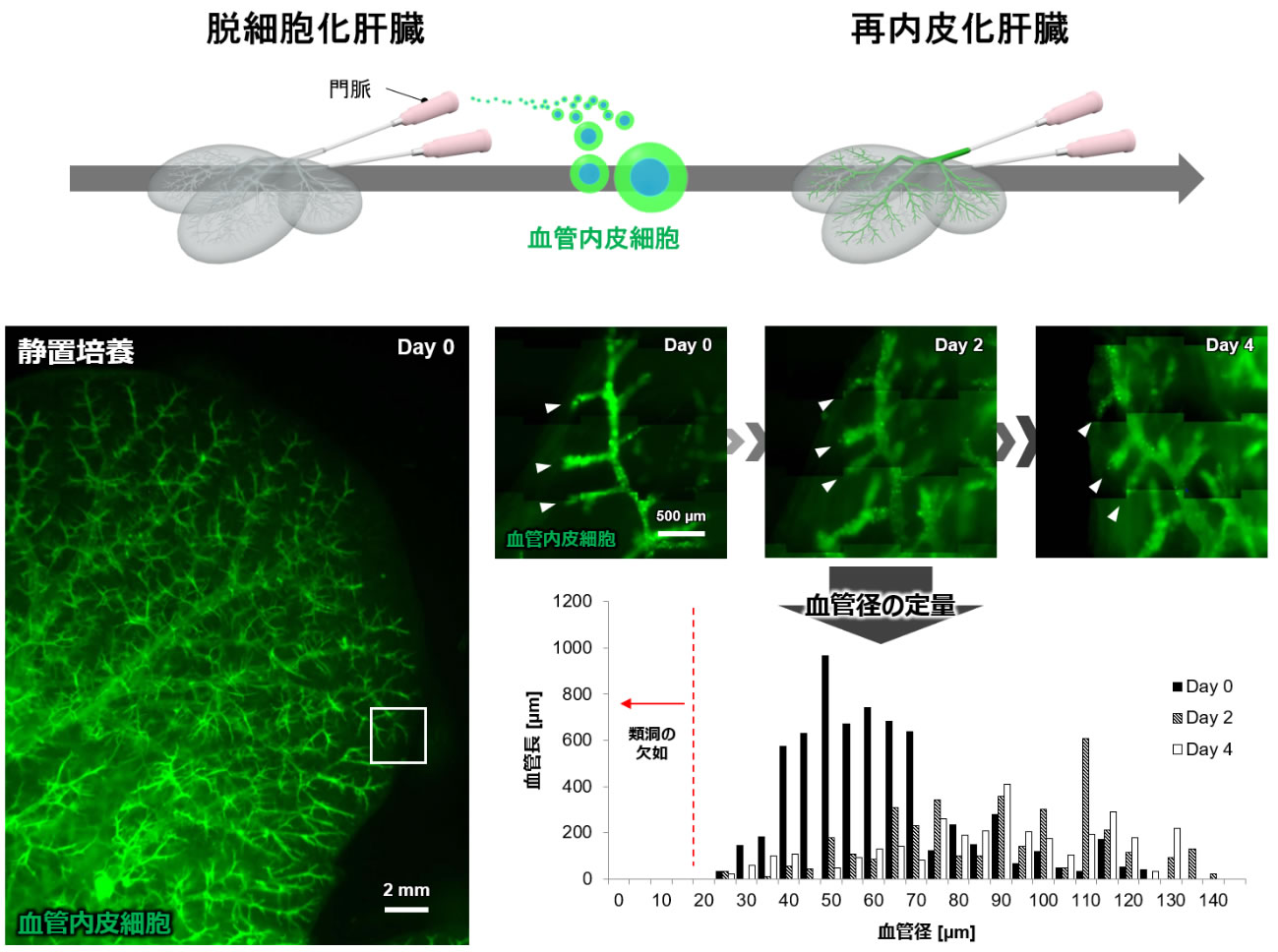
図2 血管内皮細胞による脱細胞化肝臓骨格の再内皮化
脱細胞化肝臓骨格に血管内皮細胞(GFP-HUVEC)を充填した結果、臓器全体に広がる血管ネットワークが形成された。また血管径の定量評価では、類洞サイズ(直径10 μm程度)の血管が欠如していることが明らかになった。
4. 機械的刺激および生化学的因子を利用した類洞様構造の再構築
生体外で毛細血管を再生する研究では、様々な培養プラットフォームを利用した従来研究が報告されている (21)。これらの研究によって、生体外において毛細血管の形成を促進するためには、機械的な刺激や生化学的な因子を調節することが重要であることが示されてきた。具体的には、血管内皮細胞にせん断応力のような機械的刺激を負荷することや (22, 23)、ECM成分の1つであるフィブロネクチンのコーティングを施すことで、既存血管から血管新生が誘導され、血管形成が促進されることが報告されている (24)。そこで、脱細胞化肝臓骨格内の血管再生においても、血管内皮細胞に機械的刺激であるせん断応力を負荷し、生化学的因子の調節としてフィブロネクチンコーティングを施すことで、血管内皮細胞による血管形成能力を促進し、太い血管から類洞サイズの毛細血管まで再生することができるのではないかと考えた(図3)。
まず機械的刺激を負荷するために、血管内皮細胞を充填した脱細胞化肝臓骨格にローラーポンプを接続し、肝臓骨格内部に培養液を循環させることで、血管内皮細胞にせん断応力を負荷した。この時、門脈から注入する培養液の体積流量を4.7 ml/minに設定すると、血管内壁に負荷されるせん断応力が0.1〜1 Pa程度になることを流体シミュレーションによって明らかにしている(図4右上)。このようなせん断応力を負荷した条件(還流培養)では、静置培養において欠如していた類洞サイズの血管が再構築されることを見出した(図4、矢頭)。また還流培養条件では、血管内皮細胞が血管の中心軸に沿って配向する形態を示した。血管内皮細胞が流れの方向に配向する現象は、血流にさらされている生体内の血管内皮細胞が流れを感知していることに起因するため、脱細胞化肝臓骨格内においても血管内皮細胞が機械的な刺激を受容しており、その結果として類洞様構造が再構築された可能性を示している。さらに、還流培養に加えて、脱細胞化肝臓骨格内部をフィブロネクチンでコーティングしてから血管内皮細胞を充填することで、再生される類洞様構造の数が顕著に増加することがわかった。これらの結果から、脱細胞化肝臓骨格においても、機械的な刺激と生化学的な因子を組み合わせることで、類洞様構造を再生できることが明らかになった。以上の研究は、2019年9月に刊行されたActa Biomaterialia誌の特集号「Biomaterials for Cell Manufacturing and Tissue Biofabrication」に収録されている (25)。
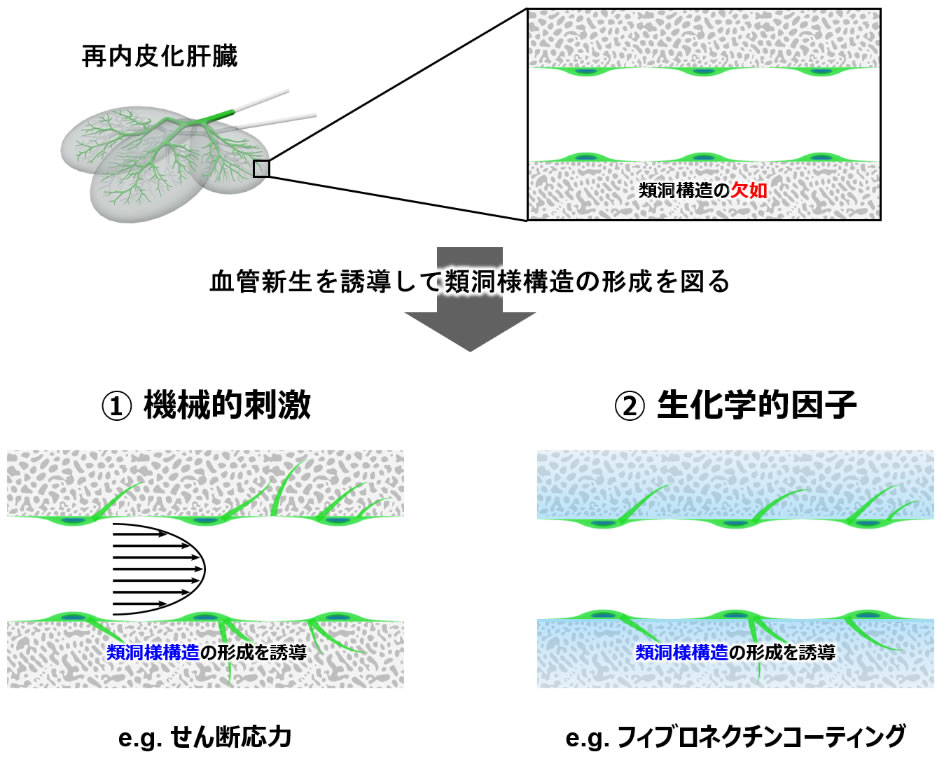
図3 脱細胞化肝臓骨格内における類洞様構造の形成アプローチ
脱細胞化肝臓骨格に充填した血管内皮細胞に対して、①機械的刺激や②生化学的因子を利用することにより、類洞様構造の形成が促進できるのではないかと仮説を立てた。

図4 脱細胞化肝臓骨格内における類洞様構造の再生
再内皮化肝臓を還流ポンプと接続して培養することで、脱細胞化肝臓骨格内の血管内皮細胞(GFP-HUVEC)にせん断応力を負荷した。その結果、還流条件および、還流培養とフィブロネクチンコーティングを組み合わせた条件において、類洞様構造の再生が認められた(矢頭)。
5. 脱細胞化肝臓骨格を用いた組織工学のこれから
これまでの研究によって、脱細胞化肝臓骨格において類洞様構造の再生が可能であることがわかってきたが、現時点では形態的な評価のみに留まっており、機能的な評価が行われていない。そこで、脱細胞化肝臓骨格において再構築した血管ネットワークに対して、抗血栓性を中心とした機能評価を行うことが今後の課題として残されている。また、現時点では機能的なヒト類洞内皮細胞を培養で維持することは極めて困難なため、脱細胞化肝臓骨格に充填した血管内皮細胞には、広く血管形成の研究に用いられてきたHUVECを使用した。そのため、血管による抗血栓性や血流を介した物質輸送(酸素や栄養の供給)といった血管の基本的な機能に着目して研究を進めてきたが、今後の研究では肝臓特異的な類洞構造をいかに再構築するのかという点も課題になる。類洞内皮細胞は肝臓特異的な血管内皮細胞であり、本研究で再構築された類洞サイズの血管が実際に類洞のような特徴を有しているのかどうか調べていく必要がある。あるいは、ヒト類洞内皮細胞の培養が可能になれば、脱細胞化肝臓骨格の再内皮化に使用することができる。
今回の研究では肝臓内の血管構造に着目したが、今後の研究では生体外において個別の組織として構築が可能になってきた肝組織 (26)、胆管 (27)、血管ネットワーク (25)を統合していかなければならない。そのためには、これらの組織をどのような順序で構築していくのが最終的に機能的な肝組織の再生につながるのか、系統立てて調べていく必要がある。より複雑な臓器サイズの肝臓システムの再生を目指して、さらなる研究に取り組んでいきたいと考えている。
6. おわりに
私たちの研究では、生体工学的な視点から組織工学の課題に取り組んできた。特に本稿で紹介した研究では、せん断応力の最適化と生化学的因子の調節を組み合わせることによって生体外における血管形成を促進する生体工学的なアプローチが、脱細胞化肝臓骨格における類洞様構造の再生にも役立つことを示している。このような医工連携による研究を通して将来の再生医療・組織工学の発展に貢献できれば幸いである。生体外においてより機能的な肝組織を構築することを目指して今後も生体工学的な立場から研究を続けていきたいと考えている。
謝辞
本稿で紹介した脱細胞化肝臓骨格を用いた研究は、当研究室に在籍する博士課程 渡邉應文君が中心となって行った研究成果である。脱細胞化肝臓骨格の作製は、慶應義塾大学医学部 北川雄光教授、八木洋専任講師のご協力のもとに行った。また、流体シミュレーションは慶應義塾大学 谷下一夫 名誉教授のご協力のもとに行った。この場を借りてお礼申し上げたい。
参考文献
- Langer, R. and Vacanti, J. P. (1993) Tissue engineering. Science 260, 920–926
- Sudo, R., Chung, S., Zervantonakis, I. K., Vickerman, V., Toshimitsu, Y., Griffith, L. G., and Kamm, R. D. (2009) Transport-mediated angiogenesis in 3D epithelial coculture. FASEB J. 23, 2155–2164
- Kasuya, J., Sudo, R., Masuda, G., Mitaka, T., Ikeda, M., and Tanishita, K. (2015) Reconstruction of hepatic stellate cell-incorporated liver capillary structures in small hepatocyte tri-culture using microporous membranes. J. Tissue Eng. Regen. Med. 9, 247–256
- Yoon No, D., Lee, K. H., Lee, J., and Lee, S. H. (2015) 3D liver models on a microplatform: well-defined culture, engineering of liver tissue and liver-on-a-chip. Lab Chip 15, 3822–3837
- Uygun, B. E., Soto-Gutierrez, A., Yagi, H., Izamis, M.-L., Guzzardi, M. A., Shulman, C., Milwid, J., Kobayashi, N., Tilles, A., Berthiaume, F., Hertl, M., Nahmias, Y., Yarmush, M. L., and Uygun, K. (2010) Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nat. Med. 16, 814–820
- Shirakigawa, N., Takei, T., and Ijima, H. (2013) Base structure consisting of an endothelialized vascular-tree network and hepatocytes for whole liver engineering. J. Biosci. Bioeng. 116, 740–745
- Yagi, H., Fukumitsu, K., Fukuda, K., Kitago, M., Shinoda, M., Obara, H., Itano, O., Kawachi, S., Tanabe, M., Coudriet, G. M., Piganelli, J. D., Gilbert, T. W., Soto-Gutierrez, A., and Kitagawa, Y. (2013) Human-scale whole-organ bioengineering for liver transplantation: A regenerative medicine approach. Cell Transplant. 22, 231–242
- Kadota, Y., Yagi, H., Inomata, K., Matsubara, K., Hibi, T., Abe, Y., Kitago, M., Shinoda, M., Obara, H., Itano, O., and Kitagawa, Y. (2014) Mesenchymal stem cells support hepatocyte function in engineered liver grafts. Organogenesis 10, 268–277
- Baptista, P. M., Moran, E. C., Vyas, D., Ribeiro, M. H., Atala, A., Sparks, J. L., and Soker, S. (2016) Fluid Flow Regulation of Revascularization and Cellular Organization in a Bioengineered Liver Platform. Tissue Eng. Part C 22, 199–207
- Ko, I. K., Peng, L., Peloso, A., Smith, C. J., Dhal, A., Deegan, D. B., Zimmerman, C., Clouse, C., Zhao, W., Shupe, T. D., Soker, S., Yoo, J. J., and Atala, A. (2015) Bioengineered transplantable porcine livers with re-endothelialized vasculature. Biomaterials 40, 72–79
- Hussein, K. H., Park, K.-M., Kang, K.-S., and Woo, H.-M. (2016) Heparin-gelatin mixture improves vascular reconstruction efficiency and hepatic function in bioengineered livers. Acta Biomater. 38, 82–93
- Kojima, H., Yasuchika, K., Fukumitsu, K., Ishii, T., Ogiso, S., Miyauchi, Y., Yamaoka, R., Kawai, T., Katayama, H., Yoshitoshi-Uebayashi, E. Y., Kita, S., Yasuda, K., Sasaki, N., Komori, J., and Uemoto, S. (2018) Establishment of practical recellularized liver graft for blood perfusion using primary rat hepatocytes and liver sinusoidal endothelial cells. Am. J. Transplant. 1–9
- Ueda, A., Sudo, R., Ikeda, M., Kudo, S., and Tanishita, K. (2006) Initial bFGF Distribution Affects the Depth of Three-dimensional Microvessel Networks in Vitro. J. Biomech. Sci. Eng. 1, 136–146
- Abe, Y., Ozaki, Y., Kasuya, J., Yamamoto, K., Ando, J., Sudo, R., Ikeda, M., and Tanishita, K. (2013) Endothelial progenitor cells promote directional three-dimensional endothelial network formation by secreting vascular endothelial growth factor. PLoS One 8, 1–12
- Yamamoto, K., Tanimura, K., Mabuchi, Y., Matsuzaki, Y., Chung, S., Kamm, R. D., Ikeda, M., Tanishita, K., and Sudo, R. (2013) The stabilization effect of mesenchymal stem cells on the formation of microvascular networks in a microfluidic device. J. Biomech. Sci. Eng. 8, 114–128
- Ueda, A., Koga, M., Ikeda, M., Kudo, S., and Tanishita, K. (2004) Effect of shear stress on microvessel network formation of endothelial cells with in vitro three-dimensional model. Am. J. Physiol. Circ. Physiol. 287, 994–1002
- Yamamura, N., Sudo, R., Ikeda, M., and Tanishita, K. (2007) Effects of the Mechanical Properties of Collagen Gel on the In Vitro Formation of Microvessel Networks by Endothelial Cells. Tissue Eng. 13, 1443–1453
- Yamamoto, K., Tanimura, K., Watanabe, M., Sano, H., Uwamori, H., Mabuchi, Y., Matsuzaki, Y., Chung, S., Kamm, R. D., Tanishita, K., and Sudo, R. (2018) Construction of Continuous Capillary Networks Stabilized by Pericyte-like Perivascular Cells. Tissue Eng. Part A 25, 499–510
- Uwamori, H., Ono, Y., Yamashita, T., Arai, K., and Sudo, R. (2019) Comparison of organ-specific endothelial cells in terms of microvascular formation and endothelial barrier functions. Microvasc. Res. 122, 60–70
- Abe, Y., Watanabe, M., Chung, S., Kamm, R. D., Tanishita, K., and Sudo, R. (2019) Balance of interstitial flow magnitude and vascular endothelial growth factor concentration modulates three-dimensional microvascular network formation. APL Bioeng. 3, 1–12
- Bogorad, M. I., DeStefano, J., Karlsson, J., Wong, A. D., Gerecht, S., and Searson, P. C. (2015) Review: In vitro microvessel models. Lab Chip 15, 4242–4255
- Kang, H., Bayless, K., and Kaunas, R. (2008) Fluid shear stress modulates endothelial cell invasion into three-dimensional collagen matrices. Am. J. Physiol. Circ. Physiol. 295, 2087–2097
- Galie, P. A., Nguyen, D.-H. T., Choi, C. K., Cohen, D. M., Janmey, P. A., and Chen, C. S. (2014) Fluid shear stress threshold regulates angiogenic sprouting. Proc. Natl. Acad. Sci. 111, 7968–7973
- Nicosia, R. F., Bonanno, E., and Smith, M. (1993) Fibronectin promotes the elongation of microvessels during angiogenesis in vitro. J. Cell. Physiol. 154, 654–661
- Watanabe, M., Yano, K., Okawa, K., Yamashita, T., Tajima, K., Sawada, K., Yagi, H., Kitagawa, Y., Tanishita, K., and Sudo, R. (2019) Construction of sinusoid-scale microvessels in perfusion culture of a decellularized liver. Acta Biomater. 1–12
- Sudo, R., Mitaka, T., Ikeda, M., and Tanishita, K. (2005) Reconstruction of 3D stacked-up structures by rat small hepatocytes on microporous membranes. FASEB J. 19, 1695–1697
- Hashimoto, W., Sudo, R., Fukasawa, K., Ikeda, M., Mitaka, T., and Tanishita, K. (2008) Ductular network formation by rat biliary epithelial cells in the dynamical culture with collagen gel and dimethylsulfoxide stimulation. Am. J. Pathol. 173, 494–506










