研究交流
脊椎動物における肝臓構築の多様性と進化
塩尻信義、太田考陽
静岡大学創造科学技術大学院自然科学系教育部バイオサイエンス専攻
1. はじめに
ヒトをふくめ哺乳類の肝臓は、多角柱の肝小葉からなるとされる。肝小葉ではその周辺部に肝内胆管と門脈、肝動脈の分枝が並走した門脈トライアッドが位置し(本稿では門脈並走型胆管構築、以後並走型)(図1)、門脈血及び動脈血は類洞を経て中心静脈に流れる。血液が類洞を通過する過程で、肝細胞による種々の物質代謝や血漿タンパク質などの類洞血液への供給が行われる。一方、肝細胞で産生された胆汁は肝細胞の間に発達した毛細胆管に出された後、肝内胆管へと運ばれる。この肝小葉構築は多くの教科書に記載されているが、脊椎動物において共通のものではない。条鰭類の肝臓構築については1960年代より報告があり、条鰭類肝臓は門脈と肝内胆管の走行にはあまり関係が認められず特殊な形態をもつ(本稿では門脈独立型胆管構築、以後独立型)(図1)ことが指摘されてきた[1-3, 6, 10]。最近、私たちのグループは脊椎動物100種余りの肝臓構築について系統的な形態解析を行い、脊椎動物の肝臓構築は大きく2タイプ、並走型と独立型に分けられ、特に条鰭類の進化のなかで肝臓構築が並走型から独立型へと大きく変容・進化したことを明らかにした(図2)[11-13]。この成果は、条鰭類の進化や適応の仕組みの解明に加え、両タイプの肝臓構築を比較解析することで、今までに知られていなかった、哺乳類の並走型肝臓構築の仕組みの解明にもつながる可能性がある。本稿では、私たちが現在までに得ている肝臓構築の多様性と進化に関する成果について、胆管形成誘導因子Jag1の関わりを含め概説する。
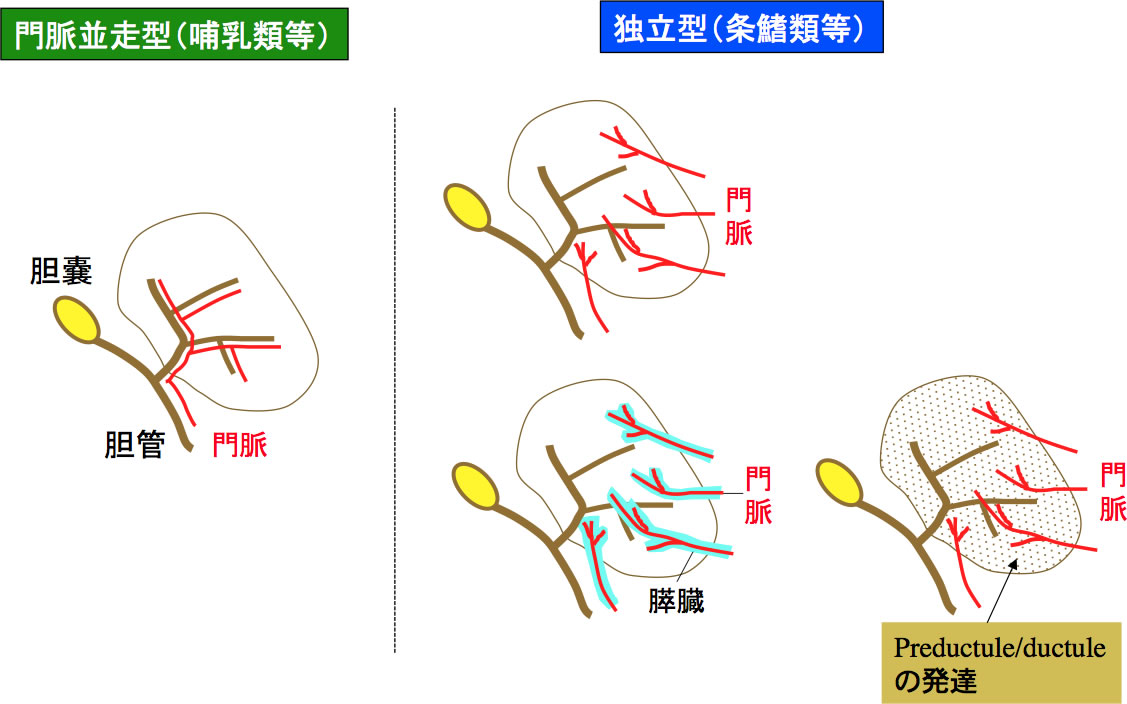
図1 脊椎動物における肝臓構築の2タイプ
哺乳類等に認められる肝臓は門脈と肝内胆管が並走する(並走型)のに対し、条鰭類等では門脈と肝内胆管の配置は独立である(独立型)。独立型の条鰭類の場合、肝内の門脈が膵臓をともなうことが多い。また肝臓に入る門脈も複数本以上である。肝内にductuleが発達する。
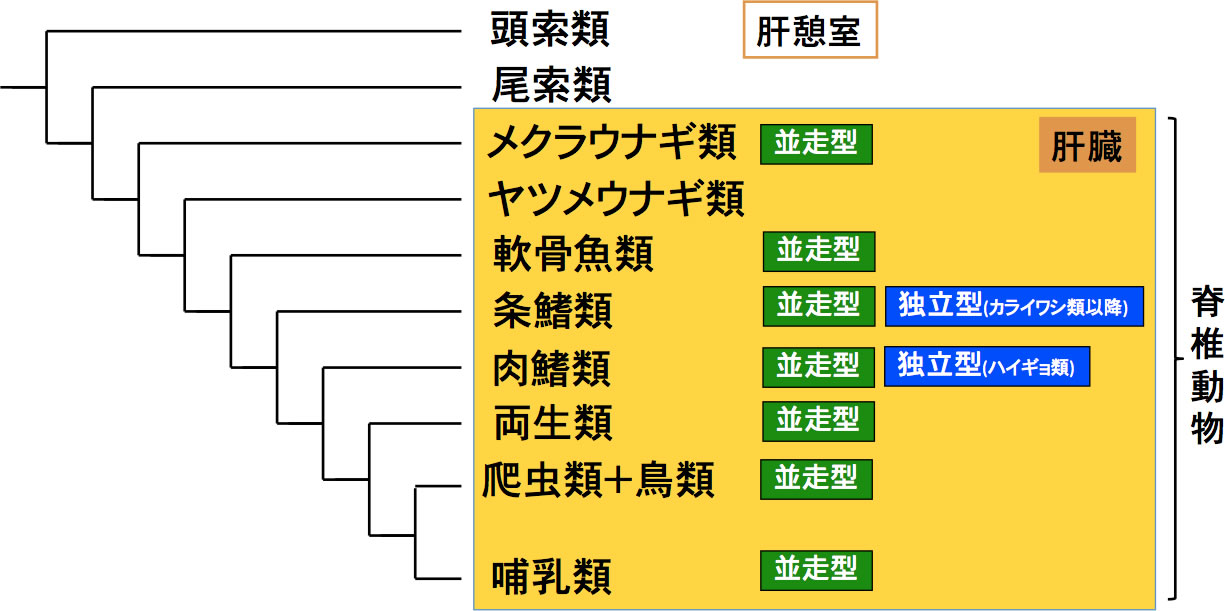
図2 脊椎動物における肝臓構築の進化
実質臓器である肝臓は無顎類から出現し、その構築は哺乳類型の並走型である。条鰭類の進化のなかで、古代魚は並走型をとるが、カライワシ類で並走型と独立型の中間型となり、ニシン・骨鰾類以降に独立型となる。ハイギョ類は並走型ではなく、独立型である。
2. 脊椎動物における肝臓の出現と2種類の肝臓構築
脊椎動物の進化のなかで、実質臓器である肝臓が出現するのはメクラウナギ類(無顎類)からである。脊索動物・頭索類ナメクジウオでは肝憩室にとどまる。尾索類マボヤの肝膵臓は非常に複雑な腺管構造をとるが、肝細胞が索状に配列する実質臓器ではない。メクラウナギ類ヌタウナギの肝臓には、胆管構造が発達する門脈と、その発達が認められない中心静脈(肝静脈)がすでに存在している[13](図3)。しかも驚いたことに、大きな管腔をもち、高い円柱上皮からなる肝外胆管は肝門より肝臓内に入り、同様の組織形態を有する肝内胆管となるが、これは門脈に沿って走り、途中から細管構造(ductule)に直接接続する。そしてこのductuleは門脈周囲に多数分布し、哺乳類肝臓の肝内胆管発生過程で出現するductal plate構造に類似していた。これらの結果より、哺乳類などに認められる並走型胆管を有する肝臓構築の原型は、脊椎動物の進化のなかで肝臓の獲得とともに最初に出現したと考えられる。
メクラウナギ類から軟骨魚類、肉鰭類、両生類と、哺乳類に至るまでこれらの肝臓は基本的に並走型胆管構築をとるが、ハイギョ類の胆管構築は独立型、あるいは並走型と独立型の中間型である(図4)。シーラカンスの肝臓は並走型胆管構築を示す。
一方、条鰭類の進化過程では、腕鰭類ポリプテルス、軟質類コチョウザメ、新鰭類スポッテッドガー、アミア、シルバーアロワナなどの古代魚は並走型胆管構築をとるが、ニホンウナギが含まれるカライワシ類では門脈に沿った肝内胆管に加え、門脈の走行とは独立の肝内胆管も走り、並走型と独立型の中間型の表現型を示す(図5)。そしてさらに進化したニシン類以降は、胆管と門脈の走行が独立である独立型肝臓となる(図6)。独立型肝臓では、2 cell plateからなる肝細胞索の毛細胆管側にサイトケラチン免疫組織化学で強陽性のductuleの発達が認められることが多い(図7)。ductuleが発達する条鰭類肝臓の構築は、哺乳類などで肝障害時に肝前駆細胞が実質部に増殖・侵入する病理像に近いとも考えられる[7, 9]。哺乳類肝臓における肝前駆細胞の増殖は胆汁排泄障害に対する応答との報告もあり[9]、その意味で、カライワシ類あるいはニシン類以降の条鰭類肝臓は胆汁排泄についてより効率的であったり、胆汁毒性に対しより耐性であるのかもしれない。また各分類群で、肝臓で産生される胆汁酸の種類が異なるとの報告[4]もあるが、これらの構築の違いは胆汁中の胆汁酸の種類では整理できない。
さらに、独立型肝臓では、門脈が多数本肝内に入る(図1, 図8)。哺乳類では、腸管からの血管は1本の門脈にまとめられた後、肝門ならびに肝内で分枝するため、腸管からの血液は同じ組成のものが各肝小葉に供給されると考えられる。独立型肝臓で門脈が多数本肝内に入る生物学的意義はよくわかっていないが、肝臓の各部域に供給される血液組成が異なる可能性がある。なお条鰭類のうち特に進化した種では、肝臓内に入る血管は門脈として1本にまとまらなかったり、また必ずしも腸管からのものばかりとは言えないため、その血管系の記載として、求心性血管(afferent vessel)、遠心性血管(efferent vessel)を採用する文献もある[3]。本稿では便宜的にそれぞれを門脈、中心静脈と呼んでいる。
また独立型肝臓では、門脈に沿って胆管は分布しないが、その周囲には膵臓(外分泌部)がしばしば観察され、肝膵臓と呼ばれる。膵臓の肝内への侵入は古代魚ポリプテルスやスポッテッドガーでも認められるが、これらの種では肝内胆管は同時に門脈と並走して肝内に分布する(図5)。膵臓の侵入はアロワナ類では余り顕著ではないが、クサフグやオイカワなどの骨鰾類以降の条鰭類では膵臓の侵入が顕著な種が多い(図5)。
条鰭類の独立型胆管を有する肝臓構築は哺乳類型肝臓構築のあと新たに獲得されたものと考えられるが、哺乳類のものに比し何が有利なのかはよくわかっていない。哺乳類などにおける肝障害の病理像との類似性からは、条鰭類の祖先動物、例えば肝臓構築に関し中間型の形質をもつカライワシ類の祖先動物が肝障害をひきおこしうる環境に置かれ、この独立型構築を進化的に発達させた可能性がある。またこの進化は門脈の走行や膵組織の発達と関係がある可能性もある。いずれにせよ、条鰭類の進化にともなって肝臓構築に大きな形態変化が認められるのは極めて興味深い。
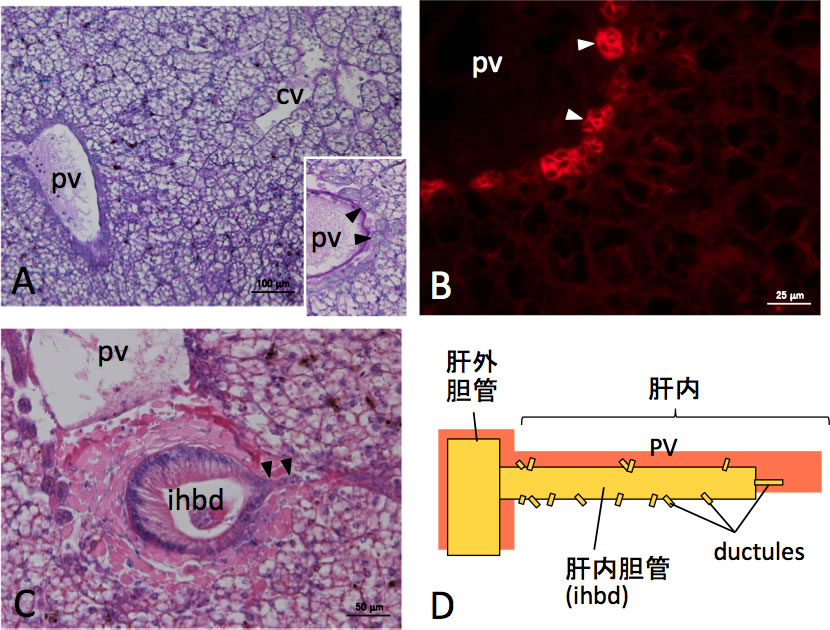
図3 無顎類ヌタウナギ肝臓は哺乳類肝臓の原始型である
A: ヌタウナギ肝臓のPAS-ヘマトキシリン染色像。B: ヌタウナギ肝臟の抗ウシサイトケラチン抗体による免疫蛍光染色像。C: ヌタウナギ肝臓における肝内胆管とductuleの分布(H-E染色像)。D: ヌタウナギ肝臓における肝内胆管の分布の模式図。門脈周囲にductuleが分布する(A)。Ductuleが発達しない血管(中心静脈)もある。挿入図は、ductuleの拡大(矢頭)。門脈周囲に発達するductuleはサイトケラチンの発現に関し強陽性である(B, 矢頭)。円柱上皮からなる肝内胆管が肝門から肝内に入るが、途中でductuleと連結する(C, 矢頭; D)。肝内胆管の組織像は肝外胆管に近い。cv, 中心静脈; ihbd, 肝内胆管; pv, 門脈。
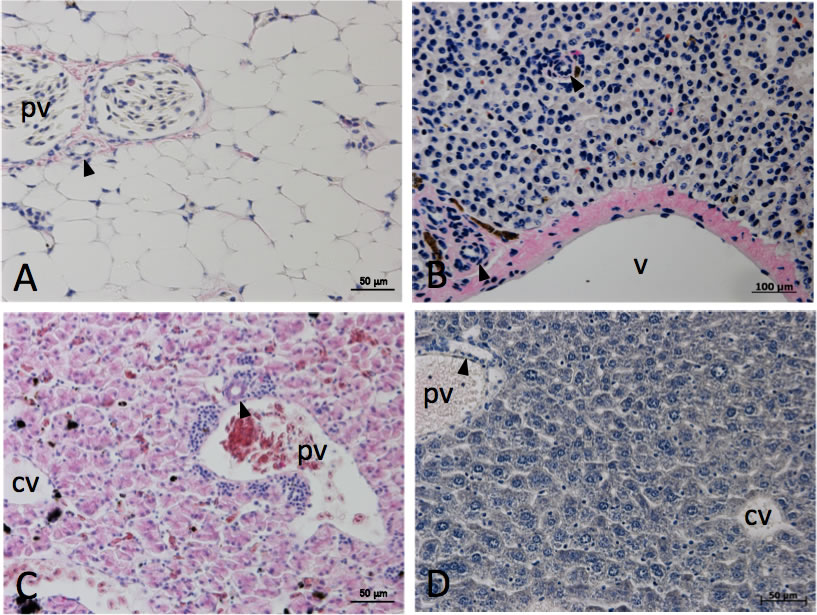
図4 軟骨魚類、肉鰭類、両生類、哺乳類肝臓の組織像
A: ラブカ肝臓。B: ミナミアメリカハイギョ肝臟。C: ネッタイツメガエル肝臓。D: マウス肝臓。H-E染色像。ラブカ肝臓は大量の脂肪を蓄積し、脂肪組織のようであるが、胆管は門脈と並走する(A, 矢頭)。ミナミアメリカハイギョ肝臟では、血管周囲に存在する胆管もあるが、肝実質に分布する胆管もある(B, 矢頭)。ネッタイツメガエル、マウス肝臓における肝内胆管の分布は門脈並走型である(C、D)。cv, 中心静脈; pv, 門脈; v, 血管。
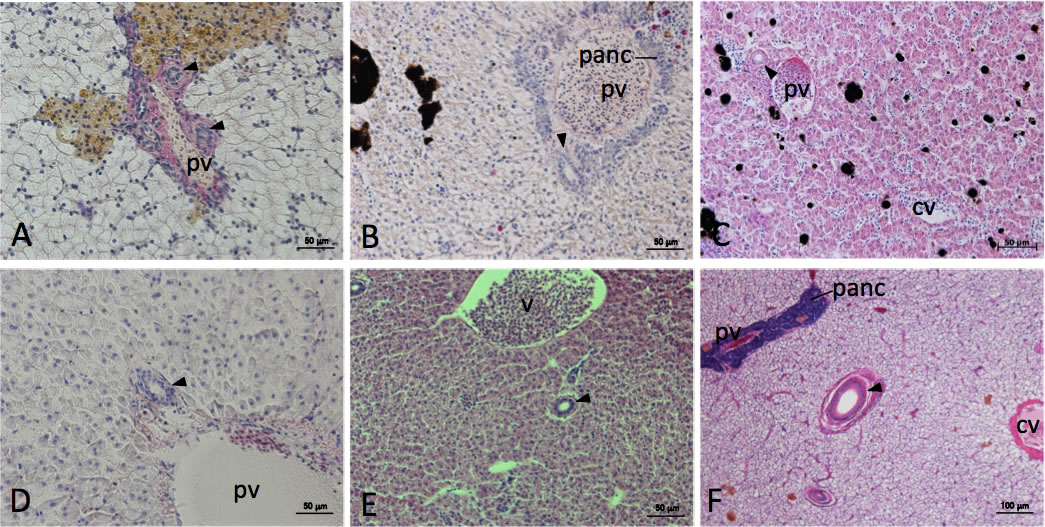
図5 条鰭類における肝臓の組織像
A: ポリプテルス肝臓。B: スポッテッドガー肝臟。C: シルバーアロワナ肝臓。D: アミウツボ肝臓。E: ゼブラフィッシュ肝臓。F: クサフグ肝臟。H-E染色像。ポリプテルス、スポッテッドガー、シルバーアロワナ、アミウツボ肝臓では、肝内胆管(矢頭)は門脈周囲に分布する(A-D)。スポッテッドガー肝臟では膵臓が門脈に沿って肝内に入る(B)。他方、ゼブラフィッシュ、クサフグ肝臓では、肝内胆管(矢頭)は門脈と並走することはなく、独立に分布する(E、F)。クサフグ肝臟の門脈周囲には膵臓が発達する(F)。cv, 中心静脈; panc, 膵臓; pv, 門脈。
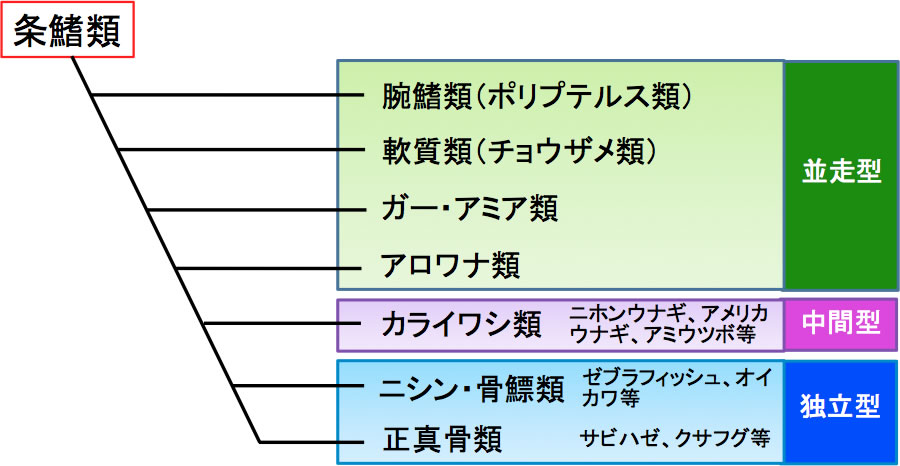
図6 条鰭類における肝臓構築の変化
条鰭類肝臓における肝内胆管の配向はニホンウナギの属するカライワシ類を境に、並走型から独立型に変化する。カライワシ類以降の魚種のうち本文中にでてくるものがどの分類群に属するか示されている。
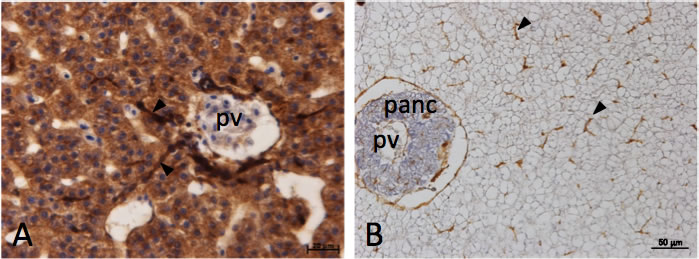
図7 条鰭類肝臓におけるductuleの発達
A: アメリカウナギ肝臓。B: クサフグ肝臟。抗ウシサイトケラチン抗体を用いた免疫組織化学。アメリカウナギでは、サイトケラチン強陽性のductuleが門脈周囲より肝実質部に侵入する(A, 矢頭)。クサフグでは、サイトケラチン陽性のductuleが肝細胞の毛細胆管側に発達する(B, 矢頭)。panc, 膵臓; pv, 門脈。
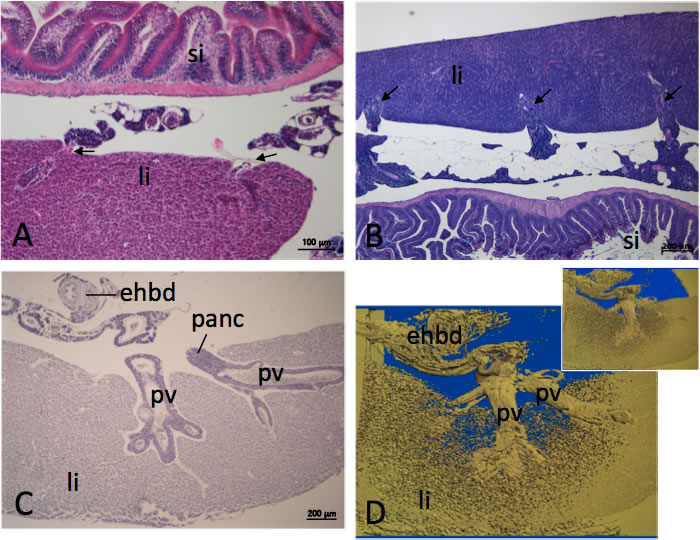
図8 条鰭類における肝臓への血管の侵入
A: ゼブラフィッシュ肝臓。B: オイカワ肝臟。C: サビハゼ肝臓。D: サビハゼ肝臓に入る門脈の3次元再構築像(Cをふくめ、厚さ6mm切片26枚からの再構築)。A-CはH-E染色像。ゼブラフィッシュ肝臓に肝門以外の部分から門脈が入る(A, 矢印)。オイカワ肝臓には門脈が複数本以上侵入する(B, 矢印)。門脈はその周囲に膵臓をともなう。サビハゼ肝臓でも、複数本以上の門脈が胆管とは独立に肝内に入る(C、D)。Dの挿入図は門脈の入る肝臓部分をあまり削除しない構築像を示す。ehbd, 肝外胆管; li, 肝臓; panc, 膵臓; pv, 門脈; si, 小腸。
3. 独立型胆管構築はどのような仕組みで形成されるのか
哺乳類では、胎生期にノッチシグナルのリガンドの1つであるJag1が門脈間充織で発現され、これがNotch2受容体を発現する隣接肝芽細胞に対して胆管誘導因子として働き、門脈に沿った胆管の形成がおこるとされる[5](図9)。ゼブラフィッシュでもJag1のパラログjag1a、jag1bやjag2bリガンドによるノッチシグナルが胆管形成に重要であるとの報告があるが[8, 14]、哺乳類の肝発生過程にみられるJag1の作用では、門脈と胆管が独立に分布する肝臓構築の仕組みは説明できないと考えられる。実際に、ゼブラフィッシュ肝臓発生過程で胆管形成を組織学的に調べてみると、肝細胞とともにその細胞索の間にductuleの発生がまずおこることがわかった。門脈周囲に肝内胆管の前駆構造ductal plateが形成されることはない。次にductuleと肝外胆管との接続部から肝内胆管の形成が開始される。現在までのところ、肝内胆管の起源が先に発生したductuleなのか、肝細胞なのか、あるいは肝外胆管が伸長するのかはまだわかっていない。
ゼブラフィッシュの肝臓構築におけるjag1aと1bの働きを解析するにあたり、両遺伝子のシンテニー解析をまず行ったところ、両遺伝子はアロワナ類の分岐前におこった第三次全ゲノム重複に由来する可能性が高いことがわかった。次にjag1aと1bに機能的な差がある可能性を考え、ゼブラフィッシュjag1aと1b タンパク質とマウスJag1タンパク質などとのアミノ酸配列の比較解析を行った。結果、その保存性は高く、機能的に大きく異ならないことが明らかとなった(図10)。これらの発現パターンをゼブラフィッシュ肝臓発生過程で解析することが必要であるが、予備的データでは哺乳類とは大きく異なり、両遺伝子ともに肝細胞で発現が認められるようである。その意味で、条鰭類の進化の過程で、胆管形成におけるノッチシグナルの利用の仕方が変更された可能性が高い。また、胆管形成の場所を時間的に指定するjag1a、1b遺伝子発現制御領域についても条鰭類の進化過程で大きく変化した可能性が高く、その比較ゲノム解析が望まれる。またjag2bについても同様の解析が必要である。
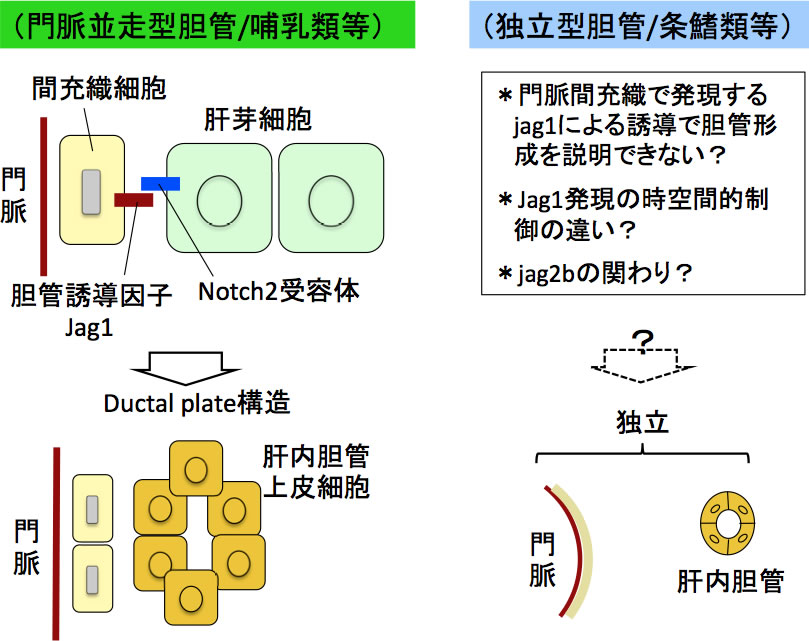
図9 マウス発生過程におけるJag1による肝内胆管誘導と条鰭類における肝内胆管形成
哺乳類では門脈間充織で発現するJag1より、隣接する肝芽細胞にノッチシグナルが入り、肝内胆管が形成される。条鰭類等の場合、肝内胆管は門脈とは独立に分布し、その胆管形成のしくみは哺乳類のものとは異なる可能性が高い。
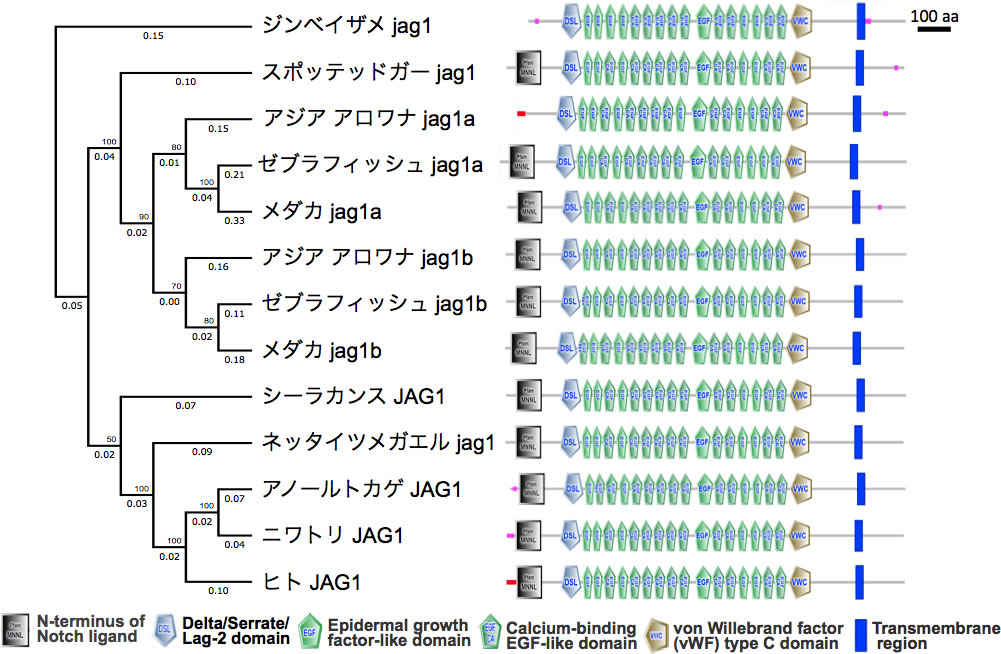
図10 Jag1タンパク質の構造の比較と最尤法による分子系統解析
系統樹はMEGA7 (Molecular Evolutionary Genetics Analysis version 7.0 )を用い最尤法にて推定した [15,16]。枝の分岐点の左上には100回のブートストラップ検定での推定確率 [17]、各枝の下部には座位当たりのアミノ酸置換数が示されている。タンパク質の構造の模式図は、SMART (a Simple Modular Architecture Research Tool) を用いてアミノ酸配列から分析及び同定し作成されたものを使用した[18]。重複したjag1a、bを含め脊椎動物におけるjag1はアミノ酸配列及び構造は高度に保存されており、特徴的な機能差は認められない。
4. おわりに
脊椎動物における肝臓構築の多様性と、その進化にともなう条鰭類肝臓における、門脈配向とは独立した胆管構築の進化について解説した。この構築の生物学的意義は必ずしも明らかになっていないが、本稿で述べたとおり、条鰭類肝臓においてductuleが発達する状況が、哺乳類肝臓で障害を受け前駆細胞が発達する病理像に近いことは、その意義を考える際のヒントになるのかもしれない。門脈の肝臓への侵入の仕方や膵臓の発達なども胆管配向とあわせて条鰭類の進化のなかで系統的に変化しており、胆汁排泄に加え、小腸や膵臓との機能連関なども、並走型肝臓とは異なる可能性がある。いずれにせよ、独立型胆管構築の生理学的な特徴を実験的に証明する必要がある。これにはあわせて、独立型胆管構築の分子基盤を並走型肝臓構築のそれとともに証明することが重要である。Jag1は、それぞれのタイプの胆管構築に関わる鍵因子であるので、分子基盤を明らかにする上で、Jag1遺伝子の比較ゲノム解析、特に発現の時空間制御をになう上流域の比較解析が威力を発揮するものと期待される。これらは今後の重要課題である。
謝辞
本研究はJSPS科研費 JP16K45678の助成を受けたものである。
文献
- Akiyoshi H, Inoue A (2004) Comparative histological study of teleost livers in relation to phylogeny. Zool Sci 21, 841-850.
- Beresford WA, Henninger JM (1986) A tabular comparative histology of the liver. Arch Histol Jap 49: 267-281
- Figueiredo-Fernandes AM, Fontaínhas-Fernandes AA, Monteiro RA, et al. (2007) Spatial relationships of the intrahepatic vascular-biliary tracts and associated pancreatic acini of Nile tilapia, Oreochromis niloticus (Teleostei, Cichlidae): a serial section study by light microscopy. Ann Anat 189: 17-30
- Hofmann AF, Hagey LR, Krasowski MD (2010) Bile salts of vertebrates: structural variation and possible evolutionary significance. J Lipid Res 51, 226-246.
- Hofmann JJ, Zovein AC, Koh H, et al. (2010) Jagged1 in the portal vein mesenchyme regulates intrahepatic bile duct development: insights into Alagille syndrome. Development 137, 4061-4072.
- Ito T, Watanabe A, Takahashi Y (1962) Histologische und cytologische Untersuchungen der Leber bei Fisch und Cyclostoma, nebst Bemerkungen uber die Fettspeicherungszellen. Arch Histol Jap 22, 429-463.
- Lemire JM, Shiojiri, N, Fausto N (1991) Oval cell proliferation and the origin of small hepatocytes in liver injury induced by D-galactosamine. Am J Pathol 139, 535-552.
- Lorent K, Yeo SY, Oda T, et al. (2004) Inhibition of Jagged-mediated Notch signaling disrupts zebrafish biliary development and generates multi-organ defects compatible with an Alagille syndrome phenocopy. Development 131, 5753-5766.
- Nagahama Y, Sone M, Chen X, et al. (2014) Contributions of hepatocytes and bile ductular cells in ductular reactions and remodeling of the biliary system after chronic liver injury. Am J Pathol 184, 3001-3012.
- Rocha E, Monteiro RA, Pereira CA (1994) The liver of the brown trout, Salmo trutta fario: a light and electron microscope study. J Anat 185, 241-249.
- Shiojiri N, Kametani H, Ota N, et al. (2018) Phylogenetic analyses of the hepatic architecture in vertebrates. J Anat 232, 200-213.
- Ueno T, Ishihara A, Yagi S, et al. (2015) Histochemical analyses on biliary development during metamorphosis of Xenopus laevis tadpoles.Zool Sci 32, 88-96.
- Umezu A, Kametani A, Akai Y, et al. (2012) Histochemical analyses of hepatic architecture of the hagfish with special attention to periportal biliary structures. Zool Sci 29, 450-457.
- Zhang D, Gates KP, Barske L, et al. (2017) Endoderm Jagged induces liver and pancreas duct lineage in zebrafish. Nat Comm 8, 769.
- Kumar S, Stecher G, Tamura K (2016) MEGA7: Molecular Evolutionary Genetics Analysis version 7.0 for bigger datasets. Mol Biol Evol 33, 1870-1874.
- Jones DT, Taylor WR, Thornton JM (1992) The rapid generation of mutation data matrices from protein sequences. Comput Appl Biosci 8, 275-282.
- Felsenstein J (1985) Confidence limits on phylogenies: An approach using the bootstrap. Evolution 39, 783-791.
- Letunic I, Bork P (2018) 20 years of the SMART protein domain annotation resource. Nucleic Acids Res 46, D493-D496.










