研究交流
Microphysiological System(生体模倣システム)の開発
小島伸彦
横浜市立大学大学院 生命ナノシステム科学研究科
1. はじめに
2016年の世界経済フォーラムでは“The top 10 emerging technologies of 2016”としてOrgans-on-chipsが選ばれている[1]。Tissue-chipsやHuman-on-a-chipなどとも呼ばれるこれらのチップは主に透明なシリコーンゴムなどで成形されており、単独あるいは複数の臓器コンパートメントをもち、臓器コンパートメントで細胞や組織を培養できるようになっている。血液の代わりに培養液でコンパートメントを結ぶと、人体の模倣システムが完成する。チップの素材やコンパートメントのデザイン、培地の駆動法、分析装置の研究なども合わせて、より包括的な概念としてMicrophysiological Systems(MPS)とも呼ばれており、同名の学術雑誌が2017年より刊行されている[2]。人体の中でも重要な臓器の一つである肝臓は、当然ながらこれらのチップに搭載されるべき臓器である。肝細胞研究会でも興味をもつ会員が多いと考え、MPSに関する近年の状況について簡単に報告を行いたい。
2. MPSの歴史
MPSは、Lab on a chipやMicro total analysis systems (µTAS)やMicro electro mechanical systems (MEMS)と呼ばれる半導体加工技術をベースとした研究領域において個別に開発が行われてきた。MPS研究が注目を集めたのは、2012年にアメリカ国防高等研究計画局(Defense Advanced Research Projects Agency; DARPA)が5年で37Mドルをハーバード大Wyss Instituteに出資し[3]、同時にアメリカ国立衛生研究所(NIH)も75Mドルを配分し[4]、アメリカ食品医薬品局(FDA)とも連携して国家プロジェクトがスタートしたためである。
DARPAによる開発目的は、戦場における様々な環境が人体へ及ぼす影響を評価するためのものと考えられるが、NIHやFDAはインビトロ試験の予測性の向上とそれにともなう創薬開発の効率化が主な動機になっている。創薬において、臨床試験での開発中止は数百億円にも達する損失を意味する。このリスクを避けるためには前臨床試験で医薬品の正確な毒性を予想する必要があるが、動物実験や生理学性の低いインビトロアッセイ系では正確性が担保できておらず、臨床試験で初めて不具合が明らかになるケースが多い。動物実験による前臨床試験をヒト細胞を用いたMPSに代替できれば、種差による医薬品に対する応答の違いがなくなるだけでなく、動物を飼育するスペースやコストがなくなり、近年話題となっている動物倫理の問題もクリアできる。またMPSは動物やヒトよりも容積が小さいため、低コストで実験を実施できるとともに、MPSのデザインを工夫することで幅広い条件検討を効率よく実施することが可能である。さらには、人種の差異を考慮した創薬や、個人のゲノムの多様性を反映したテーラーメイド投薬治療など、先進的な創薬・医療を実現する上で必要不可欠ともいえる魅力的なツールである。
2017年よりアメリカでMPS開発研究の第2期にあたるプロジェクトが継続されることとなり[5]、アメリカでの取り組みを慎重に見守ってきた日本でも同年、国立研究開発法人日本医療研究開発機構(AMED)による生体模倣システム(MPSの和訳)事業が開始されることとなった[6]。AMED-MPS事業では人体を構成する臓器・組織の中でも、特に医薬品開発において重要となる、小腸、肝臓、腎臓、血液脳関門の再現を目指しており、デバイス作製や細胞培養の専門家、細胞供給、ユーザーである製薬会社が集まり、特にヒトiPS細胞を活用することを日本の強みとして、急ピッチで開発が進展している。
3. 肝臓チップに期待される点
MPSが世界的に注目されるようになったのは、2010年にWyss InstituteのIngberらが開発したLung-on-a-chip、すなわち肺を模倣したチップである[7]。巧妙なチップ形状によってガスと血管のそれぞれのチャンバーを隔てるように肺胞上皮細胞・血管内皮細胞を培養できるだけでなく、デバイスの伸縮性を利用して呼吸時の物理的な伸縮を再現している。肝臓チップにはどのような特徴が求められるだろうか。まず、薬物代謝を担うCYPなどの代謝酵素が十分に発現しており、さらには適切に誘導が可能であることが重要である。次に、類洞や毛細胆管構造の再現が挙げられる。これらの構造はMPSだからこそ再構築できる可能性が高いが、小さなデバイスに細胞を播種・培養することは難しいケースが多く、100回に1回といった成功頻度ではなく実用的な生産性が必要とされる。同様に、類洞内皮細胞や星細胞などを適切な位置関係で共培養することや、排泄した胆汁を回収できるような工夫も望まれている。肝臓チップ単独だけでなく、特に小腸チップと連結して「腸肝循環」を再現するようなチップデザインの開発についても、AMED-MPS事業で開発が行われている。
4. ヒトiPS細胞由来肝細胞の高機能化
MPSの開発では、チップのデザインが先行しがちではあるが、いかに機能の高い細胞・組織を使うことができるかが実用性のカギとなる。AMED-MPS事業における我々の役割は、高機能なヒトiPS細胞由来肝細胞の供給である。株式会社リプロセルが研究分担となっており、ヒトiPS細胞由来肝細胞の機能を、我々独自のスフェロイド形成技術によってヒト凍結肝細胞と同等レベルまで改善し、最終的には株式会社リプロセルから販売することを目標としている。ヒトiPS細胞由来肝細胞は各社から販売されているものの、ヒト凍結肝細胞と比べれば全体的に肝機能が低く、α−フェトプロテインの発現がみられるなど、完全に分化した肝細胞とは言い難いためである。
ヒトiPS細胞由来肝細胞を最終分化させる、あるいは分化程度は変わらないまでも、最大限の肝機能を発揮させる手法の一つとして期待されているのが三次元培養である。例えばスフェロイド培養は初代培養細胞[8]でも、細胞株[9]でも肝機能を高める効果がある。したがってヒトiPS細胞由来肝細胞でも同様と期待されるが、ヒトiPS細胞由来肝細胞は凝集しづらい傾向があり、U字やV字の96ウェルプレートやハンギングドロップでは思うようにスフェロイドを作製できないことがある。我々が開発してきた細胞凝集技術[10]は、数千個の細胞をメチルセルロース培地の膨潤力を利用して10分程度で強制的に凝集させ、その状態のまま安定的に培養できる。細胞はじっくりと時間をかけて組織化を進めることができるため、特に接着力が弱い細胞を用いてスフェロイド形成を行いたい場合に効果的である[11]。当該技術を用いて、実際にヒトiPS細胞由来肝細胞を比較的安定に培養することができている。
メチルセルロース培地によるスフェロイド作製は、スフェロイドを安定的に作製できるだけではない。細胞の組織化や極性の獲得を補助するような細胞外マトリクスなどの高分子を、スフェロイドを形成する細胞間に薄膜状に充填することもできる[12]。さらには、ハイドロゲルビーズをスフェロイドに混ぜ込むことで、類洞に似た管腔構造をスフェロイド内に作り込み、局所的な細胞密度を下げることも可能としている[13]。これらの要素をうまく組み合わせれば、スフェロイドの内部に微細構造を作り込むことが可能であり、ヒトiPS細胞由来肝細胞の高機能化、高付加価値化を実現できると考えている(図)。例えば、CYP3A4の発現量について、標準的な平面培養と比べて40倍程度増加させることができる条件を見出している。さらなる条件検討によって、より高い機能誘導が期待できることが示されており、早急に誘導条件についての詳細を追求したい。
本事業において我々が想定している問題点は、例えばCYP3A4が高発現する条件が他のすべての肝機能にとっても最適であるとは限らないことである。肝小葉にはもともとmetabolic zonationが存在し、全ての細胞が同じ機能を発現しているわけではない。インビトロでもそれは同じであり、わずかな微小環境の違いによって肝機能が変化する可能性が高い。ユーザーが期待する肝機能に最適な培養条件を探しながら、個別の肝機能発現に特化した種々のスフェロイドの開発を予定している。
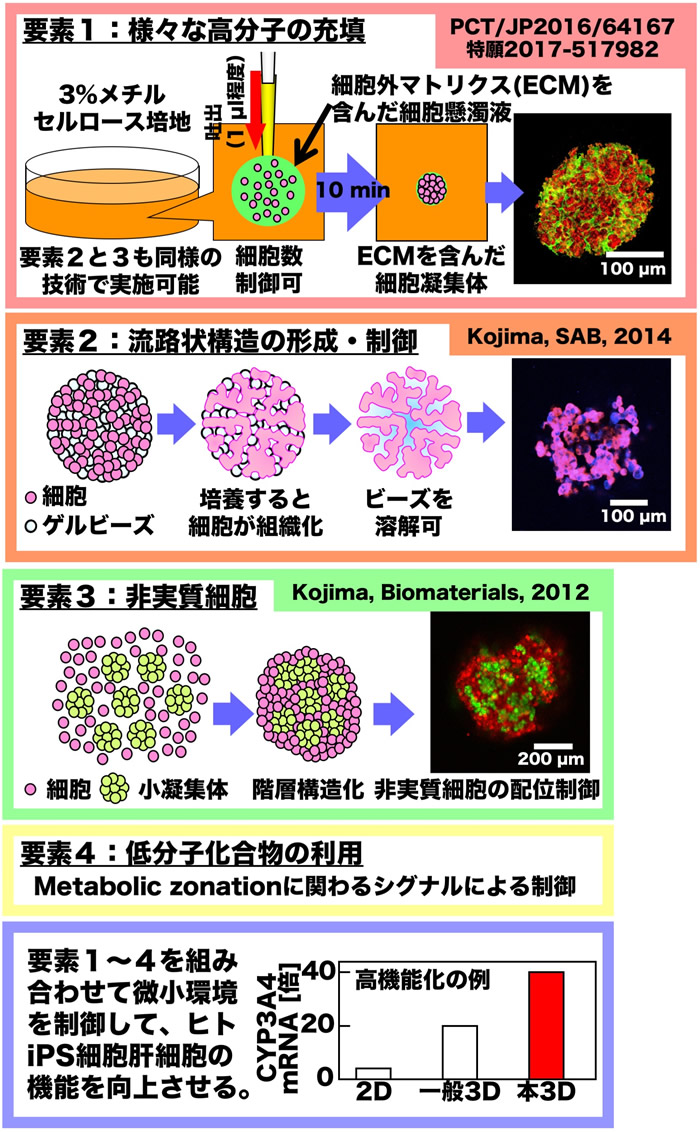
図 ヒトiPS細胞由来肝細胞を高機能化する方法。凝集しづらいヒトiPS細胞由来肝細胞を用いてスフェロイドを作製するために、メチルセルロース培地を用いた凝集法は効果的である。細胞外マトリクスを薄膜状に充填することで、さらにスフェロイドを安定化することや機能を制御すること(要素1)が可能である。メチルセルロース培地を用いると、ハイドロゲルビーズをスフェロイドに混ぜ込んで流路状の空隙を作製すること(要素2)や、非実質細胞を、例えばあらかじめ小さな凝集体にした状態でスフェロイドに混ぜ込むこと(要素3)も可能である。これらの要素をメチルセルロース培地による細胞凝集という共通のフォーマット上で任意に組み合わせ、様々な微小環境を構築できることが重要である。低分子化合物など液性因子による制御(要素4)も併せて、ヒトiPS細胞由来肝細胞の代謝機能を高めるような微小環境の探索に取り組んでいる。
5. まとめ
およそ4年前になるが、肝細胞研究会の研究交流において、メチルセルロース培地による細胞凝集技術を紹介させていただいた。このユニークな細胞凝集技術はじわじわと浸透しており、大学や企業など7施設に技術移転を行い、これらとは別に11施設と共同研究を行っている。本技術の長所は、スフェロイドの直径、細胞外マトリクス充填率(薄膜状、厚膜状、細胞のカプセル化)、ハイドロゲルビーズによる空隙サイズと頻度、といったパラメーターをそれぞれ連続的にチューニングできる自由度の高さにある。肝細胞以外にも神経細胞や膵島細胞、骨髄細胞、腸管上皮細胞、精巣や卵胞を構成する細胞などのスフェロイドあるいはカプセル化培養を実施し、メチルセルロース培地をベースとしたスフェロイドなどの産業的生産システムについても複数の可能性を検討している。スフェロイドなどの三次元培養がうまくいかないという場合は、ぜひお手伝いさせていただければ幸いである。
6. 謝辞
本稿で紹介した研究の一部は、AMED-MPS事業の研究費で得られた成果です。ここに感謝の意を表します。
7. 参考文献
- https://www.weforum.org/agenda/2016/06/top-10-emerging-technologies-2016/
- http://mps.amegroups.com
- https://wyss.harvard.edu/wyss-institute-to-receive-up-to-37-million-from-darda-to-integrate-multiple-organ-on-chip-systems-to-mimic-the-whole-human-body/
- https://ncats.nih.gov/tissuechip/about/faq#money
- https://www.nih.gov/news-events/news-releases/nih-awards-15-million-support-development-3-d-human-tissue-models
- https://www.amed.go.jp/program/list/01/02/007.html
- Huh, D., Matthews, B.D., Mammoto, A., Montoya-Zavala, M., Hsin, H.Y., Ingber, D.E. Reconstituting organ-level lung functions on a chip. Science, 328, 1662-1668 (2010).
- Matsushita, T., Ijima, H., Koide, N., Funatsu, K. High albumin production by multicellular spheroids of adult rat hepatocytes formed in the pores of polyurethane foam. Appl. Microbiol. Biotechnol., 36, 324-326 (1991).
- Yamashita, Y., Shimada, M., Tsujita, E., Tanaka, S., Ijima, H., Nakazawa, K., Sakiyama, R., Fukuda, J., Ueda, T., Funatsu, K., Sugimachi, K. Polyurethane Foam/Spheroid Culture System Using Human Hepatoblastoma Cell Line (Hep G2) as a Possible New Hybrid Artificial Liver. Cell Transplant., 10, 717-722 (2001).
- Kojima, N., Takeuchi, S., Sakai, Y. Rapid aggregation of heterogeneous cells and multiple-sized microspheres in methylcellulose medium. Biomaterials, 33, 4508-4514 (2012).
- Sayo, K., Aoki, S., Kojima, N. Fabrication of bone marrow-like tissue in vitro from dispersed-state bone marrow cells. Regen. Ther., 3, 32-37 (2016).
- 高分子を細胞と共に凝集させる技術, PCT/JP2016/64167, 特願2017-517982
- Kojima, N., Takeuchi, S. and Sakai, Y. Fabrication of microchannel networks in multicellular spheroids. Sensor. Actuat. B-Chem., 198, 249-254 (2014).










