転写因子Bcl6は肝臓の薬物代謝酵素遺伝子群の性差発現を制御する
近田裕美、紙谷聡英
東海大学・医学部・基礎医学系・分子生命科学
はじめに
肝臓は薬物の代謝、外来毒物の分解、栄養素の代謝・吸収・貯蔵、タンパク質の合成等、複数の機能を有しており、生体の恒常性に重要な代謝器官である。肝臓における代謝機能の大半を担う肝細胞は、血清蛋白質や糖・脂質代謝酵素、薬物分解系などの様々な肝機能遺伝子を発現している。一方で胎児期の肝臓は主に造血組織として機能しており、発生過程の進行に伴い臓器の機能がドラスティックに変化することが肝臓の特徴である。我々は、マウス胎仔肝前駆細胞の培養系を確立し発生過程において肝成熟を促進する外的因子の探索を行った結果、インターロイキン6ファミリーのサイトカインであるオンコスタチンM(OSM)や細胞外マトリクスが関与することを報告している(1, 2)。
繊維芽細胞から肝細胞へと直接分化誘導を行うDirect differentiationの研究成果などから、肝細胞へのSpecification等におけるHNF4αやFOXA2等の転写因子群ネットワークの重要性が示された一方で、アミノ酸代謝酵素Tyrosin aminotransferaseや薬物代謝酵素であるCytochrome P450 (Cyp)の発現などに見られる胎仔肝前駆細胞の成熟化・肝機能 の獲得に関わる内在性因子は未だ不明な点が多い。我々は、胎児期から成体における肝発生過程で発現変化する転写調節因子群をマイクロアレイを用いて網羅的に解析し、成熟肝機能の誘導因子の候補とした。得られた候補転写調節因子をマウス胎仔肝前駆細胞分化誘導系に遺伝子導入し、肝機能を誘導可能な因子のスクリーニング を行った。例えば、bHLH型転写因子Mist1 がCyp3a11やCarbamoyl phosphate synthetase (CPS) などの肝機能酵素の発現や活性を上昇させ、肝成熟化に関与することを既に報告している(3)。本総説では、肝機能を制御する新規転写調節因子として同定したC2H2型転写因子B cell lymphoma 6(Bcl6)について解説する(4)。
1、Bcl6は肝臓の薬物代謝酵素遺伝子群の性差発現に必須である。
マウス胎仔肝前駆細胞における肝機能誘導因子の一つとして同定したBcl6は、肝発生過程において発現が顕著に誘導される(図1a)。Bcl6はB細胞等の免疫系細胞の分化や機能に必須の転写因子として報告され、Bcl6欠損マウスはリンパ腫や心筋炎を発症する(5,6)。一方で、この全身性のBcl6欠損マウスは脆弱・短命であり、成熟肝臓でのBcl6の機能解析には適していない。そこで、我々は肝臓で特異的にCreを発現するAlbumin-CreマウスとBcl6-floxedマウスを掛け合わせて、肝臓特異的Bcl6欠損(Bcl6-LKO)マウスを作出し、成体肝臓におけるBcl6の機能を解明することとした。
肝臓の薬物代謝には性差のあることが知られている(7)。ヒトではCYP3Aは女性で活性が高く、薬物のクリアランス速度にも男女間で違いが認められる(8,9)。マウスやラットにおいても、薬物代謝酵素遺伝子群の発現には性差のあることが報告されている。例えば、マウスではCyp2d9はオス優位に発現し(10)、Cyp3a41はメス優位に発現する(11)。このような薬物代謝酵素遺伝子群の発現性差は、血中成長ホルモン(GH)のプロファイルに制御されることが報告されている(12)。血中GH濃度は、オスではパルス的に濃度の高い時間とほとんど検出されない時間が繰り返されるのに対して、メスでは濃度が低いながらも常に一定量が検出される。この違いにより、GHシグナル制御下のSTAT5bのリン酸化に性差が生じ、遺伝子発現プロファイルを制御すると考えられている(13)。しかし、遺伝子発現の性差を制御する詳細な分子機能や他に介在する因子群等は不明な点が多かった。
我々はマイクロアレイを用いたBcl6-LKOマウスの網羅的遺伝子発現解析を行い、Bcl6が肝臓における遺伝子発現プロファイルの性差の維持に必要なことを見出した。特にBcl6欠損オス肝臓では野生型メス肝臓に近いCytochrome P450群(Cyps)の発現プロファイルを示した(図1b)。
Cyp群の発現性差をリアルタイムPCR法によって解析した。オス優位に発現しているCyp2d9, Cyp2u1, Cyp4a12a/12b, Cyp7b1遺伝子は、Bcl6欠損によりオス肝臓でもメスレベルまで発現低下した(図2a)。同様にメス優位のCypsとして、Cyp2a4/2a5、Cyp2b9, Cyp2b10, Cyp2b13, Cyp3a16, Cyp3a41, Cyp3a44, Cyp17a1を測定した結果、これらの遺伝子群はメス優位に発現していたが、Bcl6欠損オス肝臓では野生型のオス肝臓に比べて高い発現が見られるようになる (図2b)。Bcl6による遺伝子発現制御が実際の酵素活性にまで反映されているかを検証するために、メス優位の発現を示すCYP2B活性を肝細胞初代培養系を用いて測定した。CYP2Bの活性はオス肝臓由来細胞に比べてメス細胞で高く、オスBcl6-LKOマウス肝臓由来細胞でもオス野生型マウス細胞に比べて有意に高かった(図2c)。以上の結果は、Bcl6が肝臓の薬物代謝活性をオス型に維持するのに重要な転写因子であることを示しており、Bcl6における性差制御機構の存在が示唆された。
2、肝臓のBcl6は体全体の性差への影響は少なく、肝臓に限局して性差を制御する。
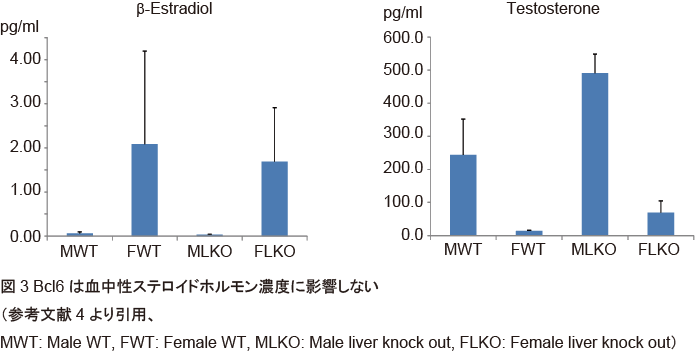
上記の結果から、Bcl6-LKOマウスでは肝臓における遺伝子発現の性差が変化していることが明らかとなった。そこで次に、性ホルモンなどの全身状態における性別がBcl6の肝臓特異的欠損で変化するか解析を行った。血中性ホルモン濃度を測定した結果、女性ホルモン(β-Estradiol)、男性ホルモン(Testosterone)ともに、野生型およびBcl6-LKOマウスでの発現性差の変化は見られなかった(図3)。
また、Bcl6-LKOマウスの生殖能力を交配によって評価した結果、オス、メスマウス共に正常な交配が可能で得られた産仔も正常であった(表1)。以上の結果から、Bcl6の肝臓における欠損は、全身性の性差や生殖能力は変化させず、肝臓における性特異的発現のみを変化させることが示唆された。
| Male | Female | Resulting genotype | |||
|---|---|---|---|---|---|
| Male Bcl6lox/lox | Male Alb-Cre + Bcl6lox/lox | Female Bcl6lox/lox | Female Alb-Cre + Bcl6lox/lox | ||
| Bcl6lox/lox | Alb-Cre + Bcl6lox/lox | 60 | 52 | 45 | 50 |
| Alb-Cre + Bcl6lox/lox | Bcl6lox/lox | 36 | 44 | 30 | 39 |
まとめ
Bcl6は薬物代謝酵素Cypsの性差発現の維持、特にオスにおいてオス型の発現プロファイルを維持するのに重要であった。さらに肝臓のBcl6は血中性ホルモン濃度や生殖能力といった体全体の機能的な性差には影響せず、肝臓に限局して性差を制御していることが考えられた。これらのことから、Bcl6-LKOマウスを用いることで、体全体の性差の影響を受けずに、肝臓の性差を考慮した薬物代謝の評価に応用できると考えられる。
参考文献
- Kamiya, A, Kinoshita T, Ito Yet al: Fetal liver development requires a paracrine action of oncostatin M through the gp130 signal transducer. Embo Journal 1999; 18:2127-2136.
- Kamiya A, Kojima N, Kinoshita T et al: Maturation of fetal hepatocytes in vitro by extracellular matrices and oncostatin M: Induction of tryptophan oxygenase. Hepatology 2002; 35:1351-1359.
- Chikada H, Ito K, Yanagida A et al: The basic helix-loop-helix transcription factor, Mist1, induces maturation of mouse fetal hepatoblasts. Sci Rep2015; 5:14989.
- Chikada H, Ida K, Ando E et al:Establishment and analysis of a mouse model that regulates sex-related differences in liver drug metabolism. Lab Invest 2018; Epub ahead of print
- Dent AL, Shaffer AL, Yu X et al: Control of inflammation, cytokine expression, and germinal center formation by BCL-6. Science1997; 276:589-592.
- Yoshida T, Fukuda T, Hatano M et al: The role of Bcl6 in mature cardiac myocytes. Cardiovasc Res1999; 42:670-679.
- Renaud HJ, Cui JY, Khan M et al: Tissue distribution and gender-divergent expression of 78 cytochrome P450 mRNAs in mice. Toxicol Sci2011; 124:261-277.
- Hunt CM, Westerkam WR, Stave GM: Effect of age and gender on the activity of human hepatic CYP3A. Biochem Pharmacol1992; 44:275-283.
- Lew KH, Ludwig EA, Milad MA et al: Gender-based effects on methylprednisolone pharmacokinetics and pharmacodynamics. Clin Pharmacol Ther1993; 54:402-414.
- Jarukamjorn K, Sakuma T, Jaruchotikamol A et al: Regulation of mouse hepatic CYP2D9 mRNA expression by growth and adrenal hormones. Drug Metab Pharmacokinet2006; 21:29-36.
- Sakuma T, Takai M, Endo Y et al: A novel female-specific member of the CYP3A gene subfamily in the mouse liver. Arch Biochem Biophys2000; 377:153-162.
- Waxman DJ, O'Connor C: Growth hormone regulation of sex-dependent liver gene expression. Mol Endocrinol2006; 20:2613-2629.
- Waxman DJ, Ram PA, Park SH et al: Intermittent plasma growth hormone triggers tyrosine phosphorylation and nuclear translocation of a liver-expressed, Stat 5-related DNA binding protein. Proposed role as an intracellular regulator of male-specific liver gene transcription. J Biol Chem1995; 270:13262-13270.