研究交流
異常肝細胞排除による品質管理機構
宮村憲央、石原えりか、仁科博史
東京医科歯科大学難治疾患研究所 発生再生生物学分野
はじめに
摂取された食べ物やアルコール、薬や有害物質などは消化管から取り込まれ、肝臓へ運ばれる。肝臓はこれら物質の代謝や解毒を担う生命維持に必須の器官である。肝臓の細胞はこうした生理機能上、常に様々なストレスにさらされている。ストレスは細胞の老化や損傷を誘導する。これら異常細胞は組織の機能不全や腫瘍形成の原因となるため、排除する必要がある。しかしながら、肝臓における異常細胞の排除機構については不明な点が多く残されている。本稿では老化肝細胞および、最近我々が見出した傷害肝細胞の排除機構について概説する。
老化肝細胞の排除
Kangらは、マウス肝臓においてがん遺伝子Rasによって誘導される老化肝細胞の動態を解析した1。水圧によって外来遺伝子を細胞へ導入するHydrodynamic tail vein injection (HTVi)法と、外来遺伝子をゲノムへ挿入するSleeping Beauty法を組み合わせることで、野生型マウスの肝臓へモザイク状に活性型Ras遺伝子を導入した。その結果、活性型Ras発現肝細胞の細胞老化が6日目までに誘導され、60日までに肝臓からほぼ消失した(図1)。次に、老化肝細胞消失の原因探索が行われた。HE染色の結果、活性型Ras発現老化肝細胞の周囲には免疫系細胞の集積が観察された。B, T細胞の機能不全を呈するSCID/beige免疫不全マウスでは、活性型Ras発現老化肝細胞の消失は抑制された。さらにフローサイトメトリーによる集積免疫系細胞の表面抗原解析ではCD4陽性T細胞およびCD8陽性T細胞が増加していることから、CD4またはCD8ノックアウトマウスを用いた解析の結果、CD4の欠損でのみ老化肝細胞の消失は抑制された。興味深いことに、活性型Ras発現老化肝細胞の排除が生じないマウスでは、4か月後には肝細胞がんを発症した。以上の結果から、活性型Rasの発現によって誘導された老化肝細胞は、CD4陽性T細胞依存的に排除されること、活性型Ras発現老化肝細胞の残存はがん発症の原因となることが示された。

図1、活性型Rasの発現によって誘導される老化肝細胞の排除
活性型Rasの発現によって肝細胞は細胞老化する。活性型Ras発現老化肝細胞の周囲に、CD4陽性T細胞が集積する。活性型Ras発現老化肝細胞は、単球細胞によって貪食され肝臓から排除される。一方、獲得免疫が不全になると、活性型Ras発現肝細胞は細胞増殖し肝がんを発症する。
傷害肝細胞の排除
近年、肝臓のサイズを制御するシグナルとしてHippo-YAPシグナル伝達経路が注目されている2, 3。Hippoシグナルは、転写共役因子YAPをリン酸化し細胞質に局在化させる(図2)。非リン酸化状態のYAPは、核内でTEADなどの転写因子と結合し、細胞増殖に関与する標的遺伝子の発現を誘導する。HippoシグナルのノックアウトマウスやYAPのトランスジェニックマウスの解析によって、肝臓全体におけるYAPの活性化は肝肥大と肝がんを誘導することが示された4-6。しかしながら、YAP活性化肝細胞の詳細な動態は不明な点が多い。
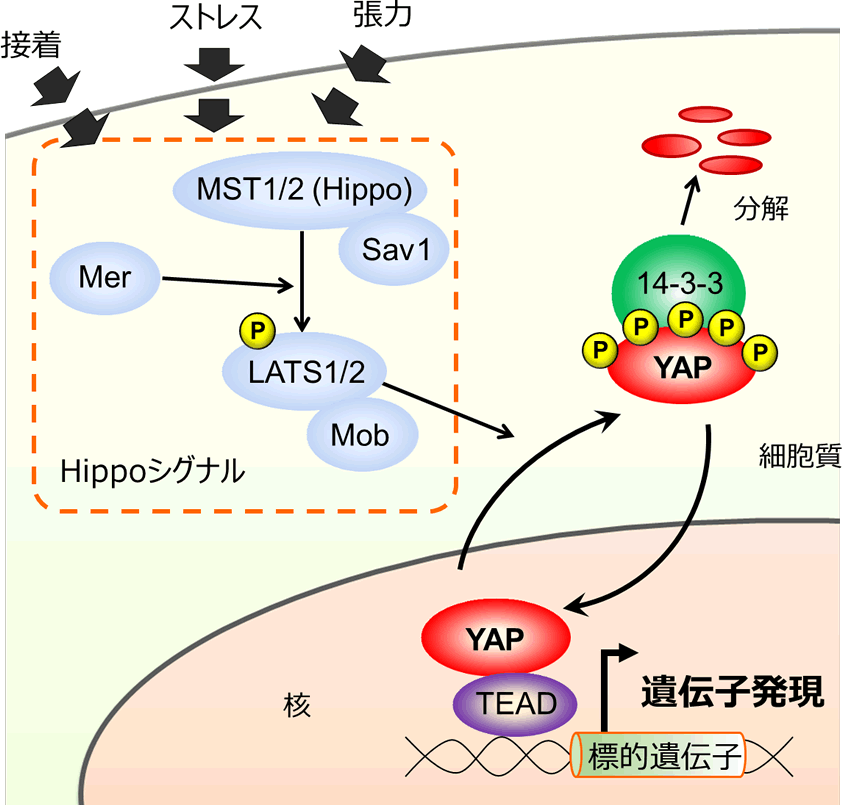
図2、Hippo-YAPシグナル伝達経路
MST1/2(ショウジョウバエにおけるHippo)、Sav1、LATS1/2、Mob、Merなどから構成されるHippoシグナルは、細胞接着やストレス、張力刺激などで活性化し、YAPをリン酸化する。リン酸化型YAPは14-3-3と結合し細胞質へ局在化し、分解される。脱リン酸化型のYAPは核内へ移行し、転写因子TEADと結合し、遺伝子発現を誘導する。
我々は肝臓におけるYAP活性化細胞の動態を明らかにするため、マウス肝臓でモザイク解析を行った7。その結果、アデノウイルスベクターを用いて肝臓内の約30%の肝細胞に活性型YAPを発現させると、体重に対する肝重量の割合(肝サイズ)が通常の6%から7日間で10%まで肥大し、活性型YAP発現肝細胞は増殖した(図3A)。過去に報告されているようにYAPによる細胞増殖の誘導が観察された。一方、HTVi法を用いて活性型YAPを発現させた場合は、肝サイズは6%のまま変化しなかった(図3B)。興味深いことに、1日目に約30%存在した活性型YAP発現肝細胞は、7日間で約3%まで減少した。YAP活性化肝細胞が増殖せずに逆に減少するという現象はこれまでに報告されておらず、本現象は新規の細胞応答であると考えられた。次に、細胞数減少の原因探索を行った。B,T細胞欠失等の重度免疫不全を呈するNOGマウスにHTVi法を用いて遺伝子導入を行うと、やはりYAP活性化肝細胞は減少することから、老化肝細胞排除と異なり獲得免疫非依存的な機構であることが示された。組織染色を行った結果、YAP活性化肝細胞は、類洞へ細胞移動し、アポトーシスを起こした後、クッパー細胞によって貪食され、排除されることが判明した(図4)。
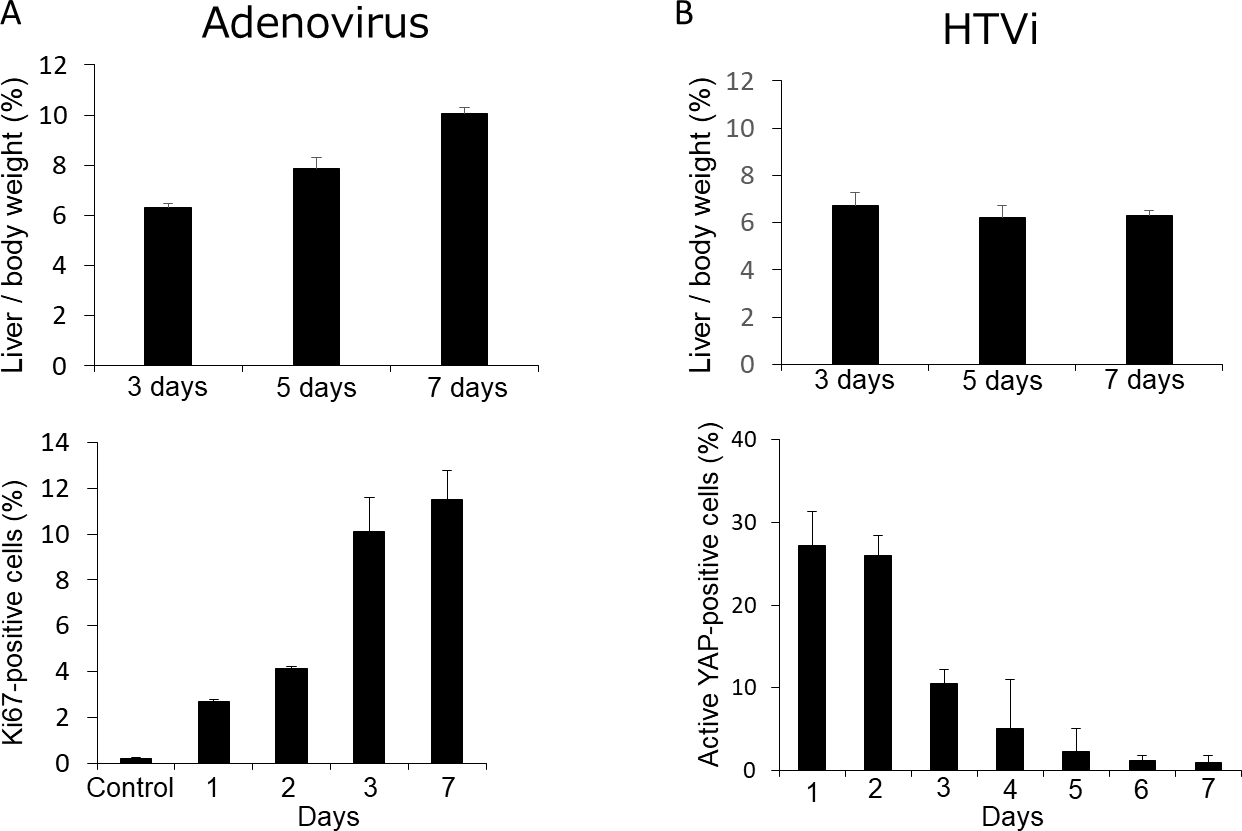
図3、YAP活性化肝細胞の細胞動態
A、アデノウイルスベクター用いて肝細胞で活性型YAPを発現させると、体重に対する肝重量の割合が、通常の6%から7日間で10%まで増大した。活性型YAP発現肝臓ではコントロール肝臓と比べ、Ki67陽性肝細胞が増加した。B、HTVi法を用いて活性型YAPを発現誘導すると、肝サイズが6%のまま変化しなかった。約30%存在した活性型YAP発現肝細胞が7日間で約3%に減少した。
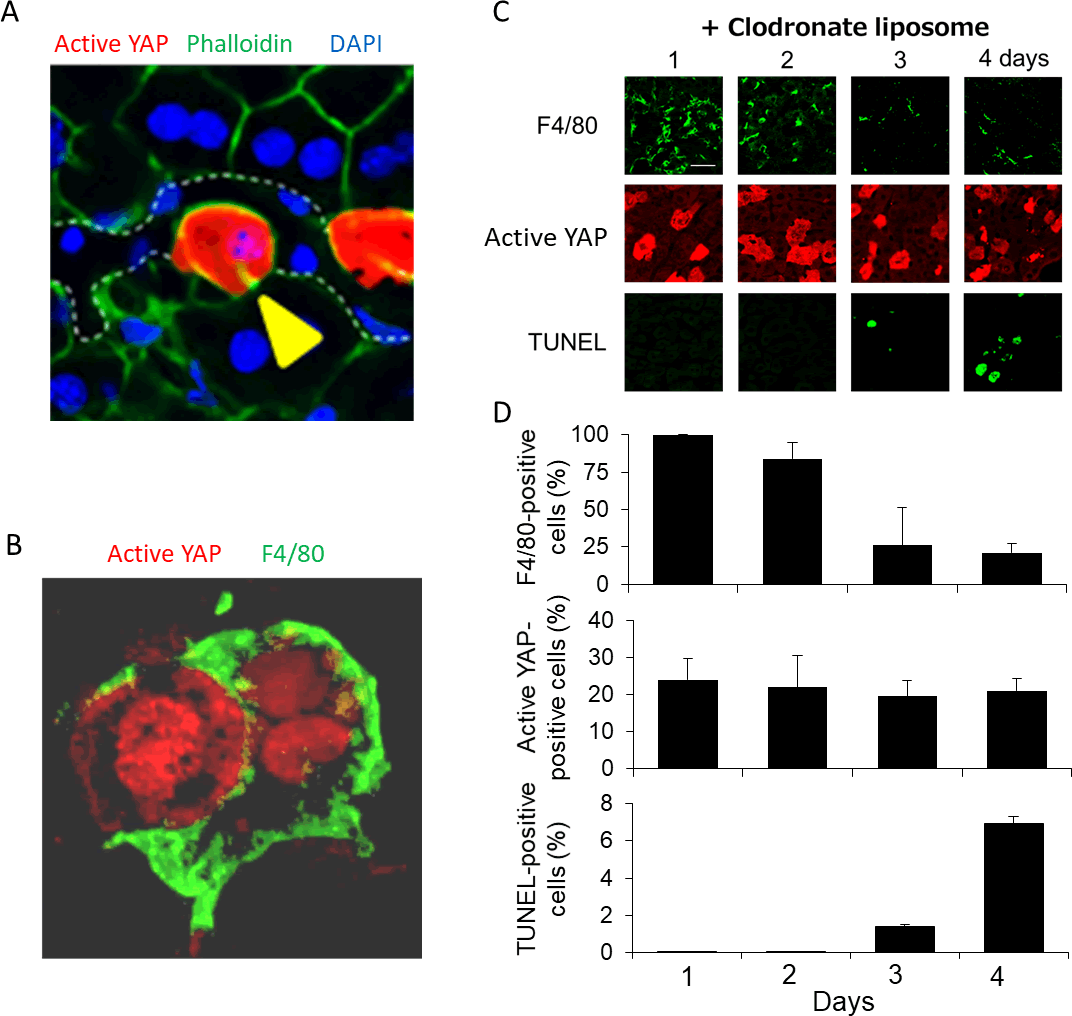
図4、HTVi法で誘導したYAP活性化肝細胞の細胞動態
A、活性型YAP誘導3日目に活性型YAP発現肝細胞(赤色)が類洞(白破線)内に突出した。緑色はファロイジンによるF-アクチンの染色。青色はDAPIによる核の染色。B、活性型YAP発現肝細胞(赤色)がクッパー細胞(緑色)によって貪食された。C、クロドロネートリポソームを用いてクッパー細胞を除去すると(上段)、活性型YAP発現肝細胞の排除が抑制され(中段)、TUNEL陽性肝細胞が出現した(下段)。D、Cの組織染色の定量結果。
アデノウイルスベクターとHTVi法で異なる細胞応答が誘導された原因は何か?我々は、遺伝子導入の際に肝傷害が生じるか否かの違いが、YAP活性化肝細胞の応答の違いの原因ではないかと考えた。そこで、アデノウイルスベクターを用いて活性型YAPを発現誘導した後に、肝臓へ各種傷害を加え、細胞増殖から細胞排除へ表現型が変化するか否かを検討した。その結果、CCl4付加で肝細胞に、モノクロタリン付加で類洞内皮細胞にそれぞれ特異的に傷害を与えた場合には、細胞排除は誘導されなかった。一方、HTVi法の手技やエタノールの付加によって、肝細胞と類洞内皮細胞の両者に傷害を与えた場合には細胞排除は誘導された(図5A)。次に分子メカニズムの解析を行った。YAP変異体解析の結果、YAPと転写因子TEADとの結合が必須であった。マイクロアレイ解析の結果、細胞移動を制御する低分子量Gタンパク質CDC42やRacの活性化が必須であった。さらに遺伝子発現解析の結果、CDC42やRacの活性化因子GEFであるEct2とFgd3が細胞排除の生じる条件で特異的に発現誘導された(図5B)。これらの結果から、類洞内皮細胞と肝細胞の両者への傷害が加わった場合に、YAP-TEAD依存的にEct2やFgd3などの遺伝子発現が誘導され、傷害肝細胞が排除されることが示唆された。

図5、肝細胞の増殖と傷害肝細胞の排除
A、YAPは肝細胞を増殖させる(左)。一方、傷害を受けた肝細胞では、YAPは肝細胞の排除を誘導する(右)。B、転写因子TEAD依存的に、Ect2とFgd3が発現誘導され、CDC42やRacが活性化し、細胞骨格の変化が生じ、傷害肝細胞は排除される。
おわりに
Ras誘導性の老化肝細胞は、獲得免疫を用いて一週間以上かけて排除される。一方、YAP活性化傷害肝細胞は、クッパ―細胞を用いて数日以内に迅速に排除される。傷害肝細胞の場合は、炎症誘導分子などを放出する危険があるため、肝臓内から迅速に排除される必要がある。肝臓ではHippoシグナルは恒常的に活性化し、YAPをリン酸化し、不活性化している。ストレスなどによってHippoシグナルが不活性化されると、YAPは脱リン酸化状態となり、核内へ移行し、機能を発揮する。Hippo-YAPシグナルは傷害肝細胞を迅速に除去する品質管理のセンサーとしての役割を担っていると考えられる。
我々は哺乳動物培養細胞を用いて、正常な上皮細胞中に異常なYAP活性化細胞が生じると、YAP活性化細胞が頂端側に排除されることを報告した8。この細胞応答は、獲得免疫のないショウジョウバエで発見された細胞競合(Cell competition)と類似の現象と考えられている。一方、本研究で見出されたYAP活性化肝細胞の排除では、傷害刺激が必要であり、細胞競合との類似性については検討を要する。
マウスのみならずヒトにおいても、YAPは肝線維症や肝がんの悪性化に寄与することが報告されている9-11。すなわち、YAPはがん原遺伝子として機能する。一方、傷害依存的YAP活性化肝細胞の排除は、YAPのがん抑制遺伝子としての機能を示唆する。YAPはこれら二面性を外環境の状況に応じて使い分け、肝サイズや細胞品質の制御を行っていると考えられる。
参考文献
- Kang TW, Yevsa T, Woller N, Hoenicke L, Wuestefeld T, Dauch D, Hohmeyer A, Gereke M, Rudalska R, Potapova A, et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature 2011; 479:547-51.
- Pan D. The hippo signaling pathway in development and cancer. Developmental cell 2010; 19:491-505.
- Meng Z, Moroishi T, Guan KL. Mechanisms of Hippo pathway regulation. Genes & development 2016; 30:1-17.
- Dong J, Feldmann G, Huang J, Wu S, Zhang N, Comerford SA, Gayyed MF, Anders RA, Maitra A, Pan D. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell 2007; 130:1120-33.
- Zhou D, Conrad C, Xia F, Park JS, Payer B, Yin Y, Lauwers GY, Thasler W, Lee JT, Avruch J, et al. Mst1 and Mst2 maintain hepatocyte quiescence and suppress hepatocellular carcinoma development through inactivation of the Yap1 oncogene. Cancer cell 2009; 16:425-38.
- Song H, Mak KK, Topol L, Yun K, Hu J, Garrett L, Chen Y, Park O, Chang J, Simpson RM, et al. Mammalian Mst1 and Mst2 kinases play essential roles in organ size control and tumor suppression. Proceedings of the National Academy of Sciences 2010; 107:1431-6.
- Miyamura N, Hata S, Itoh T, Tanaka M, Nishio M, Itoh M, Ogawa Y, Terai S, Sakaida I, Suzuki A, et al. YAP determines the cell fate of injured mouse hepatocytes in vivo. Nature communications 2017; 8:16017.
- Chiba T, Ishihara E, Miyamura N, Narumi R, Kajita M, Fujita Y, Suzuki A, Ogawa Y, Nishina H. MDCK cells expressing constitutively active Yes-associated protein (YAP) undergo apical extrusion depending on neighboring cell status. Scientific Reports 2016; 6:28383.
- Yu FX, Zhao B, Guan KL. Hippo Pathway in Organ Size Control, Tissue Homeostasis, and Cancer. Cell 2015; 163:811-28.
- Johnson R, Halder G. The two faces of Hippo: targeting the Hippo pathway for regenerative medicine and cancer treatment. Nature reviews Drug discovery 2014; 13:63-79.
- Yimlamai D, Fowl BH, Camargo FD. Emerging evidence on the role of the Hippo/YAP pathway in liver physiology and cancer. Journal of hepatology 2015; 63:1491-501.










