研究交流
線維肝におけるAFP陽性細胞はどこにいて何をしているのか?
中野 泰博、稲垣 豊
東海大学大学院医学研究科マトリックス医学生物学センター
はじめに
Alpha-fetoprotein(AFP)は、肝発生における肝前駆細胞や肝癌細胞のマーカー分子として広く知られている(1)。また、重度な線維肝の患者の血清中でも検出されるが(2)、その産生細胞がどこにいて何をしているかは不明瞭であった。
線維肝の再生では、健常な肝臓のそれと比べ、成熟肝細胞の細胞増殖能が顕著に低下しており(3)、しばしば肝再生不全を生じることが臨床上のひとつの課題である。また、線維肝の再生時には、肝前駆細胞が動員され、再生に寄与する説が提唱されているが(4)、その詳細は分かっていない。そこで我々は、この肝前駆細胞がAFPを産生していると考え、AFP陽性細胞の同定と機能について解析した(5)。
1. 線維肝におけるAFP陽性細胞は線維束に沿うように存在する
我々はまず、マウスに対して四塩化炭素(CCl4)を反復投与することで、線維肝モデルを作製した。その肝組織を解析したところ、線維束を形成するαSMA陽性筋線維芽細胞に隣接するように、AFP陽性細胞が多数認められた(図1A)。
次に、肝前駆細胞(Sox9, CD44, EpCAM)、肝細胞(Albumin, Hnf4α)、胆管細胞(CK19, Hnf1β)各々のマーカー分子と二重染色した結果、AFP陽性細胞はSox9+/-AlbuminlowHnf4α+(他は陰性)であり、肝細胞に近い特徴を示していた。また、AFP産生細胞の多くはPCNAが陽性であり、増殖能の高い細胞であることが明らかになった(図1B)。
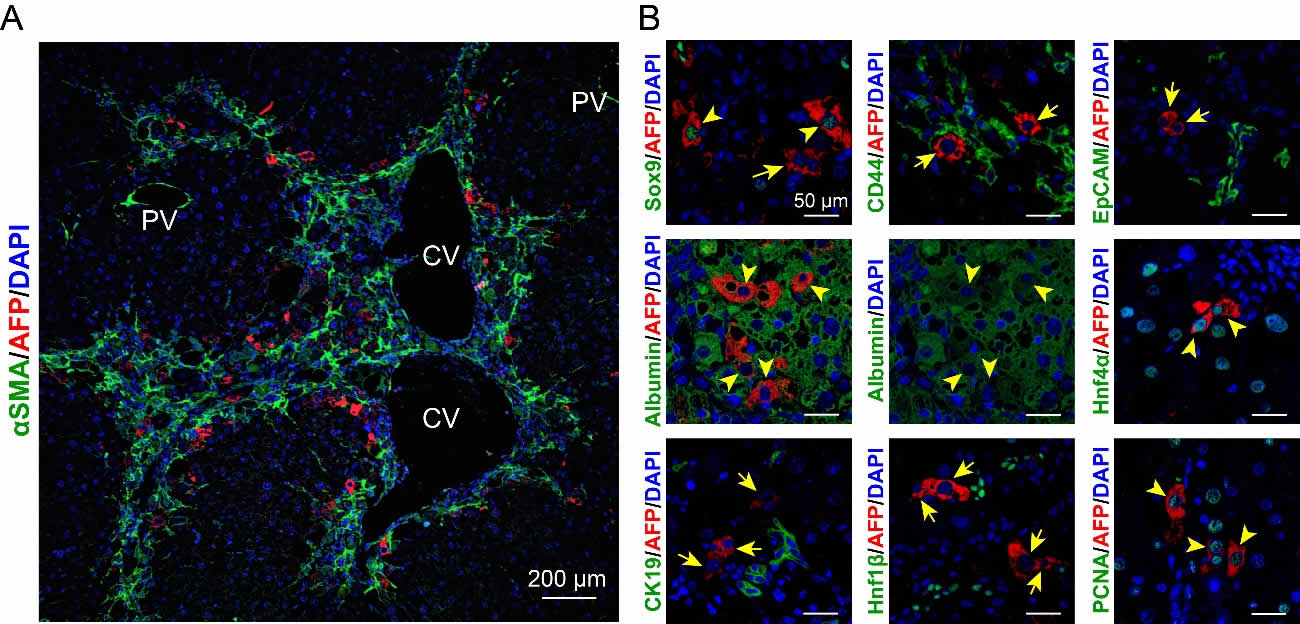
図1. マウス線維肝におけるAFP陽性細胞の同定
(A)αSMAとAFPの二重染色(蛍光免疫染色法)。(B)AFPと種々のマーカー分子との二重染色(矢頭はAFPとマーカー分子の共陽性を、矢印はAFP単独陽性を示す;同一視野でのAlbumin単染色を含む)。(参考文献5より改変して引用)
2. AFP陽性細胞はJagged1/Notchシグナルの活性化によって動員される
Sox9の発現は、Notchシグナルによって直接的な制御を受けることから(6)、Notchリガンドの発現を解析したところ、線維肝ではJag1遺伝子の発現が上昇していた(図2A)。また、Jagged1の発現はαSMA陽性筋線維芽細胞に強く認められ、それに隣接するAFP陽性細胞にはNotchシグナルの活性化指標であるHes1が発現していた(図2B)。これらのことから、AFP陽性細胞には、筋線維芽細胞のJagged1をリガンドとしたNotchシグナルが活性化していることが示唆された(図2C)。
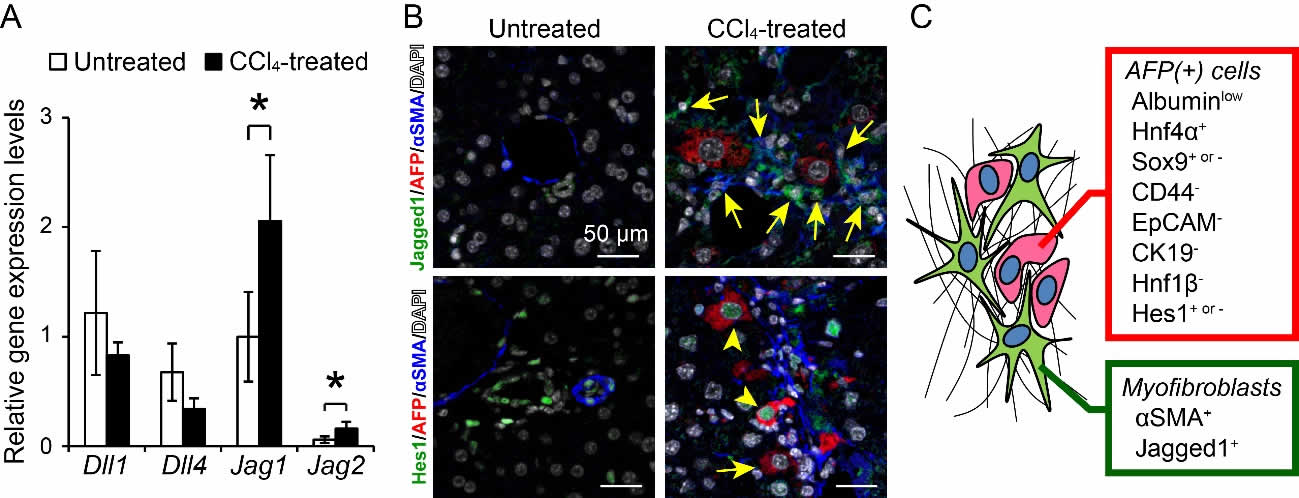
図2. 筋線維芽細胞のJagged1発現とAFP陽性細胞のNotchシグナル活性化
(A)定量RT-PCRによる正常肝および線維肝におけるNotchリガンドのmRNA量解析。(B)正常肝および線維肝のJagged1とHes1の発現。(C)AFP陽性細胞と筋線維芽細胞に発現する分子。(参考文献5より改変して引用)
次に、Mx-CreによってJag1遺伝子を後天的に欠損させた(Jag1 cKO)マウスに対して、肝線維化を誘導した。その組織像は、対照マウスと比べ、線維化の度合いや細胆管の増生には差を認めなかったが、AFP陽性細胞数およびAfp遺伝子の発現量が顕著に減少していた(図3A-C)。これよりJagged1/NotchシグナルがAFP陽性細胞の動員に必要であることが示された。
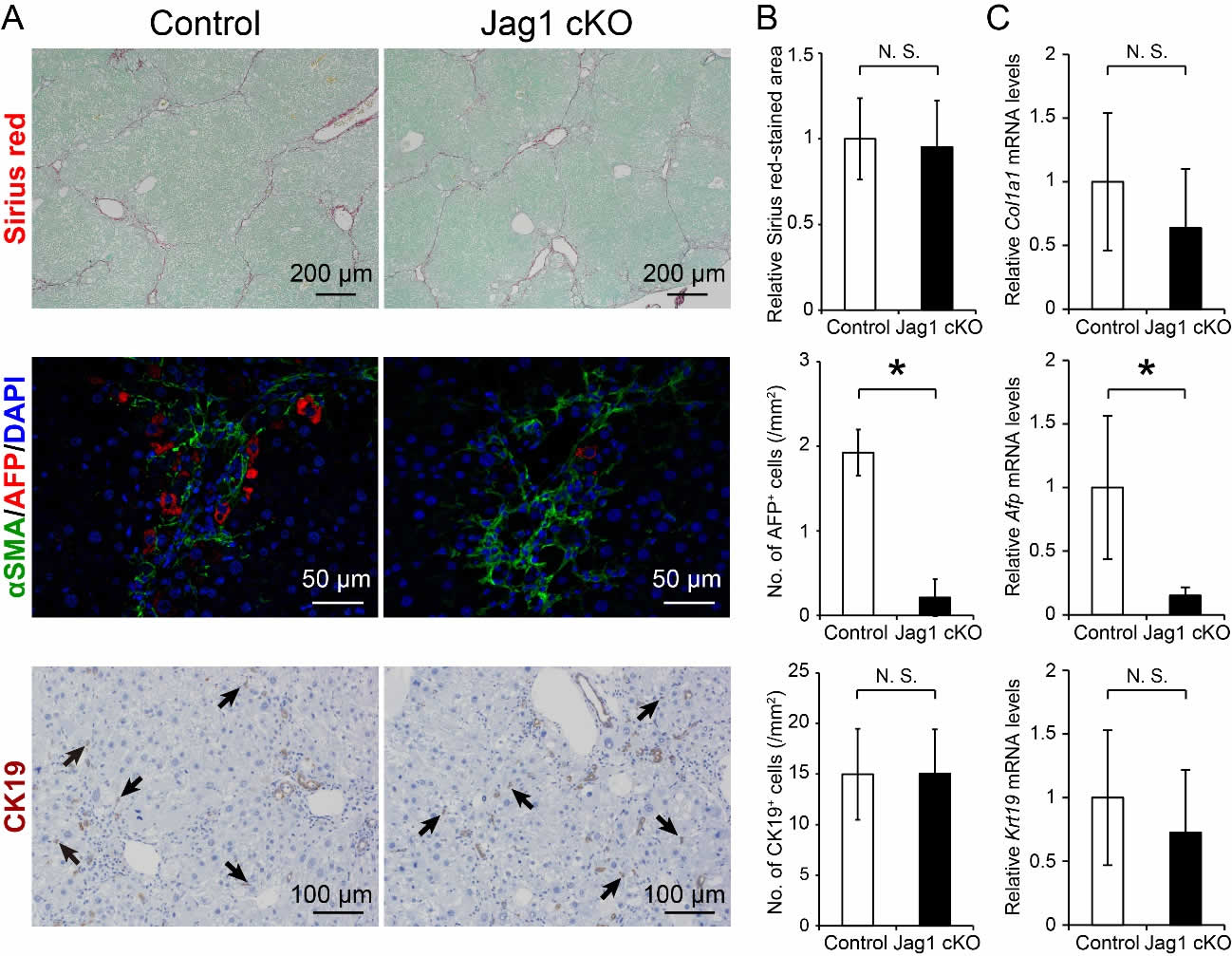
図3. Jag1 cKOマウス線維肝におけるAFP陽性細胞の消失
(A)対照マウスおよびJag1 cKOマウスの線維肝の組織学的解析。(B)染色面積比(Sirius red)および単位面積当たりのAFP、CK19陽性細胞数。(C)定量RT-PCRによるCol1a1、Afp、Krt19のmRNA発現量解析。(参考文献5より改変して引用)
3. AFP陽性細胞は活発に増殖することで線維肝の再生に寄与する
肝線維化を誘導したJag1 cKOマウスに対して、70%部分肝切除を行い、その再生能を評価した。線維肝切除から7日後、Jag1 cKOマウスは対照マウスに比して、生存率が有意に減少していた(図4A)。次に、切除後2日の肝組織を採取し、AFP陽性細胞とその増殖性について解析した。対照マウスの肝組織にはBrdU陽性のAFP陽性細胞が多くみられ、これらは肝内で増殖する細胞の主体を占めていた(図4B, C)。一方、Jag1 cKOマウスの肝組織ではAFP陽性細胞がごく少数しか存在せず、これにより全体のBrdU陽性細胞も顕著に低下していた(図4B, C)。このことから、AFP陽性細胞は、自身の細胞増殖を活発にすることで、線維肝の再生に寄与することが示された。
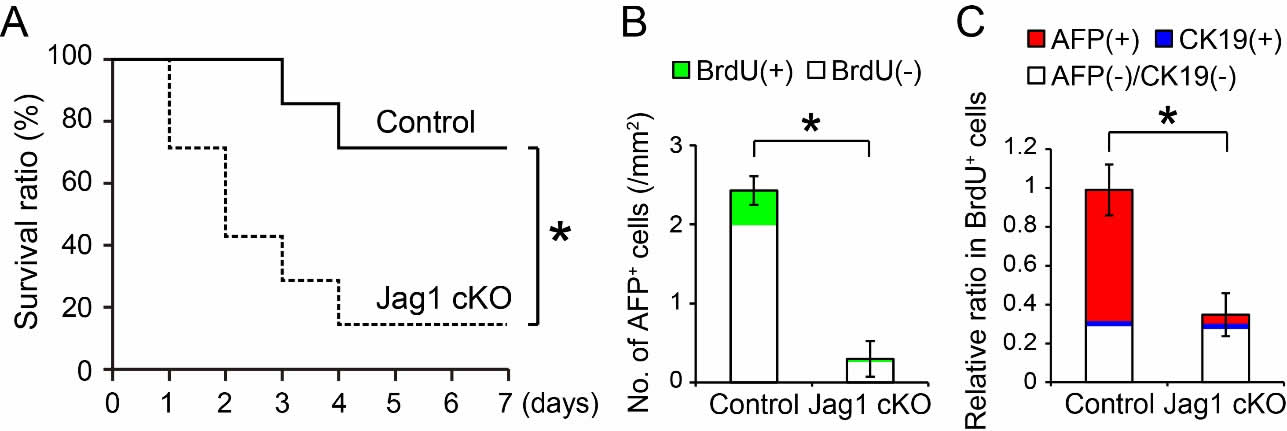
図4. 線維肝再生におけるAFP陽性細胞の役割
(A)対照マウスおよびJag1 cKOマウスの線維肝を70%部分切除した後の生存曲線。(B, C)部分肝切除から2日の肝組織におけるAFP陽性細胞数および BrdU陽性細胞の比率。(参考文献5より改変して引用)
4. Notch2シグナルの活性化が成熟肝細胞をAFP陽性細胞へと誘導する
マーカー分子の発現などから、AFP陽性細胞の起源は成熟肝細胞だと考えられた。実際に我々は、活性化肝星細胞と共培養することで、成熟肝細胞からAFP陽性細胞を誘導できることを明らかにした(図5Aおよび図5B, CのControl)。次に、Jag1 cKOマウスより単離した活性化肝星細胞を用いて同様のin vitro実験を行ったところ、Afp遺伝子の発現誘導は完全にキャンセルされた(図5B, Jag1 cKO)。さらに、Alb-CreによるNotch2欠損成熟肝細胞を用いた際も、この誘導は起こらなかった(図5C, Notch2 cKO)。
また、生体内でも同様の誘導が起こるかを検討するため、正常マウスに対して、Notch2細胞内ドメイン発現プラスミド(NICD2-IRES-EGFP)をハイドロダイナミックインジェクションによって、成熟肝細胞へ遺伝子導入したところ、一部の成熟肝細胞からAFP陽性細胞が誘導された(図5D)。
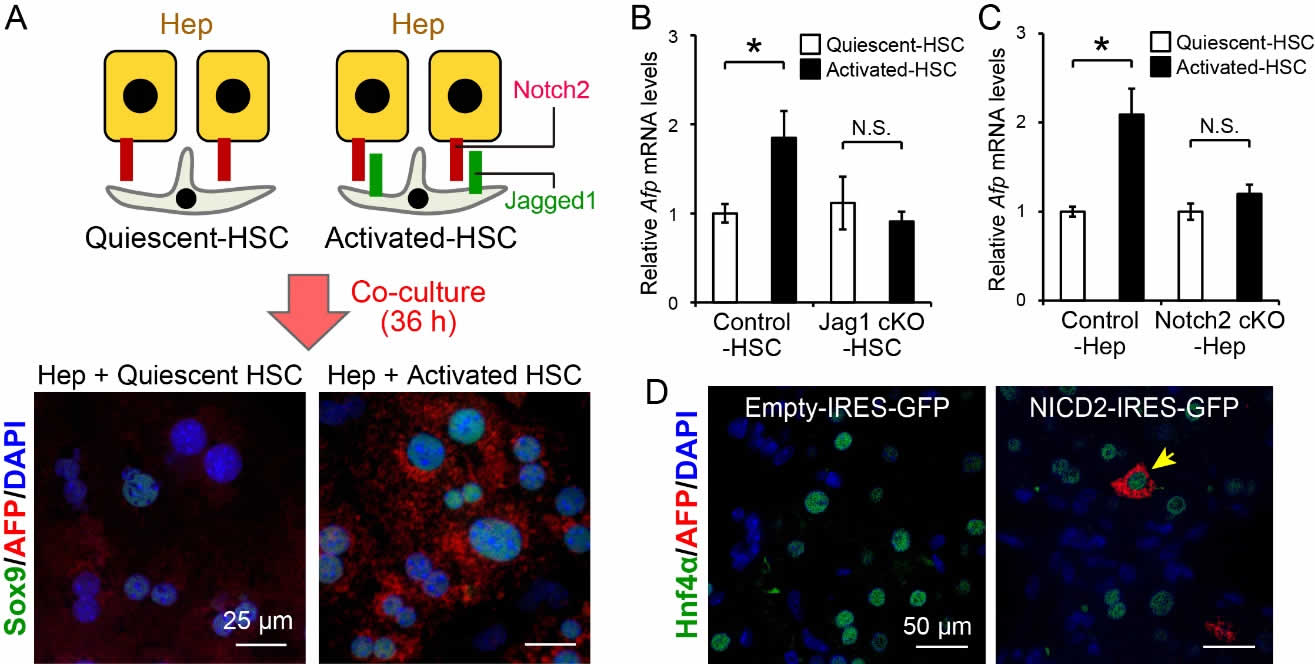
図5. Jagged1/Notch2シグナルによる成熟肝細胞からのAFP陽性細胞の誘導
(A)静止期肝星細胞(Quiescent-HSC, Jagged1陰性~弱陽性)または活性化肝星細胞(Activated-HSC, Jagged1強陽性)と成熟肝細胞(Hep)の共培養。活性化肝星細胞との共培養によるAFP+Sox9+細胞の出現。(B)Jag1欠損肝星細胞と対照マウス肝細胞との共培養におけるAfpのmRNA発現変化。(C)対照マウス肝星細胞とNotch2欠損成熟肝細胞との共培養におけるAfpのmRNA発現変化。(D)正常肝へのNICD2-IRES-EGFPの導入によるAFP陽性細胞の誘導。(参考文献5より改変して引用)
おわりに
線維肝における筋線維芽細胞で発現するJagged1は、隣接する成熟肝細胞のNotch2シグナルを活性化させ、これらをAFP陽性細胞に変化させた。また、AFP陽性細胞は、線維肝の再生時に活発に増殖し、再生に寄与することが示された(図6)。
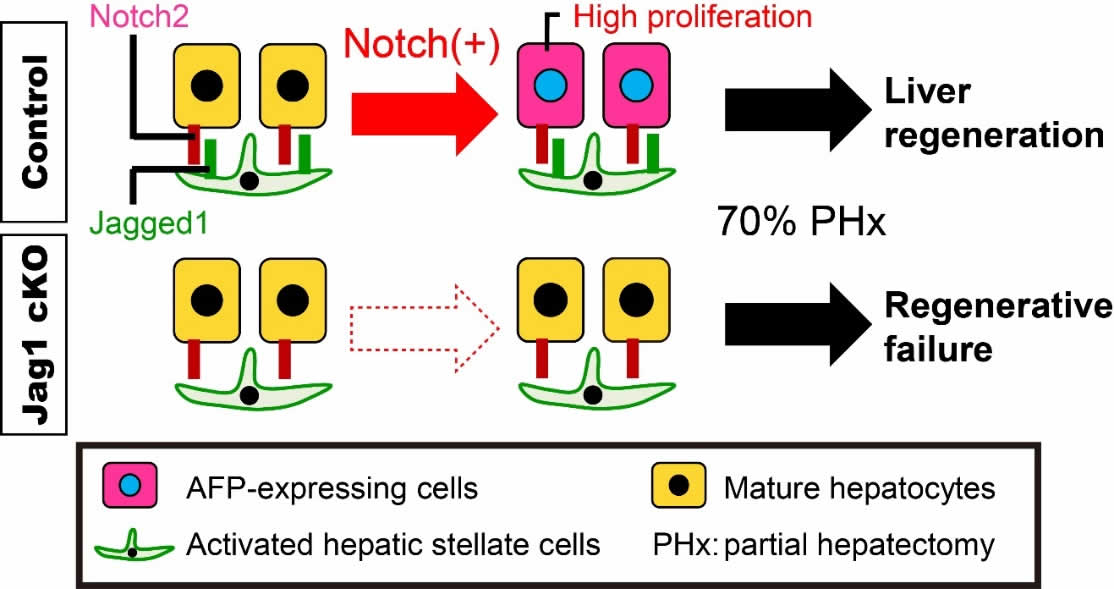
図6. 本研究のまとめ
線維肝におけるAFP陽性細胞は、Jagged1/Notch2シグナルによって動員され、肝再生時には自身の細胞増殖を活発にすることで、線維肝の再生に寄与することが明らかとなった。
謝辞
本研究の共同研究者の皆様、日々深いディスカッションを重ねてくださる川口義弥先生(京都大学iPS細胞研究所)に、この場を借りて深くお礼申し上げます。
参考文献
- Miyajima A, Tanaka M, Itoh T. Stem/progenitor cells in liver development, homeostasis, regeneration, and reprogramming. Cell Stem Cell 2014;14:561-574.
- Liu YR, Lin BB, Zeng DW, Zhu YY, Chen J, Zheng Q, Dong J, et al. Alpha-fetoprotein level as a biomarker of liver fibrosis status: a cross-sectional study of 619 consecutive patients with chronic hepatitis B. BMC Gastroenterol 2014;14:145.
- Kuramitsu K, Sverdlov DY, Liu SB, Csizmadia E, Burkly L, Schuppan D, Hanto DW, et al. Failure of fibrotic liver regeneration in mice is linked to a severe fibrogenic response driven by hepatic progenitor cell activation. Am J Pathol 2013;183:182-194.
- Alison MR, Islam S, Lim S. Stem cells in liver regeneration, fibrosis and cancer: the good, the bad and the ugly. J Pathol 2009;217:282-298.
- Nakano Y, Nakao S, Sumiyoshi H, Mikami K, Tanno Y, Sueoka M, Kasahara D, et al. Identification of a novel alpha-fetoprotein-expressing cell population induced by the Jagged1/Notch2 signal in murine fibrotic liver. Hepatology Communications 2017.
- Zong Y, Panikkar A, Xu J, Antoniou A, Raynaud P, Lemaigre F, Stanger BZ. Notch signaling controls liver development by regulating biliary differentiation. Development 2009;136:1727-1739.










