研究交流
肝疾患治療用細胞シートの開発
汐田 剛史、板場 則子
鳥取大学大学院医学系研究科 遺伝子医療学部門
はじめに
肝機能が著しく低下した末期肝不全の治療法として、肝移植は有効な治療法である。しかし、肝移植の必要数とドナー臓器数のアンバランス、すなわち、ドナー不足の問題は依然として解決されていない1)。わが国で、2010年7月17日に改正臓器移植法が全面施行され、本人の意思が不明な場合には、家族の承諾で臓器が提供できることとなり、また15歳未満のドナーからの脳死での臓器提供も可能となった。しかし、慢性的ドナー不足は解消していない。従って、再生医療への期待は大きい。
幹細胞は、自律増殖能と多分化能を有するため、幹細胞を用いた治療は肝再生を促す有効な細胞ソースとなりうる。間葉系幹細胞は、骨、軟骨、脂肪などの中胚葉系細胞の他、外胚葉系細胞や内胚葉系細胞へ分化する分化可塑性を有し、肝障害抑制作用、アポトーシス抑制作用、酸化ストレス抑制作用を有するため2)、肝臓領域の治療に使用されている1)。間葉系幹細胞を用いた肝疾患への細胞治療は、現在まで13報の報告がある1)。内訳は、ランダム化比較試験が2報、コホート研究が6報、症例対照研究が5報であり、対象は肝硬変、肝不全などである。13報のうち、明らかな効果を認めなかったのは1報のみで、その他12報は効果を認めたと報告されており、間葉系幹細胞はそのまま使用しても肝疾患に有効な細胞と思われる。われわれは、間葉系幹細胞をそのまま使用するのではなく、肝細胞様に分化させることでより強力な治療効果が期待できることに着目し、間葉系幹細胞を安定・安全性に優れた低分子化合物により肝細胞様細胞への分化誘導技術の開発を行ってきた3-5)。さらに、温度応答性培養皿による細胞シート作製技術と組み合わせることで、安全性・治療効果の高い「肝疾患治療用細胞シート」を開発したので、概要を紹介したい6,7)。
1.ヒト間葉系幹細胞の肝細胞分化を誘導する低分子化合物の同定
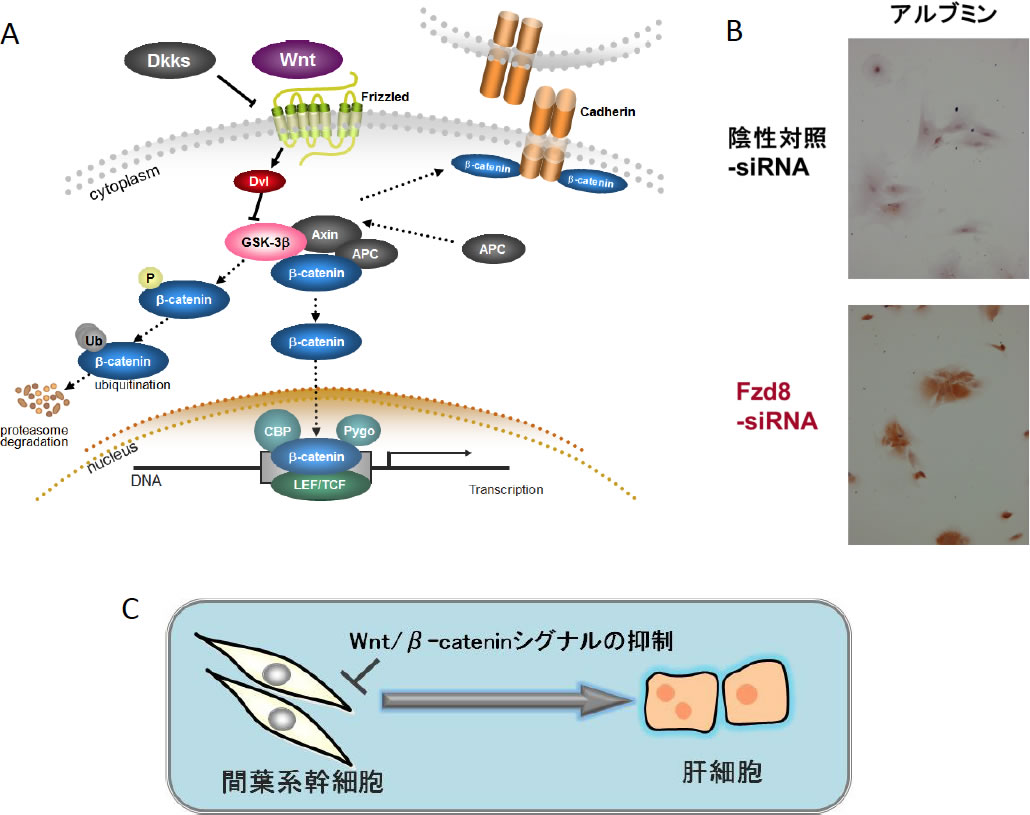
われわれは、骨髄に存在し、通常、骨、軟骨、脂肪細胞に分化するヒト間葉系幹細胞に着目した。間葉系幹細胞は、癌化のリスクが少なく、採取が比較的容易であり、倫理的問題が少ない点で良好な細胞ソースと考えられる。われわれは、ヒト間葉系幹細胞より肝細胞への誘導を既報に従い行ったところ8,9)、誘導過程でWnt/β-catenin経路(図1A)が抑制されていることを見出した3,4)。また、Wntリガンドの受容体であるFzd8を抑制すると、アルブミン発現が誘導された(図1B)。すなわち、ヒト間葉系幹細胞において、Wnt/β-catenin経路の抑制が肝細胞分化に繫がることを見出した(図1C)3,4)。さらに、安定・安全な誘導法として、蛋白や遺伝子を用いない低分子化合物に着目し、Wnt/β-catenin経路阻害薬として報告されていた10種類の低分子化合物より、最も強力に肝細胞分化を誘導する化合物としてヘキサクロロフェンを見出した6)。
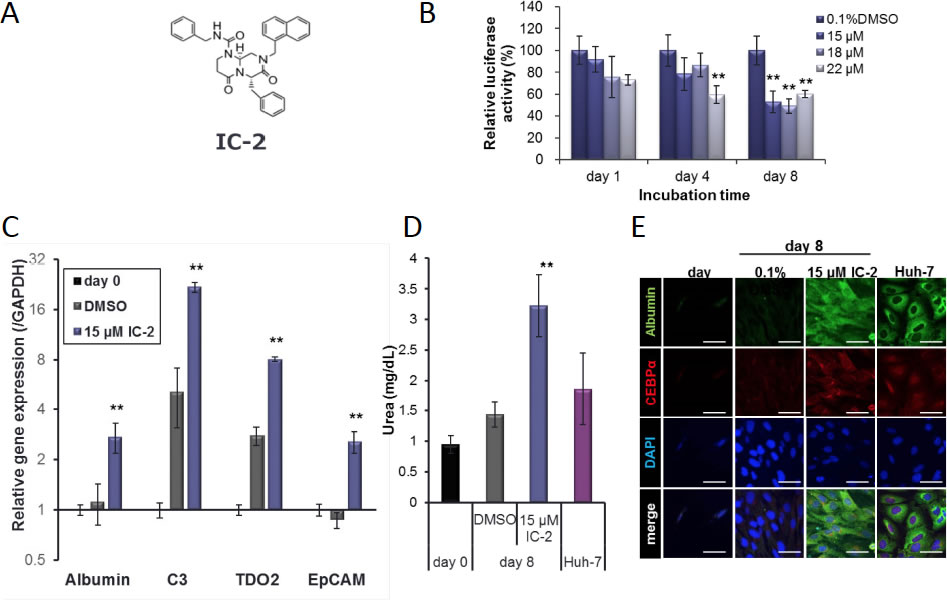
さらに、既知のWnt/β-catenin経路阻害薬の誘導体を新たに23種類を合成し、ヒト間葉系幹細胞の肝細胞分化誘導能を検討した7)。IC-2は、ヒト間葉系幹細胞において、アルブミン、C3、TDO2、EpCAM発現を強力に誘導し、グリコーゲン合成能、尿素合成能を用量依存性に増加させた(図2)。ヒト間葉系幹細胞の肝細胞分化を、先に述べたヘキサクロロフェンより強力に誘導する新規化合物として、IC-2を同定した。
図1.Wnt/β-catenin経路と肝細胞分化
A. Wnt/β-catenin経路
B. WntリガンドFzd8のsiRNA導入によるアルブミン発現
C. ヒト間葉系幹細胞のWnt/β-catenin経路抑制による肝細胞分化
図2.新規化合物ICs-2による肝細胞分化能(参考論文7より引用、掲載許諾済)
A. IC-2の構造式
B. IC-2による間葉系幹細胞のWnt/β-catenin活性抑制作用の濃度依存性と時間依存性
C. IC-2による肝細胞特異的遺伝子発現への影響
D. IC-2による尿素合成能への影響
E. IC-2によるアルブミン発現、CEBPα発現の影響(免疫蛍光染色)
2.肝疾患治療用細胞シートの開発と急性肝障害への効果
われわれは、東京女子医科大学の岡野光夫教授により開発された温度応答性細胞シートに着目した。われわれが見出した間葉系幹細胞の肝細胞分化誘導性
化合物と温度応答性細胞シート技術を融合することで、より強力な治療効果が期待される細胞シートの作製が可能となるのではないかと考えた。具体的な細胞シート作製法として、骨髄由来ヒト間葉系幹細胞を温度応答性培養皿に播種し、ヘキサクロロフェンやIC-2などの低分子化合物を培養液中に添加し8日間培養後、培養皿を37℃から20℃へ冷却することで、間葉系幹細胞から分化させた肝細胞様シートが得られる(図3)。本細胞シートは、間葉系幹細胞特有の液性因子分泌能を維持したまま、一定の肝細胞機能を備えている。
四塩化炭素によりNOD/SCIDマウスに急性肝障害を誘導し、本細胞シートによる治療効果及び予防効果を検討した6)。すなわち、治療を想定した肝障害後に本細胞シートを移植する実験系と、予防を想定した本細胞シート移植後に肝障害を加えた実験系において検討し、共に肝障害を有意に軽減させた。
図3. 肝疾患治療用細胞シートの作製の方法
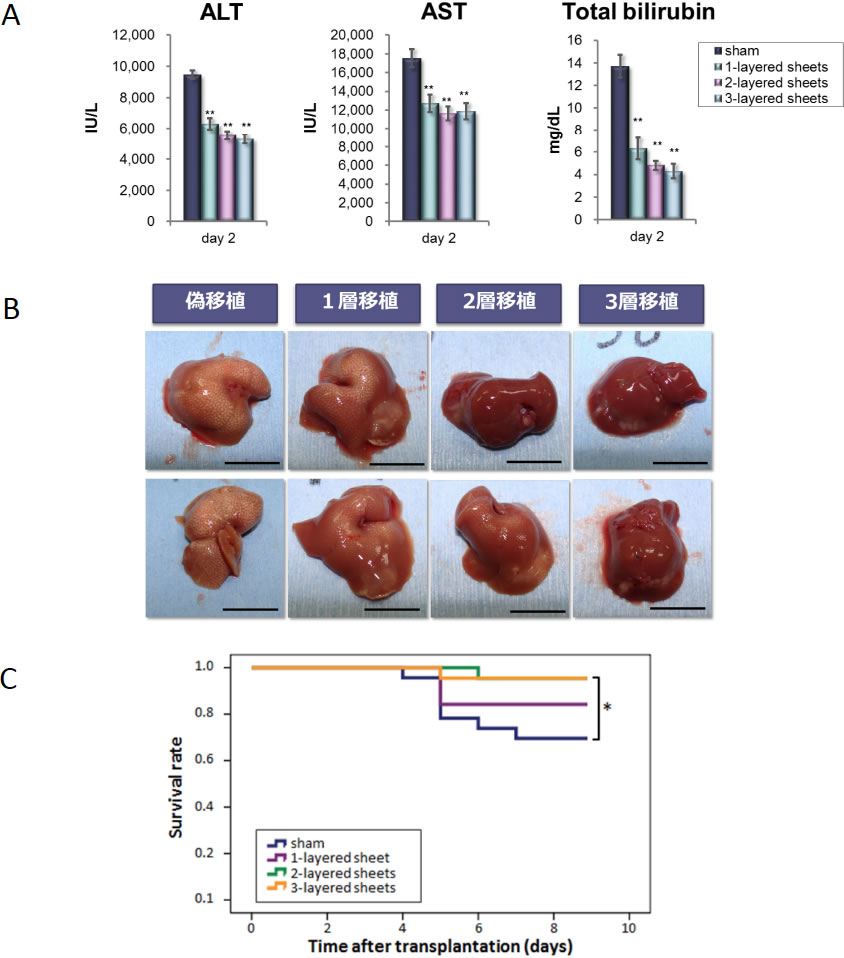
本細胞シートを、肝表面2か所に1層、2層、3層移植し、急性肝障害を加え、効果を比較した(図4A)。肝機能の指標となるALT、AST、総ビリルビン値は、細胞シートを移植していない偽移植群と比較して、劇的な改善効果を示した。すなわち、細胞シート移植によりALT、ASTの値は2/3程度に低下し、総ビリルビン値は1/3以下に低下した。この肝機能の改善効果は細胞シートの移植枚数依存的であった。改善したのは、肝機能のみでなく、肝肉眼像でも明らかであった。すなわち、偽移植群の肝表面は白色に変色し、顆粒状の変化を認めるが、1層移植群では肝表面の色調や性状が軽減している。さらに、2層移植、3層移植ではその改善効果が大きいことが明らかとなった(図4B)。生存率を比較すると、偽移植群に比較し、細胞シートを2層あるいは3層で移植した群においては、生存率が有意に改善した(図4C)。また、間葉系幹細胞を低分子化合物により肝細胞へ分化誘導した細胞で作製した細胞シートは、間葉系幹細胞そのものから作製した細胞シートに比較し、有意に治療効果が高いことを見出している(未発表データ)。
図4. 急性肝障害への肝疾患治療用細胞シートの効果(参考文献6より引用、掲載許諾済)
A. 細胞シート枚数に関連した肝機能改善効果
B. 細胞シートの枚数と肝肉眼像への効果の比較
C. 細胞シートによる生存率の改善
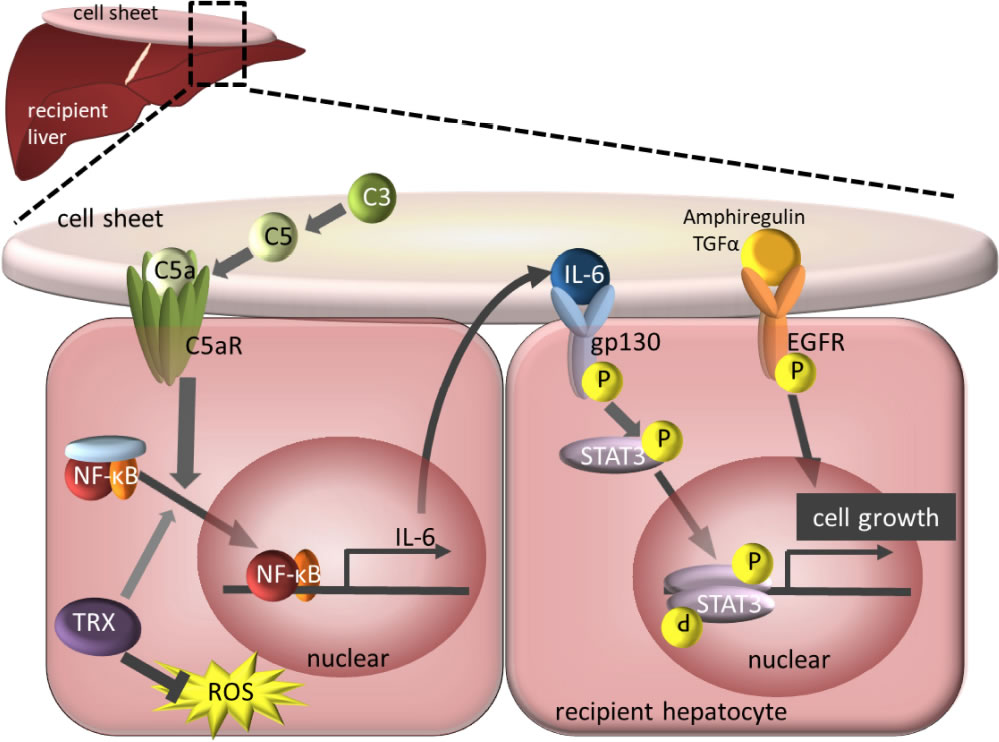
肝疾患治療用細胞シートの急性肝障害の軽減効果の機序は、本細胞シートにより肝再生が促進されるためと考えられる。肝再生を促進する三つのメカニズムを明らかにしている(図5)。一つには、間葉系幹細胞の肝細胞化に伴い、細胞シートの肝細胞特異的蛋白であるC3の発現が亢進し、下流のC5、C5aを介して、細胞シートに接するマウス肝細胞のC5a受容体に結合する。これによりNF-kBの核内移行が促進され、IL-6の分泌が亢進し、IL-6の受容体であるgp130にオートクリン或いはパラクリンに作用し、下流のSTAT3を介して肝細胞の増殖が高まることがある。二つには、EGF受容体の活性化による細胞増殖の促進されることがある。三つには、チオレドキシン蛋白発現が増加し、抗酸化作用によりNF-kBの核内移行が高まることがある。この三つの作用機序を推定している。
図5. 肝再生促進作用の機序(参考文献1より引用、掲載許諾済)
おわりに
われわれは、肝疾患治療用細胞シートを開発した。本細胞シートは、ヒト間葉系幹細胞を肝細胞に分化させ、細胞シートとして移植する治療法である。間葉系幹細胞はそのまま使用しても肝疾患に有効な細胞であるが、間葉系幹細胞をそのまま使用するのではなく、肝細胞様に分化させることにより強力な治療効果が期待できる。さらに、われわれは、間葉系幹細胞を安定・安全に分化誘導する方法として、低分子化合物を同定した。また、本稿では詳細は省略したが、本細胞シートは、強力に肝線維化を抑制することを見出している。従って、肝疾患治療用細胞シートは、急性及び慢性の重症肝疾患の新たな治療法となるものと期待される。
参考文献
- Shiota G, Itaba N: Progress in stem cell-based therapy for liver disease. Hepatol Res 47:127-141,2017
- Cho KA, Woo SY, Seoh JY, et al.: Mesenchymal stem cells restore CCl4-induced liver injury by an antioxidative process. Cell Biol Int 36:1267-74, 2012
- Shimomura T, Yoshida Y, Sakabe T, et al.: Hepatic differentiation of human bone-marrow-derived UETT-13 cells: Effectss of cytokines and CCN family gene expression. Hepatol Res 37:1068-1079,2007
- Yoshida Y, Shimomura T, Sakabe T, et al.: A role of Wnt/beta-catenin signals in hepatic fate specification of human umbilical cord blood-derived mesenchymal stem cells. Am J Physiol Gastroenterol Liver Physiol 293:G1089-1098,2007
- Ishii K, Yoshida Y, Sakabe T, et al.: Hepatic differentiation of human bone marrow-derived mesenchymal stem cells by tetracycline-regulated hepatocyte nuclear factor 3 beta. Hepatology 48: 597-606,2008
- Itaba N, Matsumi Y, Okinaka K, et al.: Human mesenchymal stem cell-engineered hepatic cell sheets accelerate liver regeneration in mice. Sci Rep 5:16169,2015
- Itaba N, Sakabe T, Kanki K, et al.: Identification of the small molecule compound which induces hepatic differentiation of human mesenchymal stem cells. Regenerative Therapy 2:32-41,2015
- Lee KD, Kuo TK, Wang-Peng J, et al.: In vitro hepatic differentiation of human mesenchymal stem cells. Hepatology 40:1275-1284,2004
- Lee KD, Kuo TK, Chen KD, et al.: Isolation of multipotent mesenchymal stem cells from umbilical cord blood. Blood 103:1669-1675,2004