研究交流
肝疾患において脾臓は本当に邪魔な存在なのか?
-脾臓のリポカリン2が門脈を介しKupffer細胞の過剰活性を抑制し肝線維化進展を阻止する-
青山友則
順天堂大学医学部消化器内科
はじめに
肝臓学をはじめ医学生物学の分野では日々そのメカニズムに関し研究がされている。その中で我々が感じることは生体の緻密さではないだろうか。細胞分子レベルにおいて多様な機能が絶妙なタイミングで制御されていることにはただ驚くばかりである。このような精密な生体機構は進化の過程の中で確立されてきたわけであるが、人類はこの過程において脾臓を温存し続けてきた。一方、我々Hepatologistは脾臓に関してはどのような認識であろうか。脾臓は一般的には肝疾患に関してやや否定的な役割を担っていると考えられ(1, 2)、肝臓外科医は脾摘を行い、肝臓内科医は部分的脾動脈塞栓術を行い、さらに研究者は基本的に脾臓を解析しない。しかし、このような邪魔者扱いされている脾臓は進化の過程において脾静脈-門脈を介して肝臓とつながり続けてきた。さらに、静脈系が肝臓へと流入するのは脾臓と腸管のみであり、それ以外の臓器の静脈は直接大循環へ流入する。すなわち、腸-肝-脾相関というものが解剖学的には存在するのである。肝臓の大きな役割として栄養分の代謝があるため、栄養分を吸収する腸管とそれを代謝する肝臓がつながっている理由は推察できる。また、腸管からは腸内細菌由来の多くの外来抗原が門脈を介して流入するため肝臓はこれらに対する免疫寛容を保っている。一方、免疫調節臓器と考えられている脾臓がなぜ肝臓と直接つながっているかは推察が難しい。しかしながら、肝臓とつながる脾臓は肝疾患において本当に邪魔な存在なのであろうか?なぜ脾臓は退化せず、我々は持ち続けているのだろうか?本研究では肝線維化進展おける脾臓の役割をあらかじめ脾摘し肝線維化を誘導したマウスを用いて検討した。その一部を紹介させていただきたい。
肝線維化に伴う脾腫の要因はうっ血だけではなかった
まず、脾摘をしない雄性8週齢の野生型マウスに0.5ul/gの四塩化炭素を週に2回、計12回投与し肝線維化モデルを作成し、脾臓の組織所見およびサイトカイン発現を検討した。肝線維化に伴い脾臓は腫大し、HE染色では赤脾髄内にうっ血を認めたが、一方で同部位に多数の有核細胞の出現を認めた(3)。したがって、肝線維化に伴う脾腫はうっ血だけではなくこのような多数の有核細胞も関与することが考えられた。また、肝線維化を誘導したマウスの脾臓におけるサイトカイン発現を調べたところ、Tnf-α、Il-10などいわゆる炎症および抗炎症性サイトカインは肝線維化を誘導していないマウスの脾臓と変化はなかったものの、肝線維化モデルの脾臓ではリポカリン2 (Lcn2)の著明な発現増強を認めた。Lcn2はNeutrophil gelatinase-associated lipocalin (NGAL)として同定された好中球の分泌蛋白である(4)。細菌の発育には鉄分が必要であり、siderophoreにより外部から鉄を獲得している。Lcn2は細菌感染において特にこのsiderophoreへの結合蛋白として知られており、細菌の発育を阻止する作用がある。また、Lcn2は細胞増殖、腫瘍形成や制御性T細胞を介した細胞保護作用(5)、さらにはマクロファージの活性制御にも関与することが報告されている(6, 7)。このことから肝線維化モデルの脾臓において多数出現した有核細胞について調べたところ、これらの細胞は好中球のマーカーであるGr1が陽性であり、かつLcn2を発現していた(Fig.1)。すなわち、肝線維化進展に伴い脾臓内ではうっ血だけではなくLcn2を発現するGr1陽性細胞が誘導されることが考えられた。
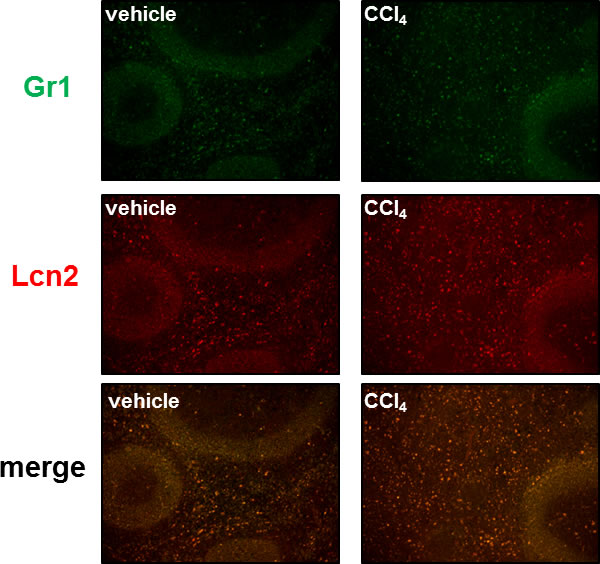
Fig.1 肝線維化モデルの脾臓では多数のGr1+Lcn2+細胞が認められた。(脾臓の蛍光免疫染色にて検討)
CCl4:carbon tetrachloride
脾臓のLcn2によるKupffer細胞の活性抑制-脾臓による肝線維化進展阻止作用の可能性-
このような反応を示す脾臓がなかった場合、肝線維化の進展に影響はあるのだろうか?そこで、肝障害誘導1週間前に脾摘を行った野生型マウスに対し四塩化炭素による肝線維化を誘導し、非脾摘群と比較した。興味深いことに脾摘群では非脾摘群と比較し肝線維化の増悪を認めた(Fig.2A,B)。一方、門脈内のLcn2値を検討すると脾摘群では非脾摘群と比べ有意な低下を認めた。以上のことから脾臓のLcn2が門脈を介して肝線維化進展に対して阻止する役割を担っていることが推察された。すなわち、脾摘群では脾臓からLcn2が分泌されないため、門脈血中濃度が低下し、Lcn2の肝臓への作用が減弱するため肝線維化が進展する可能性が考えられた。Lcn2がマクロファージの活性制御にも関わることや、門脈血は類洞にまず流入するため類洞に存在するKupffer細胞に対するLcn2の作用を解析した。単離したKupffer細胞に対してLipopolysaccharide (LPS)刺激下にrecombinant Lcn2 (rLcn2)を添加し、Tnf-αおよびCcl2 mRNA発現を調べた。rLcn2添加群では非添加群と比較しこれらの発現が有意に低下し、rLcn2のKupffer細胞活性抑制作用が示された。他方、rLcn2は肝星細胞の活性化には作用しなかった。以上より肝線維化進展において脾臓由来のLcn2が門脈を介してKupffer細胞の過剰活性を抑制し肝線維化を阻止する作用を有することが考えられた。
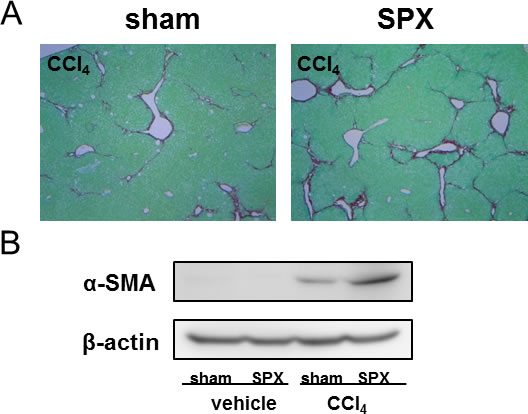
Fig.2 あらかじめ脾摘したマウスでは肝線維化の増悪を認めた。
A: Sirius Red 染色(×40)B: α-SMA western blot.
CCl4:carbon tetrachloride、SPX: splenectomy
腸-肝相関に対する脾臓の関与
Lcn2が細菌感染によって誘導されること、そして前述のとおり腸-肝-脾相関が解剖学的には考えられることから腸管滅菌を行った場合、脾摘による一連の現象がどのように変化するか調べた。あらかじめ抗菌薬投与により腸管滅菌を行いつつ、同様に脾摘後四塩化炭素による肝線維化モデルを作成したところ、脾摘による影響が認められず脾摘群および非脾摘群で肝線維化は同程度となった。また、門脈血中のLcn2濃度も両群で同等となった。このことから、脾臓由来のLcn2は肝線維化進展に伴うgut-derived productsの流入によるKupffer 細胞の過剰活性を抑制し肝線維化進展を抑制することが推察された(3)(Fig.3)。前述のとおり脾摘は、本研究とは異なり肝疾患に対してはむしろ保護的に作用することが報告されている。しかしながら、臨床上に行われる脾摘や部分的脾動脈塞栓術は肝硬変に至った後に行われることから肝硬変に伴う側副血行路の求肝性・遠肝性の血行動態が脾摘により変化することも影響していることが考えられる。本研究では肝線維化が進展する過程における脾臓の役割を明らかにするために、脾摘を側副血行路形成が起きていない線維化誘導前に行い検証した。肝線維化進展において脾臓は、腸-肝相関に対する肝臓の免疫寛容状態の維持に重要な役割を担っていることが示唆された。
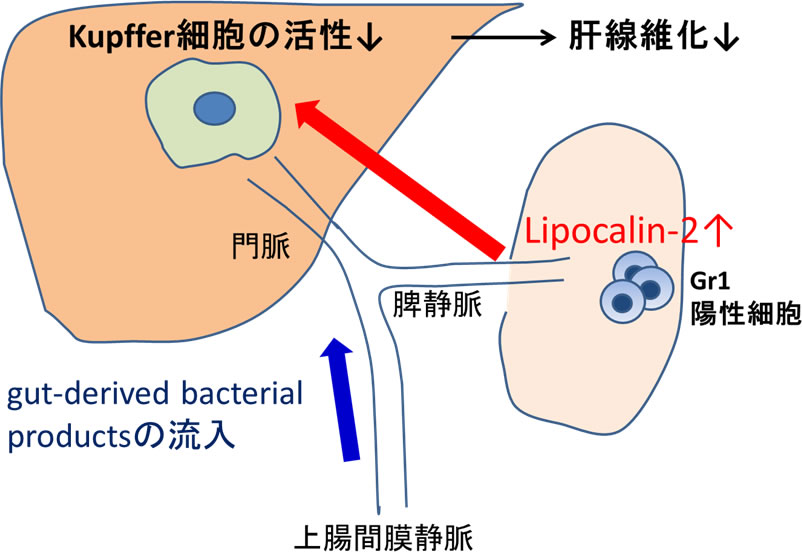
Fig.3 gut-derived productsの流入を契機として脾臓由来のLcn2が門脈を介してKupffer細胞の過剰活性を抑制し、肝線維化を阻止する。(文献3より一部改変)
おわりに
肝疾患のメカニズムを解析する上で腸-肝相関に関しては多くの報告があるが、それと比較し脾臓との関連については報告が少ない。しかし、前述のとおり我々の進化の過程で脾臓が温存されてきたことや解剖学的な見地から、もしかすると腸-肝-脾相関を介して脾臓が腸管から流入する様々な外来抗原に対して反応し肝臓をはじめ生体を保護する方向に働いている可能性もある。免疫調節臓器とも言われる脾臓の役割について、我々Hepatologistは改めて考えてみる必要があるのではないだろうか。
参考文献
- Akahoshi T, Hashizume M, Tanoue K, Shimabukuro R, Gotoh N, Tomikawa M, et al. Role of the spleen in liver fibrosis in rats may be mediated by transforming growth factor beta-1. J Gastroenterol Hepatol. 2002;17(1):59-65.
- Yada A, Iimuro Y, Uyama N, Uda Y, Okada T, Fujimoto J. Splenectomy attenuates murine liver fibrosis with hypersplenism stimulating hepatic accumulation of Ly-6C(lo) macrophages. J Hepatol. 2015;63(4):905-16.
- Aoyama T, Kuwahara-Arai K, Uchiyama A, Kon K, Okubo H, Yamashina S, et al. Spleen-derived lipocalin-2 in the portal vein regulates Kupffer cells activation and attenuates the development of liver fibrosis in mice. Lab Invest. 2017.
- Goetz DH, Holmes MA, Borregaard N, Bluhm ME, Raymond KN, Strong RK. The neutrophil lipocalin NGAL is a bacteriostatic agent that interferes with siderophore-mediated iron acquisition. Mol Cell. 2002;10(5):1033-43.
- La Manna G, Ghinatti G, Tazzari PL, Alviano F, Ricci F, Capelli I, et al. Neutrophil gelatinase-associated lipocalin increases HLA-G(+)/FoxP3(+) T-regulatory cell population in an in vitro model of PBMC. PLoS One. 2014;9(2):e89497.
- Warszawska JM, Gawish R, Sharif O, Sigel S, Doninger B, Lakovits K, et al. Lipocalin 2 deactivates macrophages and worsens pneumococcal pneumonia outcomes. J Clin Invest. 2013;123(8):3363-72.
- Jang E, Lee S, Kim JH, Kim JH, Seo JW, Lee WH, et al. Secreted protein lipocalin-2 promotes microglial M1 polarization. FASEB J. 2013;27(3):1176-90.










