研究交流
zone特異的性質を有するヒトES/iPS細胞由来肝細胞の作製法の開発
三谷成二1、高山和雄1,2,3、水口裕之1,2,4,5
- 大阪大学大学院薬学研究科分子生物学分野
- 医薬基盤・健康・栄養研究所 肝細胞分化誘導プロジェクト
- 科学技術振興機構 さきがけ
- 大阪大学国際医工情報センター
- 大阪大学大学院医学系研究科
はじめに
ヒトembryonic stem (ES)/induced pluripotent stem (iPS)細胞から分化誘導して得られる肝細胞(ヒトES/iPS細胞由来肝細胞)は再生医療や創薬研究への応用が期待されている。これまでに、世界中の多くの研究グループによりヒトES/iPS細胞から肝細胞への分化誘導法の開発が精力的に推し進められ、機能的な肝細胞を作製することが可能になった[1-4]。しかし、生体内に存在するzone特異的な肝細胞をヒトES/iPS細胞から分化誘導する技術は開発されていない。そこで、我々はzone特異的な性質を有したヒトES/iPS細胞由来肝細胞の作製を試みた[5]。本稿では、我々の検討から得られたヒトES/iPS細胞からzone特異的な肝細胞を作製する方法とそのメカニズムに関する知見について概説する。
Liver zonation
肝細胞は肝小葉の位置に応じて規則的に異なる代謝能を示す[6] (図1A, B)。このLiver zonationの形成には、血中の酸素濃度やホルモン濃度勾配などの関与が示唆されている[7]。また、コンディショナルノックアウトマウスを用いた検討から、β-catenin依存的なWNTシグナルの制御によりLiver zonationが形成・維持されていることも明らかとなっている[8] (図1C)。しかし、Liver zonation形成・維持に関与するWNTリガンドやその産生細胞などについては十分には分かっていない。
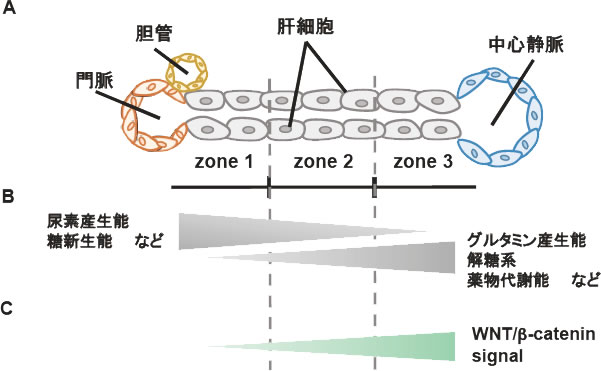
図1.Liver zonation
(A)門脈、胆管周囲はzone1、中心静脈周囲はzone3、その中間はzone2と分けられる。
(B)肝細胞はzoneに応じて異なる代謝能を有する。
(C)WNT/β-cateninシグナルはzone1肝細胞で抑制、zone3肝細胞で活性化されている。
ヒトES/iPS細胞由来肝細胞のzone特異的な機能獲得に関与する細胞種の同定
我々はzone特異的な性質を有した肝細胞の作製を試みるにあたり、肝臓における細胞間環境に着目した。そこで、様々な細胞のconditioned medium(CM)を用いてヒトiPS細胞由来肝細胞を培養し、薬物代謝能への影響を評価した。その結果、ヒトiPS細胞由来肝細胞の薬物代謝能は肝細胞のCM培養により向上し、胆管上皮細胞のCM培養により低下した(図2)。
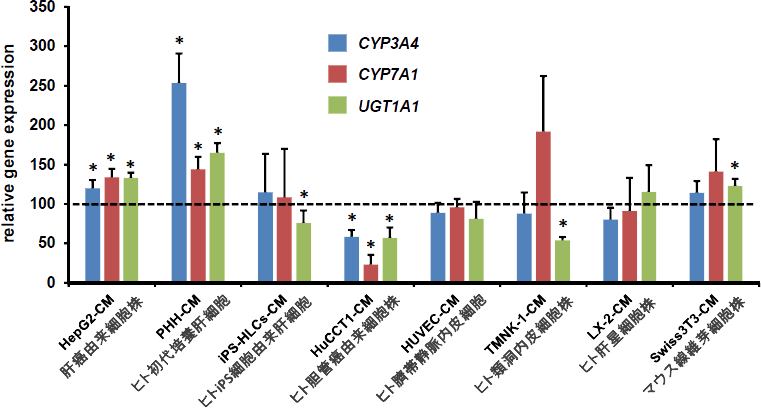
図2.各種細胞のCM培養によるヒトiPS細胞由来肝細胞の薬物代謝能への影響
薬物代謝関連因子の遺伝子発現解析 *p<0.05 (参考文献5より改変して引用)
薬物代謝能はzone3(中心静脈域)の肝細胞で高く、zone1(門脈域)の肝細胞で低い[9]。また、胆管上皮細胞からなる胆管はzone1近くに位置している[10]。これらのことから、ヒトiPS細胞由来肝細胞が肝細胞のCM培養によりzone3肝細胞、胆管上皮細胞のCM培養によりzone1肝細胞の性質を獲得しているのではないかと推測した。実際に、肝細胞のCMを用いて培養を行ったヒトiPS細胞由来肝細胞では、zone3肝細胞特異的機能であるグルタミン産生[11]、クエン酸産生[12]、CYP1A2活性[9]が向上し、WNT/β-cateninシグナルが活性化されていた(図3A, B, C, F)。また、胆管上皮細胞のCMを用いて培養を行ったヒトiPS細胞由来肝細胞では、zone1肝細胞特異的機能である尿素産生[11]、糖新生[13]が向上し、WNT/β-cateninシグナルが抑制されていた(図3D, E, F)。これらの機能変化は、ヒトES細胞由来肝細胞でも認められた(data not shown)。以上の結果から、ヒトES/iPS細胞由来肝細胞は、肝細胞のCM培養によりzone3肝細胞、胆管上皮細胞のCM培養によりzone1肝細胞の性質を獲得することが明らかとなった。
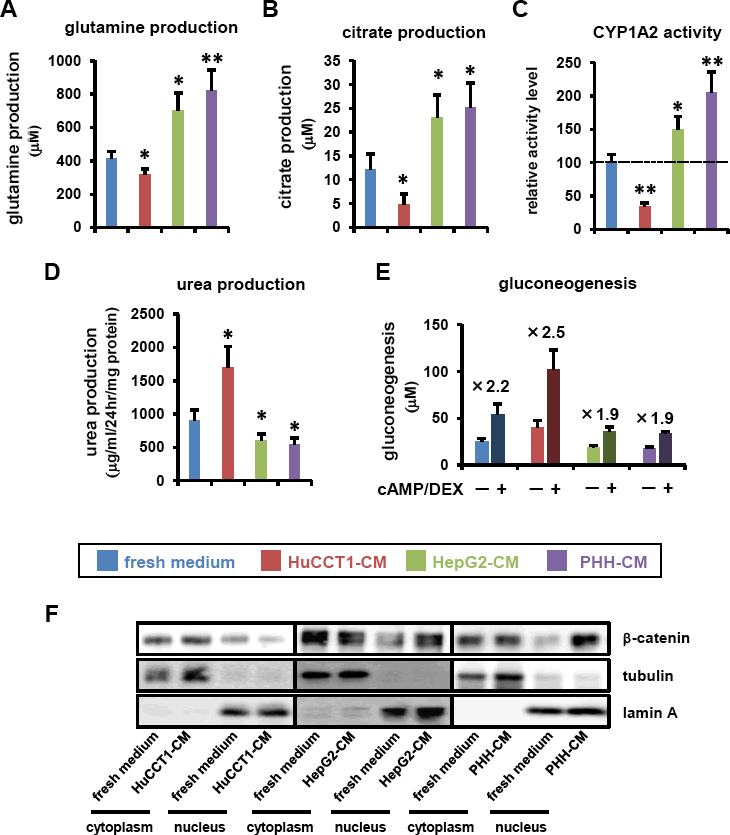
図3.肝細胞および胆管上皮細胞のCM培養によるzone特異的機能への影響
(A)グルタミン産生能の評価、(B)クエン酸産生量の評価、 (C) CYP1A2活性の評価、
(D)尿素産生能の評価、(E)糖新生能の評価、(F)β-cateninの発現解析 *p<0.05, **p<0.01
(参考文献5より改変して引用) 図内略語 PHH:ヒト初代培養肝細胞
ヒトiPS細胞由来肝細胞がzone特異的機能を獲得するメカニズムの解明
Liver zonationの形成にはWNT/β-cateninシグナルが関与しているため、肝細胞と胆管上皮細胞におけるWNTシグナルのリガンドおよびインヒビターの発現プロファイルを取得した。その結果、WNTシグナルのリガンドであるWNT7B、WNT8Bが肝細胞および胆管上皮細胞で高発現していた。また、WNTシグナルのインヒビターであるWNT Inhibitor Factor-1 (WIF-1)が胆管上皮細胞においてのみ高発現していた(図4)。さらに、ヒト肝組織においても門脈周囲にWIF-1が、肝臓全体にWNT7B、WNT8Bが発現していた(data not shown)。そこで、これらの因子に着目し検討を行った。
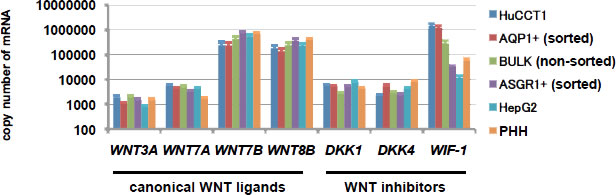
図4.肝細胞および胆管上皮細胞におけるWNTリガンド、インヒビターの発現
胆管癌由来細胞株(HuCCT1)、ヒトiPS細胞由来胆管上皮細胞(AQP1陽性細胞をソーティング)、ヒトiPS細胞由来胆管上皮細胞+ヒトiPS細胞由来肝細胞(BULK)、ヒトiPS細胞由来肝細胞(ASGR1陽性細胞をソーティング)、ヒト肝癌由来細胞株(HepG2)、ヒト初代培養肝細胞(PHH)におけるWNTリガンド、インヒビターの遺伝子発現解析 (参考文献5より改変して引用)
まず、CM作製細胞においてWNT7B、WNT8Bをダブルノックダウンすることにより、肝細胞のCM培養によるzone3特異的機能獲得の効果が抑制された。また、WIF-1をノックダウンすることにより、胆管上皮細胞のCM培養によるzone1特異的機能獲得の効果が抑制された(図5)。続いて、ヒトiPS細胞由来肝細胞にWNT7Bを過剰発現させるとzone3特異的機能が向上し、WIF-1を過剰発現させるとzone1特異的機能が向上した。過剰発現によるzone特異的機能の上昇は、各CM培養によるものよりも高い値を示した(図6)。
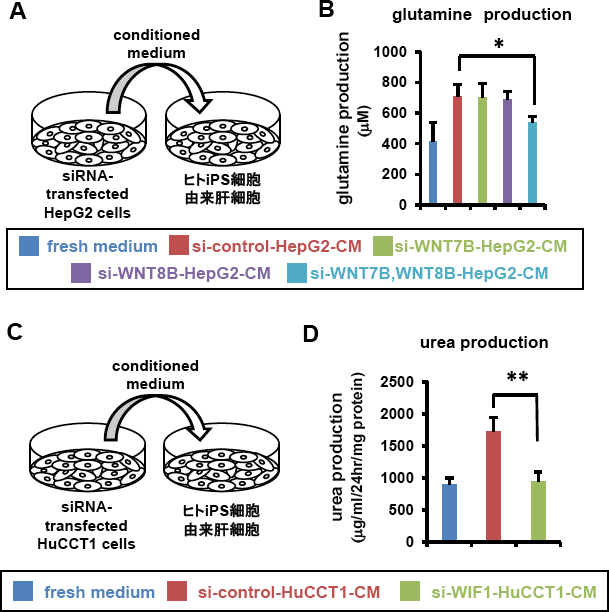
図5.WNT7B、WNT8B、WIF-1のノックダウンによるzone特異的機能獲得への影響
(A) WNT7B、WNT8BをノックダウンしたHepG2細胞から作製したCMを用いてヒトiPS細胞由来肝細胞を培養、(B)グルタミン産生能の評価、(C)WIF-1をノックダウンしたHuCCT1細胞から作製したCMを用いてヒトiPS細胞由来肝細胞を培養、(D)尿素産生能の評価 *p<0.05、**p<0.01 (参考文献5より改変して引用)
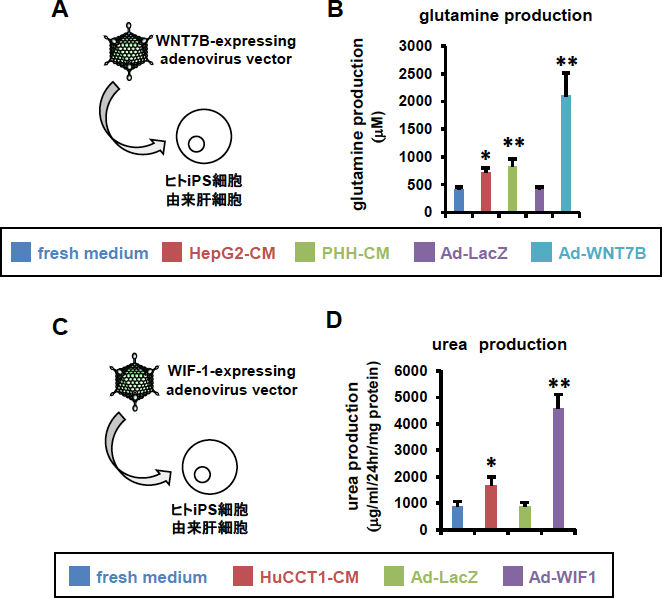
図6.WNT7B、WIF-1の過剰発現によるzone特異的機能への影響
(A)ヒトiPS細胞由来肝細胞にWNT7Bを過剰発現、(B) グルタミン産生能の評価、(C)ヒトiPS細胞由来肝細胞にWIF-1を過剰発現、(D)尿素産生能の評価 *p<0.05, **p<0.01 (参考文献5より改変して引用)
以上の結果から、肝細胞によるzone3特異的機能の獲得にWNT7B、WNT8Bが関与し、胆管上皮細胞のCM培養によるzone1特異的機能の獲得にWIF-1が関与することが示唆された。一方で、WNT7B、WNT8Bのダブルノックダウンでは肝細胞のCM培養の効果が完全には抑制されなかったこと(図5)から、WNT7B、WNT8B以外にもzone3特異的機能の獲得に関与している因子があることが示唆された。また、zone特異的性質を有する肝細胞の作製法として、WNT7BおよびWIF-1の過剰発現は肝細胞および胆管上皮細胞のCM培養よりも有用な方法であると考えられた。
まとめ・展望
本検討から、肝細胞および胆管上皮細胞のCM培養により、zone3およびzone1特異的性質を有するヒトES/iPS細胞由来肝細胞をそれぞれ作製できた。また、fresh mediumで培養を行ったヒトES/iPS細胞由来肝細胞はzone1肝細胞とzone3肝細胞との中間的な機能(zone2肝細胞様の機能)を有していた。さらに、zone3特異的な性質獲得にWNT7B、WNT8Bが、zone1特異的な性質獲得にWIF-1が関与していることを確認した(図7)。今後、各因子の肝細胞および胆管上皮細胞特異的なコンディショナルノックアウトマウスを作製し、より詳細な検討を行う必要がある。また、近年、中心静脈内皮細胞から産生されるWNTシグナルのエンハンサーであるRspondin3がLiver zonationの維持に関与していること[14]が報告されており、WNT7B、WNT8BおよびWIF-1との関連性の解明も検討課題である。
zone特異的肝細胞を作り分ける技術は、人工肝小葉の構築などティッシュエンジニアリングへの応用が可能である。また、zone3肝細胞は高い薬物代謝能を有することから創薬研究への応用も期待できる。以上、本検討から得られた知見がヒトES/iPS細胞由来肝細胞の再生医療や創薬研究への応用を促進することを期待する。
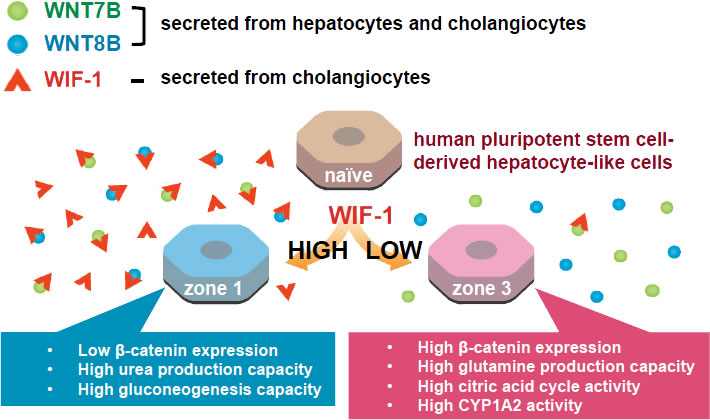
図7.本研究のまとめ (参考文献5より引用)
謝辞
本稿で紹介した成果は、大阪大学大学院薬学研究科分子生物学分野の教員・学生の方々の協力によって得られたものであり、ここに感謝の意を表します。
参考文献
- Si-Tayeb, K, Noto, FK, Nagaoka, M, Li, J, Battle, MA, Duris, C, et al. (2010). Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology 51: 297-305.
- Touboul, T, Hannan, NR, Corbineau, S, Martinez, A, Martinet, C, Branchereau, S, et al. (2010). Generation of functional hepatocytes from human embryonic stem cells under chemically defined conditions that recapitulate liver development. Hepatology 51: 1754-1765.
- Ogawa, S, Surapisitchat, J, Virtanen, C, Ogawa, M, Niapour, M, Sugamori, KS, et al. (2013). Three-dimensional culture and cAMP signaling promote the maturation of human pluripotent stem cell-derived hepatocytes. Development 140: 3285-3296.
- Takayama, K, Morisaki, Y, Kuno, S, Nagamoto, Y, Harada, K, Furukawa, N, et al. (2014). Prediction of interindividual differences in hepatic functions and drug sensitivity by using human iPS-derived hepatocytes. Proc Natl Acad Sci U S A 111: 16772-16777.
- Mitani, S, Takayama, K, Nagamoto, Y, Imagawa, K, Sakurai, F, Tachibana, M, et al. (2017). Human ESC/iPSC-Derived Hepatocyte-like Cells Achieve Zone-Specific Hepatic Properties by Modulation of WNT Signaling. Mol Ther.
- Gebhardt, R (1992). Metabolic zonation of the liver: regulation and implications for liver function. Pharmacol Ther 53: 275-354.
- Jungermann, K, and Kietzmann, T (1996). Zonation of parenchymal and nonparenchymal metabolism in liver. Annu Rev Nutr 16: 179-203.
- Burke, ZD, Reed, KR, Phesse, TJ, Sansom, OJ, Clarke, AR, and Tosh, D (2009). Liver zonation occurs through a beta-catenin-dependent, c-Myc-independent mechanism. Gastroenterology 136: 2316-2324 e2311-2313.
- Oinonen, T, and Lindros, KO (1998). Zonation of hepatic cytochrome P-450 expression and regulation. Biochem J 329 ( Pt 1): 17-35.
- Jones, AL, Hradek, GT, Renston, RH, Wong, KY, Karlaganis, G, and Paumgartner, G (1980). Autoradiographic evidence for hepatic lobular concentration gradient of bile acid derivative. Am J Physiol 238: G233-237.
- Bartl, M, Pfaff, M, Ghallab, A, Driesch, D, Henkel, SG, Hengstler, JG, et al. (2015). Optimality in the zonation of ammonia detoxification in rodent liver. Arch Toxicol 89: 2069-2078.
- Braeuning, A, Ittrich, C, Kohle, C, Hailfinger, S, Bonin, M, Buchmann, A, et al. (2006). Differential gene expression in periportal and perivenous mouse hepatocytes. FEBS J 273: 5051-5061.
- Hijmans, BS, Grefhorst, A, Oosterveer, MH, and Groen, AK (2014). Zonation of glucose and fatty acid metabolism in the liver: mechanism and metabolic consequences. Biochimie 96: 121-129.
- Rocha, AS, Vidal, V, Mertz, M, Kendall, TJ, Charlet, A, Okamoto, H, et al. (2015). The Angiocrine Factor Rspondin3 Is a Key Determinant of Liver Zonation. Cell Rep 13: 1757-1764.










