研究交流
ハイドロダイナミック法の遺伝子治療への応用に向けて
上村顕也、寺井崇二
新潟大学大学院 医歯学総合研究科 消化器内科学分野
はじめに
遺伝子治療は「種々の疾患に対して、遺伝子を細胞内へ投与することによって病気の治療、予防を行うこと」、と定義され、単回の治療で長期間の治療効果が期待されている。
その臨床応用に向けた重要なポイントは治療効果の永続性、医療経済負担の軽減、方法論の応用性の高さ、である。対象疾患は先天的な遺伝子の欠損、変異による蛋白量の減少、異常蛋白による臓器障害が原因である疾患(例、ヒトα-1アンチトリプシン欠損症、血友病など)、進行性で既存の治療法では症状の進行が抑制できない疾患(進行がんやその随伴症状、難治性神経疾患)などである。
これまでに核酸による癌細胞などの治療に関する多くの基礎的研究成果が本邦から発表されているが、患者さんの体内の癌や臓器など、組織特異的に送達し、治療効果を示す臨床研究は少ない。従って、核酸医薬を生物学的に安全、効率的かつ再現性をもって生体内の臓器、組織選択的に送達する技術及びそれを可能とする方法論、医療機器の開発が必須である。
我々は、ウイルスベクターや化学物質を使用せずに、水圧で遺伝子・薬物・細胞を臓器・組織内へとデリバリーする方法であるハイドロダイナミック法(Hydrodynamics-based delivery, 以下HD)に注目し、遺伝子導入の基礎研究を行なっている。小動物での遺伝子治療効果、ブタなどの大動物の肝臓・筋肉への臓器・組織特異的で安全かつ効率的な、遺伝子(核酸)導入への応用性を報告し、臨床応用にむけた前臨床研究をおこなっており、その内容の一部についてご紹介申し上げる。
1. HDとは
HDによる遺伝子導入法は、Liuらが1999年に報告 [1,2]して以降、簡便で、効率の高いin vivoでの遺伝子導入実験法として、遺伝子の機能解析、核酸の疾患治療効果の検証などを始めとして、様々な実験に応用されてきた[3,4](表1)。
表1. これまでに報告されているHD法による治療遺伝子の効果の検証(文献5より許可を得て、改変、転載)
| Disease | Therapeutic Genes |
| Obesity | leptin |
| IL-10 | |
| adiponectin | |
| adiponectin receptor-2 | |
| Diabetes | protein tyrosine phosphatase 1B |
| adiponectin | |
| insulin | |
| IL-6 | |
| Nonalcoholic steatohepatitis | inducible nitric oxcide synthetase |
| Hepatitis | HBV knockdown |
| HCV knockdown | |
| Fulminant hepatitis | NKG2D knockdown |
| osteopontin knockdown | |
| Liver injury | c-met |
| IL-37 | |
| caspase knockdown | |
| Liver fibrosis | platelet-derived growth factor receptor beta knockdown |
| Hemophilia | factor VIII, IX |
| von Willebrand disease | von Willebrand factor |
| C-type lectin domain family 4 member M | |
| Regeneration | fibroblast growth factor 7 |
| Autoimmune disease | FcgR-Ig |
| Viral infection | Influenza A virus knockdown |
| Alpha-1 antitrypsin deficiency | alpha-1 antitrypsin |
| Growth hormone deficiency | growth hormone |
| Hyperparathyroidism | parathyroid hormone |
| Atherosclerosis | nicotine acetylcholine receptor alpha1 knockdown |
| Mucopolysaccharidosis type VII | beta-glucuronidase |
| Fabry disease | alpha-galactosidase A |
| Metachromatic leukodystrophy | arylsulfatase |
| Mucopolysaccharidosis I | alpha-L: -iduronidase |
| Acyl-CoA dehydrogenase deficiency | short-chain acryl-CoA dehydrogenase |
| Cancer | IL-15 |
| Rejection after the transplantation | EndoGalC |
具体的には、マウスの尾静脈から体重あたり8-10%容量の核酸溶液を5-7秒で注入する。(図1)注入された核酸溶液は、心臓でうっ滞し、下大静脈側へ逆流し、肝部下大静脈から肝静脈へと流入する。溶液は、既存の門脈血流と拮抗しながら、肝類洞に到達する。溶液の注入速度と流入量によって生ずるハイドロダイナミック力が肝臓を膨張し、類洞内皮細胞を引き伸ばし、肝細胞の表面に孔を開けることによって遺伝子を肝細胞内に押し込む、と考えられる。さらに、比較的大量に肝細胞内に注入された遺伝子の一部は、細胞核に到達し、導入遺伝子の産物が発現されるとされる。マウスの尾静脈からのHDによる遺伝子導入では、約30-40%前後の肝細胞に遺伝子導入され、その流入経路から、肝静脈周辺に遺伝子導入細胞が多く認められる。小動物では、肝細胞の表面の孔は、数分で閉じることから注入された遺伝子が細胞内に蓄積されると考えられている。膨張した肝臓のサイズは24時間以内に元に復する[5,6 ](図1)。
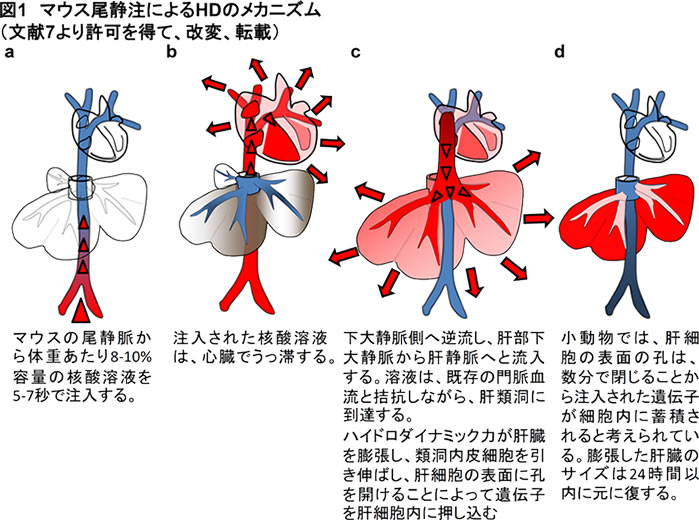
HDはこれまでに、ウイルスベクターに比較して、遺伝子導入のための準備が容易であること、手技が比較的簡便で、かつ遺伝子導入効率が高いことから、表1のような遺伝子の機能解析のためのin vivo研究に汎用され、最近では蛋白質の細胞へのデリバリーや癌細胞のデリバリーによる肝転移モデルの作製にも応用されている[5,7,8]。 一方で、これまでに、本方法をヒトの遺伝子治療に応用するための基盤的な検証はおこなわれてこなかった。
その大きな要因は、1) ハイドロダイナミック力を利用するために、高容量の核酸溶液を高流速で押し込む必要があること;2)尾静注による手技の個体間の差異が、遺伝子発現効率に反映され、再現性が担保されない、と考えられたためである。
2. 大動物への応用に向けた取り組み
我々は、HDが、ウイルスベクターや化学物質を使用せずに、いわゆる水圧で薬物・遺伝子・細胞を臓器・組織内へとデリバリーできる方法であることから、上記の2点を解決し、ヒト遺伝子治療に応用するために、基礎的研究を重ねてきた。
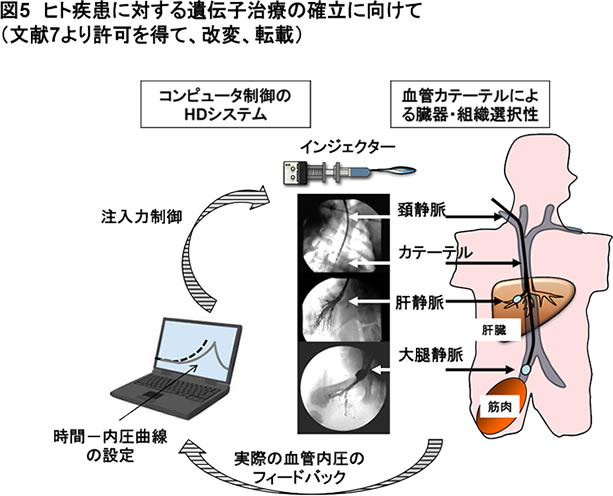
具体的には、効率的な遺伝子発現を示すために必要な溶液量を減少するための工夫として、日常の診療手技として用いている血管内のカテーテル操作を応用し、臓器、組織選択的な核酸溶液注入を行った。具体的には、各臓器の血管、例えば、肝臓の各肝区域の静脈にカテーテルを挿入し、カテーテル先端のバルーンを膨張させ、血流をブロックして溶液注入を行うことで、対象領域選択的な遺伝子導入と溶液量の減少を実現した。本方法によりブタ、イヌ、ヒヒの肝臓、筋肉を対象とした前臨床研究において、導入効率を担保しながら、注入溶液量を体重10%容量から1.25%容量まで減少することができた[7-11](図2)。
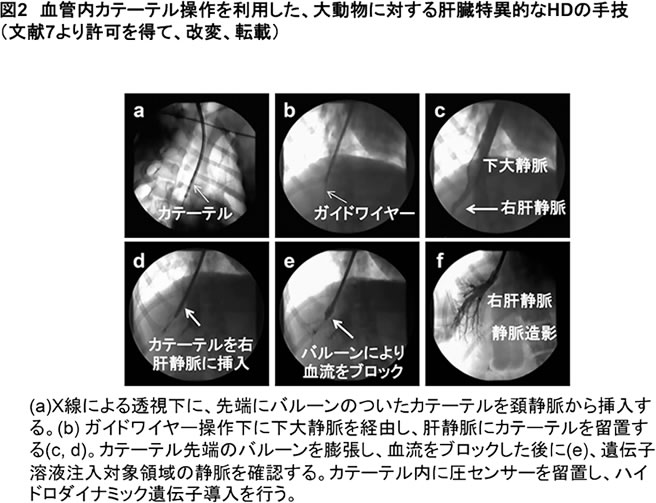
また、生体に対する手技の再現性を高めるために、核酸溶液を血管内に注入する際の、注入時間―血管内圧曲線を事前に規定し、注入中の圧変化をモニターしながら、規定の圧曲線に一致するように、注入速度を調節するためのHDシステムのプロトタイプを産官学連携で開発し、大型動物(イヌ、ブタ)でその安全性、効率性を実証している[11,12](図3、4 JST-A stepによる支援)。
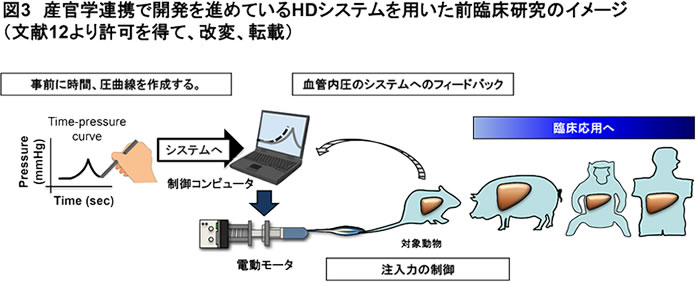
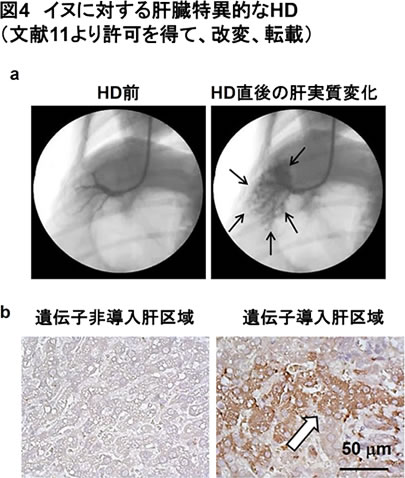
以上の結果はHDの有効性を保ちながら、『誰もが、どのような臓器・組織にも特異的に』再現できる核酸医薬治療が可能であることを示唆している。現在、本方法により肝硬変、血友病、ヒトα-1アンチトリプシン欠損症の遺伝子治療効果を示唆する結果が得られているが、反復治療でも免疫反応を認めず、観察期間中の発癌を認めていない(論文準備中)。さらには、血管カテーテルを他臓器の血管に挿入することによって、筋肉や腎臓への遺伝子導入にも成功している [13](図5)。
一方で、HDシステムの開発は、産官学連携で日本からの革新的医療機器の発信に繋がると考え、イノベーションジャパン2015 での発表課題にも採択されているが、上記のプロトタイプを医療機器として開発、発展させるための具体的な方法論を模索している。
3. 遺伝子治療法としての応用に向けた今後の課題と展望
HDをヒト遺伝子治療に応用するために、血管内カテーテル操作を用い、産官学連携で開発したHDシステムを融合して、大動物でも臓器・組織特異的なHDを安全かつ効率的に応用することが可能であることを実証した。
これまでに、大動物で血友病、ヒトα-1アンチトリプシン欠損症の遺伝子治療に対する有用性が示唆され、血友病モデルイヌに対する遺伝子治療研究を、ジョージア大学、ノースカロライナ大学と国際共同研究によって行っている(論文準備中)。
今後は、『誰もが、どのような臓器・組織にも特異的に』再現できる核酸医薬治療の開発という観点から、他臓器に対する遺伝子導入、さらには現在、有効な治療法がない進行性悪性腫瘍に対する、腫瘍組織特異的な遺伝子治療法としての発展へ向けた研究・開発を行っていきたい。
本研究により日本から世界に向けて新規遺伝子治療法を発信し、産官学連携で開発したシステムを医療機器として改良することは、トランスレーショナルリサーチのモデルとしても魅力的で、世界に先駆けた革新的医療機器の実用化の推進という点でも日本の科学技術の資源の有効活用の点から、将来性が高いと考え、今後とも会員皆様からのご指導、ご鞭撻をお願い申し上げます。
最後に本稿を書く機会を与えて頂いた東京医科歯科大学教授、仁科博史先生に深謝申し上げますとともに、一緒に研究をしている教室のメンバーにこの場を借りて深く感謝致します。
References
- Liu F, Song Y, Liu D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther 6: 1258-1266, 1999.
- Zhang G, Budker V, Wolff JA. High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA. Hum Gene Ther 10: 1735-1737, 1999.
- Kamimura K, Liu D. Physical approaches for nucleic acid delivery to liver. AAPS J 10: 589-595, 2008.
- Kamimura K, Suda T, Zhang G, Liu D. Advances in gene delivery systems. Pharm Med 25: 293-306, 2011.
- Kamimura K, Suda T, Liu D. Hydrodynamic gene delivery. In Advances and challenges in the delivery of oligonucleotide-based therapies, Future Science: Londn, UK, In Press
- Zhang G, Gao X, Song YK, Vollmer R, Stolz DB, Gasiorowski JZ, Dean DA, Liu D. Hydroporation as the mechanism of hydrodynamic delivery. Gene Ther 11: 675-682, 2004.
- Kamimura K, Yokoo T, Abe H, Kobayashi Y, Ogawa K, Shinagawa S, Inoue R, Terai S. Image-guided hydrodynamic gene delivery: Current status and future directions. Pharmaceutics. 2015. In Press
- Kamimura K, Suda T, Kanefuji T, Yokoo T, Abe H, Kobayashi Y, Aoyagi Y, Liu D. Image-guided hydrodynamic gene delivery to the liver: Toward clinical applications. In Gene Therapy and Cell Therapy through the Liver - Current Aspects and Future Prospects. Part II. Gene Therapy; Springer: London, UK. 2015. In Press
- Kamimura K, Suda T, Xu W, Zhang G, Liu D. Image-guided, lobe-specific hydrodynamic gene delivery to swine liver. Mol Ther 17: 491-499, 2009.
- Kamimura K, Suda T, Zhang G, Aoyagi Y, Liu D. Parameters affecting image-guided, hydrodynamic gene delivery to swine liver. Mol Ther Nucleic Acids. 2: e128, 2013.
- Kamimura K, Kanefuji T, Yokoo T, Abe H, Suda T, Kobayashi Y, Zhang G, Aoyagi Y, Liu D. Safety assessment of liver-targeted hydrodynamic gene delivery in dogs. PLoS One 24: e107203, 2014.
- Yokoo T, Kamimura K, Suda T, Kanefuji T, Oda M, Zhang G, Liu D, Aoyagi Y. Novel electric power-driven hydrodynamic injection system for gene delivery: safety and efficacy of human factor IX delivery in rats. Gene Ther 20: 816-823, 2013.
- Kamimura K, Guisheng Z, Liu D. Image-guided, intravascular hydrodynamic gene delivery to skeletal muscle in pigs. Mol Ther 18: 93-100, 2010.










