研究交流
肝疾患とサイトグロビン
松原 三佐子、河田 則文
大阪市立大学大学院医学研究科 肝胆膵病態内科学
はじめに
サイトグロビン(Cygb)は、ヘモグロビン、ミオグロビン、ニューログロビンに続く哺乳類第4番目のグロビンとして本研究室と吉里再生機構プロジェクトの共同研究として発見され、肝臓ではDisse腔に存在する星細胞 (HSC)のみに発現し、酸素(O2)や一酸化窒素 (NO)などと結合する。Cygb過剰発現は酸化ストレスからHSCを保護し、肝線維化を抑制する。また、肝癌誘発モデルにおいてCygb欠損マウスでは野生型に比べ、インターロイキンやTGF-βの過剰発現および酸化ストレス関連因子の増加により易発がん性になる。これらに見られるCygbと病態の関係は興味深く、近年、我々を含む複数の研究室で研究が精力的に行われている。しかしながら、Cygbの生理的意義などは依然として不明な点が多い。特に、肝HSCにおけるCygb遺伝子の発現制御に関する報告は乏しい。本稿ではCygb研究の背景と機能解析の現状を概説し、さらにHSC活性化とCygb遺伝子発現制御機構の解明に挑む我々の研究内容について紹介する。
サイトグロビンとは
2001年、本研究室では肝HSCの活性化に関わるタンパク質を探索する過程で21kDaの新しいタンパク質を同定し、Stellate Cell-Associated Protein (STAP)と命名した(1) (図1)。
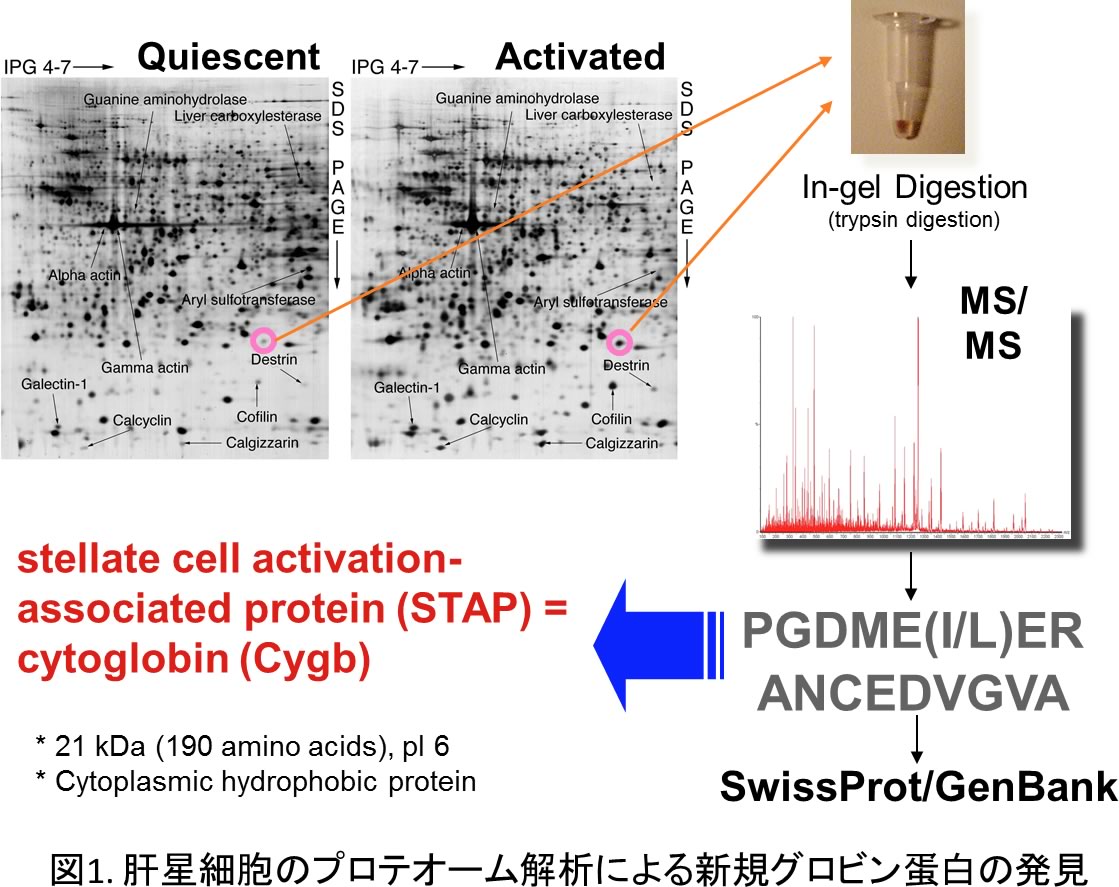
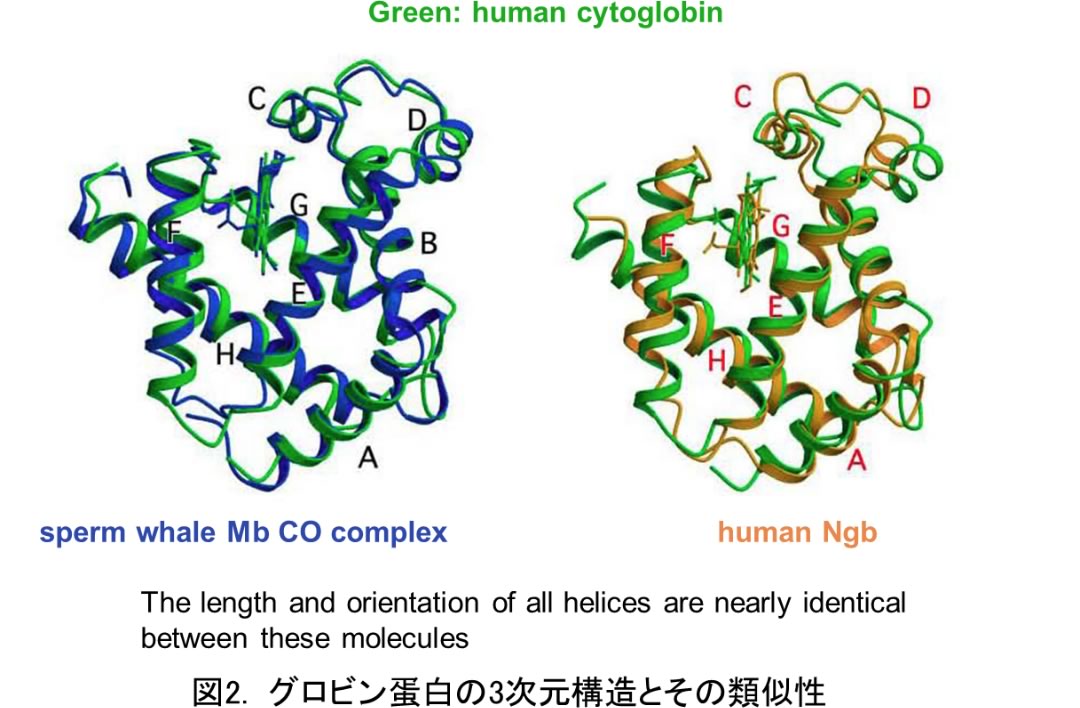
その後、この蛋白はヘモグロビン (Hb)、ミオグロビン (Mb)、ニューログロビン (Ngb)と同じグロビンスーパーファミリーに属することが明らかとなり、サイトグロビン (Cygb)と名称が統一された。CygbはMb、Hbと約25%程度のアミノ酸配列の相同性があり、グロビン蛋白の特徴である8本のαヘリックスからなる球状構造を持つ。Cygbは、X線結晶構造解析から2つのHis残基のイミダゾール基がヘムを挟み込むように6配位構造をとり、酸素 (O2)や一酸化窒素 (NO)などと結合する機能を有する (図2)。 Mb、Hbはそれぞれ150アミノ酸残基で構成されているのに対し、ヒト由来Cygbは190アミノ酸をコードし、古典的なGlobin fold配列の両端にアミノ末端側とカルボキシ末端側が約20残基ずつ付加されている(2)。
Hbは赤血球に存在しO2を全身へ運搬している。Mbは心筋や骨格筋などに存在し細胞内のO2の貯蔵やミトコンドリアへの拡散に寄与する。Ngbは中枢ならびに末梢の神経組織や目の網膜に発現しO2の運搬やNO代謝に関与している。Cygbは肝臓のHSC以外に膵臓、腎臓、肺など多数の臓器にも存在し、ビタミンAを貯蔵するpericyte、軟骨細胞や骨芽細胞に発現し、それらの細胞は共通してCollagen線維を産生するという特徴を持つ。
酸化ストレスとサイトグロビン
細胞内の活性酸素種(ROS)による酸化ストレスの蓄積は脂質、特に細胞膜の酸化を促し、細胞障害を与えることで細胞老化、組織変性および加齢関連疾患を悪化させる。精製したCygbはペルオキシダーゼ活性があるため、ROSを無毒化する作用を持つと予測される。また、Cygbは細胞内の酸素の結合や運搬に関わり、ミトコンドリアの電子伝達系と酸化的リン酸化に寄与していると考えられる。ラット肝線維化疾病モデルを用いてRecombinant adeno-associated virus-2 (rAAV-2)でCygbを過剰発現させたウイルスを門脈経由で肝臓に投入したところ、Cygbの過剰発現が酸化ストレスから細胞を保護し、組織線維化の抑制とTissue Inhibitor of Metalloproteinase-1 (TIMP-1), Transforming Growth Factor (TGF-β)およびProcollagen-1遺伝子発現が低下した。チオアセトアミドによるラット肝臓線維化モデルにおいて、リコンビナントCygb 10 mg/kg投与により血清中AST、ヒアルロン酸、ラミニン、Type I Collagenやヒドロキシプロリン濃度が低下し線維化が抑制された(3)。以上の研究は、Cygbが酸化ストレスの無毒化に関与することを提示したが、肝臓のどの細胞に起こる現象か、HSCの酸化ストレスへの影響はどの程度かは明示されていない。
酸化ストレスは細胞の代謝動態の変動によりROSが産生されることで惹起されるが、低酸素状態は、それ自体が酸化ストレスを引き起こし、ATP欠乏に加えて、酸化ストレス亢進による血管内皮細胞障害や、ミトコンドリア呼吸を抑制することで酸素消費効率を低下させる。酸化ストレスと低酸素障害は悪循環を形成し、病態進行に寄与する。低酸素時に活性化されるHypoxia inducible factor-1 (HIF-1)は低酸素に対する生体の防御機構であり、血管新生を促すVEGFや、赤血球の供給を促進するEPOの遺伝子発現を誘導する。 HIF-1はCygbのプロモーターに存在するHypoxia response element (HRE)を介しCygbの発現を誘導する(4)。また、培養細胞を低酸素下(1% O2)で培養すると、Cygb遺伝子と、HIF-1の標的であるVEGF遺伝子発現が同時に誘導されることが分かっている(5)。これらの知見から、低酸素に対するCygbの防御機構としての役割が期待されている。
本研究室ではCygb欠損 (Cygb KO)マウスを用いてアセチアミノフェン(APAP)による肝毒性の研究を行った。300 mg/kg APAP投与6時間後、野生型 (WT)マウスの肝臓では中心静脈の周辺で肝細胞の壊死が観察されたが、Cygb KOでは肝障害の軽減が見られた。APAPは肝臓の代謝酵素であるシトクロムP450 (CYP) 2E1により代謝され、N-アセチル-p-ベンゾキノイミンになる。CYP2E1はKOマウスでWTマウスと同レベルの発現があったが、血清中CYP2E1依存的代謝産物であるcystenyl-APAPおよびN-acetyl-cystenyl-APAPがKOで有意に減少した。また、CYP2E1代謝を介する四塩化炭素による急性肝炎モデルでもCygb KOマウスで肝障害の減弱が観察された。さらに低酸素下(5% O2)の肝細胞とHSCの共培養にAPAPを添加したところ、肝細胞-KO HSCに比べ、肝細胞-WT HSC共培養で肝細胞の生存率の有意な低下が見られた(6)。この結果から、HSCのCygbが肝細胞の CYP2E1活性を促すことが分かった。 肝細胞のO2レベルの調節にHSCのCygbが寄与すると推測され、酸化の代謝物による組織障害はCygbの欠失により抑制されることが分かった。今後、Cygbが他のCYPに対して、CYP2E1のような作用を示すことを実証する実験が必要である。
慢性疾患におけるサイトグロビンの生理作用
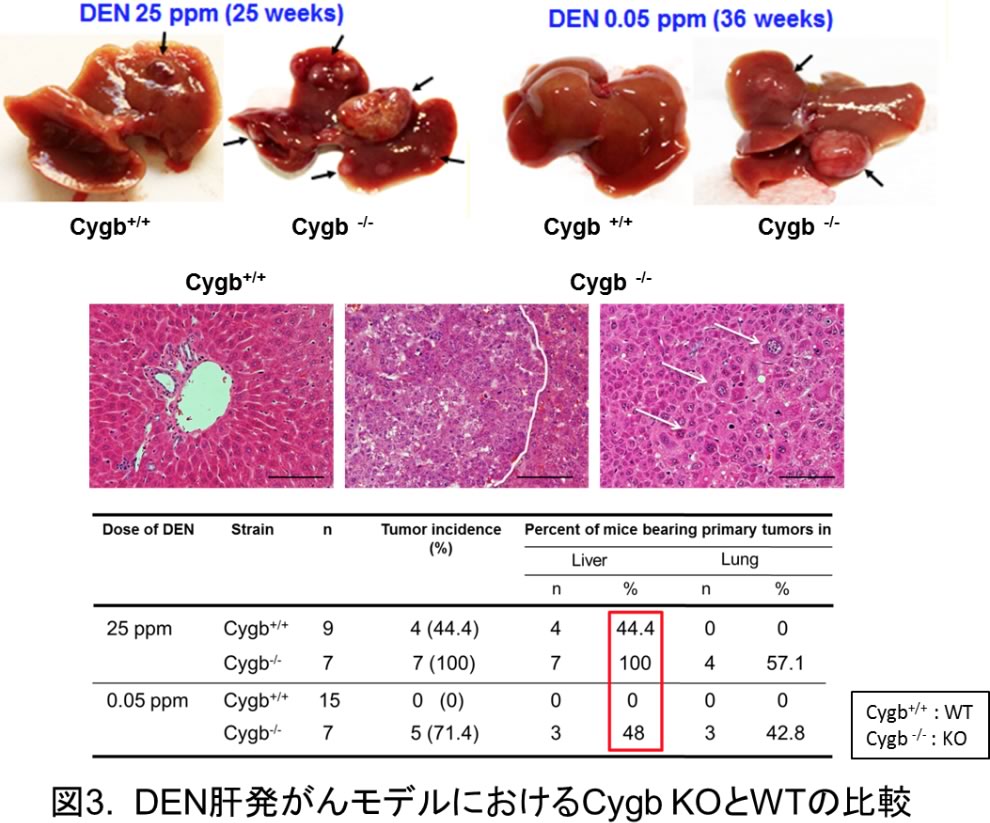
がんでは胞巣状軟部肉腫 (ASPS)の脳転移、頭頸部癌、肺非小細胞癌で低酸素によるCygbの発現量の増加と悪性度が相関するという報告がある(7)。しかし、散発性食道癌、卵巣癌、肺癌、頭頸部癌などでプロモーター領域の高メチル化とヘテロ接合体の欠損によるCygbの発現低下と癌の進行度との相関性が確認されている。Cygbは癌の種類や進行度並びに酸素量を含むがん微小環境の違いにより2つの異なる作用を持つと推測される(8)。本研究室では肝発がん剤として汎用されるジエチルニトロソアミン(DEN)をCygb KOマウスとWTマウスに25週間 (25ppm)、36週間 (0.05ppm)飲水で投与し肝発がん誘導実験を行った。その結果、DEN 25週間投与群では、WTの発癌率は44.4%に比べ、Cygb KOマウスの発癌は100%を示した。36週間 (0.05ppm)投与群では、WTマウスでは発癌しなかったのに対し、Cygb KOマウスでは57.1%の発癌率が認められた (図3)。 Cygb KOマウスではCygb陰性/Cellular retinol bonding Protein-1 (CRBP-1)・Desmin陽性細胞が存在し、肝がん周辺に顕著なPericellular fibrosisとinterleukin-1, interleukin-6とtumor necrosis factor-α (TNF-α)やTGF-βなどのサイトカイン遺伝子発現の上昇が観察された。加えて、NO由来のROSであるパーオキシナイトライト(ONOO-)レベルが著しく上昇していた (9)。更に、脂肪性肝炎背景の肝発がんでは酸化ストレス関連因子の増加が見られた(10)。
線維化は多くの臓器に共通する進行性の組織障害である。肝線維化の責任細胞と考えられるHSCは血管内皮細胞と肝細胞の間のDisse腔に存在し、正常時には静止HSCとしてビタミンAを貯蔵し、肝細胞の恒常性の維持に関わる。肝障害が慢性化するとこのHSCは活性化しビタミンA貯蔵能が低下しαSMAやCollagen (COL1A1, COL1A2), platelet-derived growth receptor (PDGFR)などを発現し、Collagen合成促進と細胞の収縮機能を亢進する。また、活性化HSCは自らTGF-βやTIMP-1、PDGFなどのサイトカインを過剰発現し、Collagenなどの細胞外マトリックス(ECM)物質の産生を促し、自身も筋線維芽細胞様の形態を呈し増殖し、肝実質の置換により線維化が誘発される。この活性化HSCの筋線維芽細胞様の形質転換は可逆性変化と考えられ、近年、脱活性化の機序解明の研究が盛んに行われている。ヒト肝線維症において、HSCで発現するCygbは線維化で増殖する門脈域の線維芽細胞で陰性を示し、線維化の進行度にCygb陽性細胞数は逆相関するため、HSC特異的マーカーとしての有用性が示唆された(11)。また、Cygbの抗酸化的作用はHSCの非活性化維持に重要であることが予想される。しかし、慢性疾患である線維化に対するCygbの分子機序は不明な点が多く、今後更なるCygb研究の発展が待たれる。
我々はヒト由来肝HSC株であるHHSteC(SceinCell社)とLX-2(ATCC社)の2種類の細胞を使用し、CygbがHHSteCでのみ発現することを見出した。 HHsteCのScienCell社推奨培養液に含まれるサプリメントの有無でCygbの発現の差異を比べたところ、Cygbの発現がサプリメント添加後時間依存的に誘導されることが分かった。興味深いことにサプリメント添加によりHHSteCは形態変化を示し、αSMAの発現減弱が見られた。現在サプリメントの含有物からCygbの発現誘導因子の探索を行っている。この研究成果はHSC脱活性化の分子機序の解明に繋がり、Cygbの線維化に関わるメカニズムの解析を展開し新規肝硬変治療法の開発が期待される。
最後に本稿を書く機会を与えて頂いた東京医科歯科大学教授、仁科博史先生に厚くお礼を申し上げると共に、日頃からご指導いただいている広島大学名誉教授、吉里勝利先生、大阪市立大学大学院医学研究科、機能細胞形態学教授の池田一雄先生、そして当研究室のメンバーにこの場を借りて深く感謝致します。
- Kawada N, et al. J Bio Chem 2001;276:25318-23.
- Sugimoto H, et al. J Mol Biol. 2004;339(4):873-85.
- Xu R, et al. Mol Ther 2006;13(6):1093-100.
- Fordel E, et al. Biochem Biophys Res Commun 2004;319:342-28.
- Guo X, et al. Biochem Biophys Res Commun 2007;364:145-50.
- Teranishi Y, et al. Lab Invest. 2015 May;95(5):515-24.
- Oleksiewicz U, et al. Hum Mol Genet 2013;22:3207-17.
- Presneau N, et al. Mol Carcinog 2005;43:141-54.
- Thuy Le TT, et al. Am J Pathol 2011;279: 1050-60.
- Thuy Le TT, et al. Am J Pathol. 2015;185(4):1045-60.
- Motoyama H, et al. Lab Invest. 2014 Feb;94(2):192-207.










