研究交流
脱細胞化骨格と肝臓再生
八木 洋、北川 雄光
慶應義塾大学
はじめに
生体内で肝臓が持つ高い再生能力は周知の事実であり、種々の切除を行った後に本来の容量・機能へ十分に回復可能である点、更に半分以上を切除しながら安全に移植が可能な性質は、他の臓器に類を見ない特徴と言える。一方で、一度体外の環境に曝された肝細胞・肝組織の機能低下は著しく、再生・増殖をするどころか数時間機能を維持することもままならない。この大きな相違は肝臓が特に体内環境に大きく依存した性格を持つ臓器であり、その再生には体内における環境の適切な理解と再現が求められることを示唆する。我々は肝再生の基盤として、1)臓器特異的立体構造、2)適切な細胞外マトリックス(ECM)環境、3)細部に渡る血液還流、を実現可能な技術の一つとして、「脱細胞化臓器骨格」に着目している。骨格そのものの性質のみならず、細胞を再生着させた際の変化を理解しながら、細胞を充填した状態で生体内に血管吻合によって留置し、生体内での充填細胞やECMの動態を観察することに主眼を置き、研究を重ねてきた。本稿では本技術開発の進捗と展望について説明する。
1. 脱細胞化組織作製方法の実際と免疫原性
組織の生細胞をすべて除去した後に残るマトリックスで構成された骨格のみを利用して、身体における組織欠損部位に補助・充填する試みは1990年代半ばから行われてきており、すでに多くが医療用として製品化されている。この脱細胞化組織の作製方法は種々報告されているが大きく分けて、1)機械的刺激による細胞膜破壊:高圧・凍結・エレクトロポレーション法・浸透圧変化と、2)薬剤による洗浄・細胞破壊:界面活性剤・酸/アルカリ・酵素・アルコール、の二つに大別される1。実際には、これらの組み合わせによって施行されることが多いが、いずれにしても効率よく細胞を破壊し、抗原性のある細胞断片が限りなく残存せずに脱細胞化され、しかもECMの構成成分である線維性蛋白およびグリコサミノグリカンなど生物学的に重要な活性を有する部分が可能な限り残存する手法が望ましいと考えられている。実際にはこれらの様々な手法のうち、どれを用いるべきかについてはまだ議論の余地があり確定した方法はないが、脱細胞を行う対象となる組織・臓器によっても、至適な手法が異なると考えられる。
製品化された主な医療用製品と由来種・組織・使用部位を示した(表1)。すでに多くの製品がヒトのみならずブタ・ウシなどの異種の様々な由来組織から作製されている1。製品化に至る固定法によっても異なるが、これら製品化の事実を見ると、脱細胞化の工程を経た組織の免疫原性自体は非常に低く、異種移植においても拒絶反応を惹起することなく生着可能であると言える。また実際に脱細胞化組織の免疫原性について評価した報告も散見されている。例えば脱細胞化した血管を用いたグラフトの移植後の組織反応を評価した報告によれば、通常の脱細胞処理をしていない生体グラフトと比較してHLA ClassI, II抗体産生が低いことが示されている2。またブタの脱細胞化肝臓骨格をラットの皮下に移植した実験では、免疫学的反応の亢進を認めなかったことが明らかにされている3。細胞の除去の程度によって免疫反応が異なるとする報告があるが4、骨格自身に対する強い免疫反応について指摘した報告は見られない。従って、細胞が充填されていない脱細胞化組織自体は、一つの被覆・充填素材として安全に使用可能であることは明らかである。ただし、血液循環が可能な臓器全体を用いた骨格を移植した後、持続的な血液還流下でどのような免疫応答が惹起されるかについては不明であり、今後詳細を明らかにしていく必要がある。
Crapo PM, et al. Biomaterials 2011から抜粋・改変・翻訳
| 由来種 | 組織 | 製品名 | 治療適応部位 |
|---|---|---|---|
| ヒト | 皮膚 | AlloDerm® | 軟部組織 |
| AlloPatch HDTM, FlexHD® | 腱、乳房 | ||
| NeoFormTM | 乳房 | ||
| GraftJacket® | 軟部組織、慢性外傷 | ||
| 心膜 | IOPatchTM | 眼科領域 | |
| ウマ | 心膜 | OrthAdapt®, Unite® | 軟部組織、慢性外傷 |
| CopiOs® | 歯科領域 | ||
| Lyoplant® | 硬膜 | ||
| Perimount® | 心臓弁 | ||
| ウシ | 皮膚 | TissueMendTM | 軟部組織 |
| ブタ | 皮膚 | StratticeTM | 軟部組織 |
| Zimmer Collagen Repair PatchTM | 軟部組織 | ||
| 膀胱 | MatriStem® | 軟部組織 | |
| 小腸 | Oasis®, Surgisis® | 軟部組織 | |
| RestoreTM | 軟部組織 | ||
| FortaFlex® | 軟部組織 | ||
| CorMatrix ECMTM | 心膜、心臓組織 | ||
| 胸膜中皮 | Meso BioMarixTM | 軟部組織 | |
| 心臓弁 | Hancock® II, Mosaic®, Freestyle® | 心臓弁 | |
| PrimaTM Plus | 心臓弁 | ||
| EpicTM, SJM Biocor® | 心臓弁 |
2. 脱細胞化臓器骨格の特徴と意義
再生素材として使用可能なECMのうち、生体にある組織そのものから生細胞をすべて除去して作製する脱細胞化骨格、中でも臓器由来の骨格には人工素材や個別に調整したECM成分のみを使用する場合とは異なる特徴が認められる。その一つに挙げられるのは、細胞一つ一つに血液を運搬する微細な毛細血管構造から、体内の循環血流との接合部である大血管構造まで、脈管系の連続構造がμm~cmスケールまで途切れる事無く再現されている点である。臨床の現場では微小循環だけでは組織が壊死を呈して脱落することが知られている。この構造上の特徴は組織再生の上で大変重要な要素の一つと言える。二つ目は、これまで再生が困難であった複雑な臓器特異的三次元構造を始めから有し、動物種や臓器を越えた様々なサイズや形態で再現可能な点である。また三次元の形態そのものが、そこに生着した細胞が持つ再生能に大きな影響を与えることも明らかにされており5、生体本来の構造を用いることが臓器再生に非常に有用であると考える。三つ目の特徴は、前述の三次元構造の元となっているコラーゲンなどの生体組織特異的な種々のECM成分が脱細胞化後も大枠で保たれている点である。組織ごとの局所に特異的なECM自身が細胞の再生・成熟・分化などに重要な役割を担うことはすでに明らかにされているため6、人工素材からなる足場構造とは異なり、生体由来の複雑なECMの組み合わせが細胞に与える影響は大きいと考えられる。
3. 脱細胞化組織の滅菌(殺菌)法
脱細胞化処理によってECMのみを残した後、組織・臓器の機能を持たせるには、これを鋳型として必要な種々の細胞を再注入し組織再生を行う必要がある。そのためには充填した細胞の安全かつ効果的な培養法およびその後の効率的な組織移植法を確立しなければならない。そのためにまず脱細胞化後の組織の性質・形状を損なうことなく、効率的に滅菌処理を行う手法の確立が必須であり、現段階では、組織・臓器採取から運搬・脱細胞化に至る周辺機器の確実な滅菌化を徹底し、汚染の機会を可能な限り減少させるための処置を施した上、抗生剤・抗真菌剤や酸を循環させることによって雑菌の汚染を排除する手法が取られている(図1)。しかしながら、薬剤や培地の交換・細胞の注入などの作業介入によって、その都度汚染の機会が伴うことは避けられない。これに対して我々は摘出した臓器を一度チャンバー内に封入した後に、これを外部に露出することなく一連の手技を完遂できるシステムを開発中である(AMED再生医療実現拠点ネットワークプロジェクト(技術開発個別課題)「幹細胞パッケージングを用いた臓器再生技術と新規移植医療の開発」: http://www.jst.go.jp/saisei-nw/)。いずれにしても脱細胞化骨格を用いて細胞再充填(再細胞化)を行い、再生組織の医療応用を実現化するためには、滅菌処理方法の定型化が必須である。
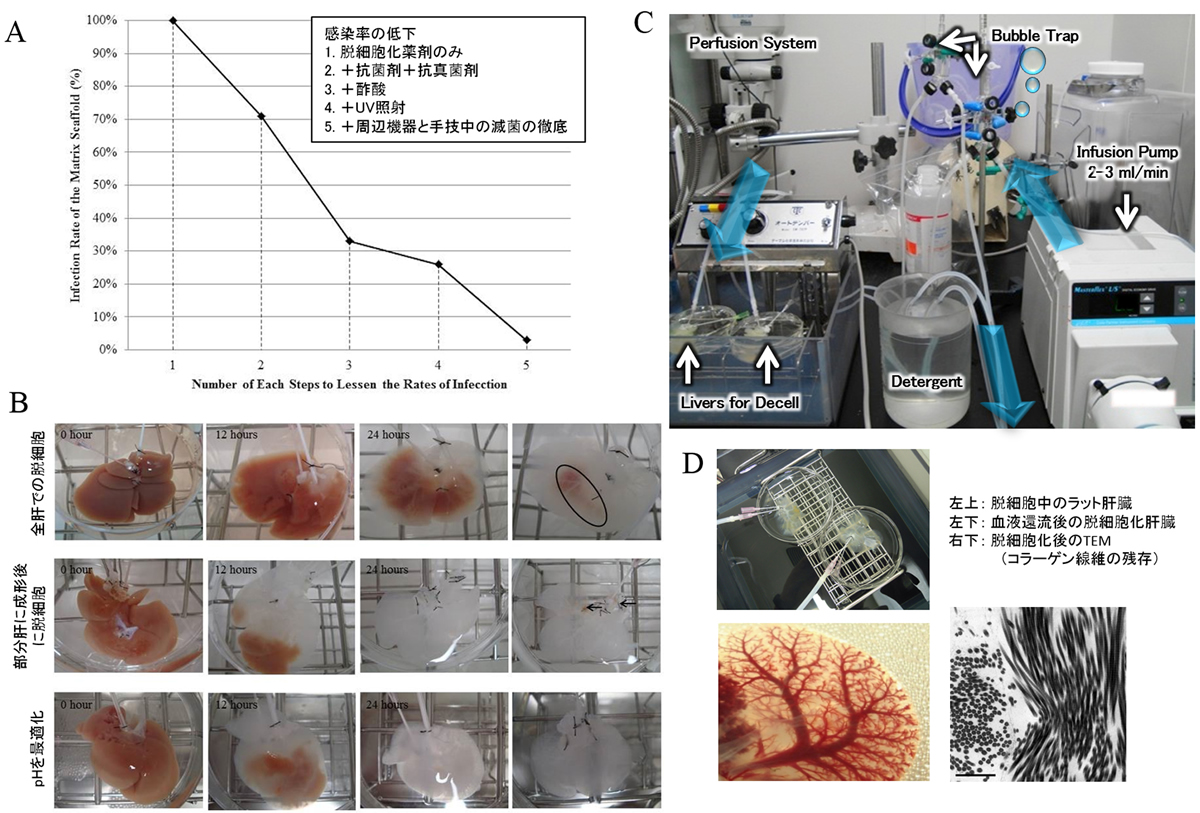
図1:感染率の向上:清潔操作で施行する脱細胞化システム
Kadota Y, et al. Organogenesis 2014から一部抜粋・改変
4. 再細胞化法の実際
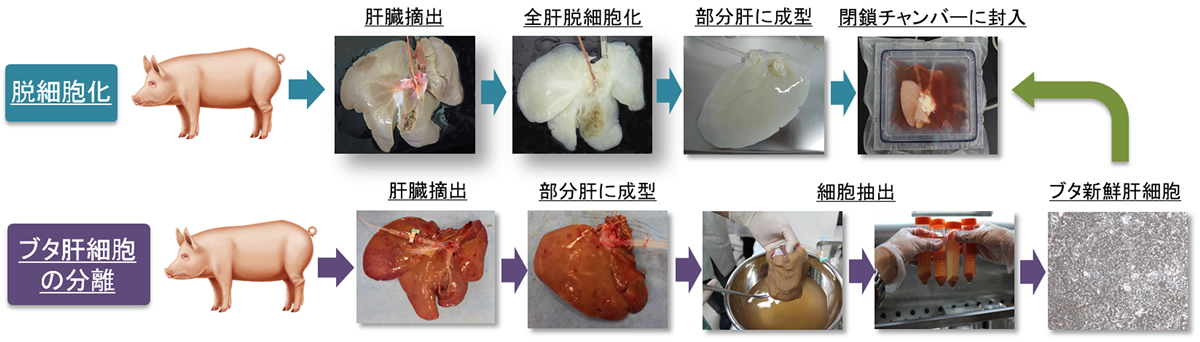
次に再細胞化の手法については、脱細胞化以上に多くの事象を議論し評価しなくてはならない。特に使用する細胞種、細胞の注入ルート・圧・速度・順序および注入後の評価法を確立することは、本技術の臨床応用へ向けた最重要課題の一つである。臓器レベルで機能的組織を再現するためには、複数種類の細胞を秩序立って生着させた三次元構造を作製しなくてはならない。これらの細胞はもちろん対象となる組織・臓器によって、大きさ、必要数、ECMへの接着の程度、細胞強度などがそれぞれ異なるため、細胞それぞれに合わせた異なる生着方法の確立が必須と考えている。例えば、肝臓では胆管細胞を胆管から、血管内皮細胞を門脈と肝静脈から(将来的には肝動脈からも)、肝細胞および間葉系幹細胞などの非間質細胞を門脈から、それぞれ特定の順序・一定の注入圧で充填することで、安定した細胞充填が得られることが示されている。ただし、体外で骨格内のすべてのスペースを埋めることは不可能であるため、我々は、脱細胞化骨格内に移植直後の機能発現に耐えうるよう、一部に増殖能の高い未熟な細胞を含めた複数の細胞を一気に充填して移植することで、結果的に充填された細胞自身の自己増殖や血流に乗って遊走してくることが期待される血球系細胞などの補助によって、移植後の体内で成熟化を果たす再生臓器に発展していくことを期待している。実際にラット再生肝臓の実験では移植した後に肝臓の索状配列が明確化した結果を得ている7。我々はブタ肝臓再生に必要な要素技術の一つ一つをラットから得た結果を元に着実に評価・発展させることで、可能な限り効率的に大型化を進めている(図2)8。実際に大型動物を使った肝臓脱細胞化の報告は最近になって散見されるようになった9,10。しかしながら未だ移植成功例の報告はなく、今後は再細胞化後に実際に移植し、生体内での機能解析や術後変化の評価法を確立することが必須である。
文献
- Badylak SF. The extracellular matrix as a biologic scaffold material. Biomaterials 2007; 28: 3587-93.
- Hawkins JA, Hillman ND, Lambert LM, et al. Immunogenicity of decellularized cryopreserved allografts in pediatric cardiac surgery: comparison with standard cryopreserved allografts. J Thorac Cardiovasc Surg 2003; 126: 247-52; discussion 52-3.
- Mirmalek-Sani SH, Sullivan DC, Zimmerman C, Shupe TD, Petersen BE. Immunogenicity of decellularized porcine liver for bioengineered hepatic tissue. The American Journal of Pathology 2013; 183: 558-65.
- Lee W, Miyagawa Y, Long C, Cooper DK, Hara H. A comparison of three methods of decellularization of pig corneas to reduce immunogenicity. International Journal of Ophthalmology 2014; 7: 587-93.
- Rozario T, DeSimone DW. The extracellular matrix in development and morphogenesis: a dynamic view. Dev Biol; 341: 126-40.
- Hynes RO. The extracellular matrix: not just pretty fibrils. Science 2009; 326: 1216-9.
- Kadota Y, Yagi H, Inomata K, et al. Mesenchymal stem cells support hepatocyte function in engineered liver grafts. Organogenesis 2014; 10: 268-77.
- Yagi H, Fukumitsu K, Fukuda K, Kitago M, et al. Human-Scale Whole-Organ Bioengineering for Liver Transplantation: a Regenerative Medicine Approach. Cell Transplant 2013; 22: 231-42.
- Wang Y, Bao J, Wu Q, et al. Method for perfusion decellularization of porcine whole liver and kidney for use as a scaffold for clinical-scale bioengineering engrafts. Xenotransplantation 2015; 22: 48-61.
- Ko IK, Peng L, Peloso A, et al. Bioengineered transplantable porcine livers with re-endothelialized vasculature. Biomaterials 2015; 40: 72-9.