研究交流
肝組織工学用足場材料としての脱細胞化肝臓由来可溶化マトリックス
中村晋太郎1)、井嶋博之2)、
1) 九州大学大学院工学府物質プロセス工学専攻
2) 九州大学大学院工学研究院化学工学部門
1. はじめに
1993年にRobert Samuel LangeとJoseph Philip Vacantiにより提唱された組織工学は、再生医療技術の確立において有望な概念とされている1)。我々はこれまでに、組織工学的アプローチによる肝臓の再構築を目指して研究してきた。言うまでもなく肝臓は生命の恒常性維持において重要な臓器であるため、肝臓の再構築技術の確立が切望されている。我々は、これまで工学的立場から肝臓の機能を担う肝実質細胞(肝細胞)の機能発現を促進する培養系の構築に取り組んできた。ここで、細胞は生体内において細胞外マトリックス(ECM)によるゲルに包まれるように存在しており、そのECM組成や構造は臓器種類により異なることが知られている2)。また、細胞に対して様々な効果を示す増殖因子は、安定性に欠けるといった問題を抱えている3)。この問題を解決するために増殖因子を足場材料に固定化する試みがなされており3)、生体内ではECM成分の一つであるプロテオグリカンに結合して存在している。これらの知見を基に、我々は細胞を育む場としての足場に着目した(図1)。肝組織構築実現のためには細胞の微小周囲環境を整えることが重要であると考え、肝臓特異的マトリックス(L-ECM)の開発に取り組んできた。本稿では、L-ECMを用いた肝組織構築に対するこれまでの研究内容について紹介する。
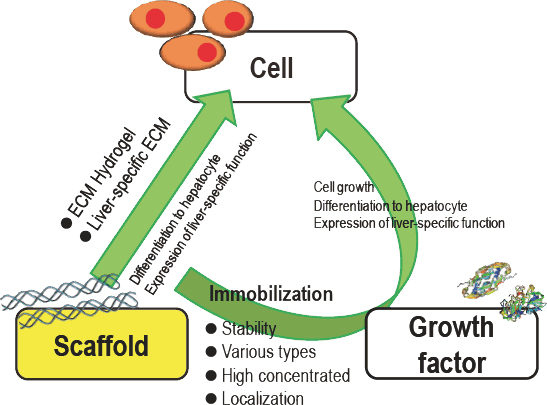
図1 肝組織構築に対して有効な材料の開発概念
細胞に対して足場材料からの直接的なシグナル、固定化増殖因子によるシグナルを同時に達成することで相乗効果を期待した材料。
2. 肝臓特異的マトリックス
近年、組織から細胞を抜き去る技術である脱細胞化が注目されている4)。脱細胞化後の組織は大筋の血管網が維持されていることが報告されており、生体適合性材料であることから移植可能な組織の鋳型として盛んに研究されている。我々の研究においても肝臓特異的マトリックスの取得に際して脱細胞化技術を用いている。ここで、前述のように脱細胞化組織は血管網といった構造を有した材料である。したがって、脱細胞化組織をそのまま用いた場合、個々の細胞をECMによって包み込んだ状態を構築することは困難である。そこで本研究では、脱細胞化後の肝臓を可溶化し再度三次元構造体、特にゲルを形成することを目指した。まず、肝臓の脱細胞化においては様々な方法が提唱されている4)。移植用の鋳型としては構造およびその力学強度が重要であるが、我々の目的に対しては成分が最も重要である。したがって、ECM成分に対する損傷が比較的小さい非イオン性界面活性剤であるTriton X-100を用いて脱細胞化を施している。得られた脱細胞化肝臓に残存していたDNA量は極めて少なく、また免疫染色により様々な型のコラーゲンやラミニンなどの成分により構成されていることが分かった。さらに、これをペプシン処理することで可溶化したL-ECMを開発した(図2)。
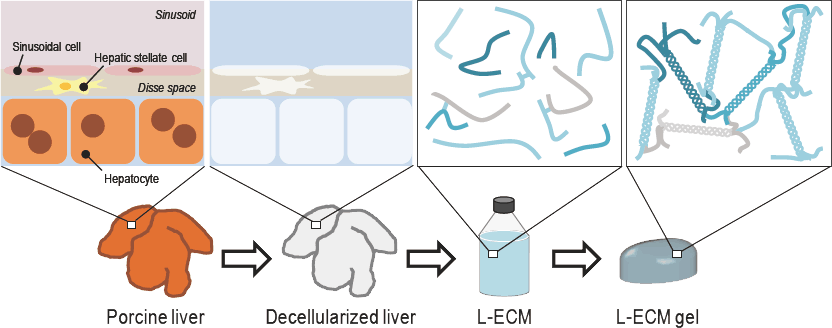
図2 脱細胞化および可溶化による材料取得の概念図
界面活性剤を用いてブタ肝臓を脱細胞化し、ペプシン処理により可溶化することでL-ECMが得られる。
3. L-ECMのゲル化および増殖因子の固定化
増殖因子は細胞の増殖、生存、分化、機能発現などの機能を調整する5-7)。特に発生の段階で組織や臓器の形成に大きな役割を担っているため組織を再生させる場合に重要な役割を果たすと考えられており、現在では増殖因子の種類は100種類を超える。このような特徴を有する増殖因子は組織工学において重要な役割を担っているが、安定性に欠け非常に高価なものである。そこで足場材料に対して増殖因子を固定化する試みがなされている。Tabataら3)は酸性ゼラチンに対して塩基性繊維芽細胞増殖因子(bFGF)を静電的に固定化することによりbFGFの生理活性を維持することに成功している。このように、増殖因子を足場に固定化することにより、生理活性の長期安定性の獲得や増殖因子の使用量の低減だけでなく、足場-増殖因子複合体形成による活性向上も期待できる。一方、足場材料はその種類だけでなく形状も重要である。我々は、肝細胞をコラーゲンゲル内において培養することで、肝細胞のスフェロイド培養と同等以上の肝特異的機能発現を実現している8)。また、前述のように生体内において肝細胞はECMゲルに包まれて存在する。したがって、足場材料の形状としてゲルが好ましいと考えた。まず、増殖因子固定化能に関して調査したところ、L-ECMは肝細胞増殖因子を90%近い効率で固定化可能であることが分かった。これは、L-ECMの成分として含まれるグリコサミノグリカンと増殖因子との静電的相互作用により生じたと考えられる。生体内においても増殖因子はECM成分に固定化されており、またECM成分と増殖因子が複合体を形成することで増殖因子の生理活性が向上することが報告されている9-11)。一方、ゲルを形成する様々な方法が報告されているが、温度およびpHを生体環境に調整することで生じる自発的な分子間架橋によるゲル化は細胞に対して最も穏和な方法である。L-ECMは温度およびpHを調整することでゲルを形成することができた。すなわち、L-ECMを開発したことで増殖因子固定化可能な肝臓特異的マトリックスゲルの構築を可能にした。
4. L-ECMを用いた三次元ゲル培養
肝細胞の肝特異的機能発現はその細胞形態に強く依存することが知られている12)。また、肝細胞は生体から単離後すぐさまに特異的な機能を喪失する13, 14)。このような特徴を有する肝細胞の肝特異的機能発現を高いレベルで長期的に維持するために様々な培養系が開発されている。例えば、前述のようにコラーゲンゲルに肝細胞を包埋することで、肝スフェロイドと同等以上の機能発現に成功している8)。また、2層のコラーゲンゲルの境界において肝細胞を培養(サンドイッチ培養)することで肝特異的機能が長期的に維持される15)。前者は肝細胞が生体内と同様の立方体状の形態を形成することに起因し、後者は細胞間結合を形成することに起因した現象であると考えられている。本研究では、材料成分による影響を検証するために細胞間結合の形成を伴わない肝細胞のゲル内分散培養を試みた。比較対象としてブタ皮膚由来I型コラーゲン(I col)ゲルを用いたところ、タンパク合成活性の指標となるアルブミン合成活性はL-ECMとI型コラーゲンに相違なく、両条件で培養初期と同等の活性を培養21日目においても維持していた(図3)。ここで特筆すべきは、薬物代謝活性の指標であるCYP1A1によるエトキシレゾルフィンの脱エチル化反応(EROD活性)である。I型コラーゲン条件でもEROD活性の増大は見られたが、L-ECM条件でさらに増大していた。一方、窒素代謝の指標である尿素合成活性は両条件で低下していた。アルブミン合成活性は、一般的に細胞形態に強く依存し、立方体状の形態を形成した場合に高く維持されることが知られている。EROD活性の向上に関しては、肝特異的マトリックスの効果やL-ECMの増殖因子固定化能により増殖因子が局所高密度化したことによる効果などが予想される。尿素合成活性は他の機能に比べ複雑な回路を通るため維持することが困難である。他者の報告を鑑みると肝細胞凝集体、いわゆるスフェロイドを形成した場合に尿素合成活性の維持および向上に成功している。今後、L-ECMゲル内において肝細胞スフェロイド培養を行うことで尿素合成活性の維持に対する効果の検証を行っていく。
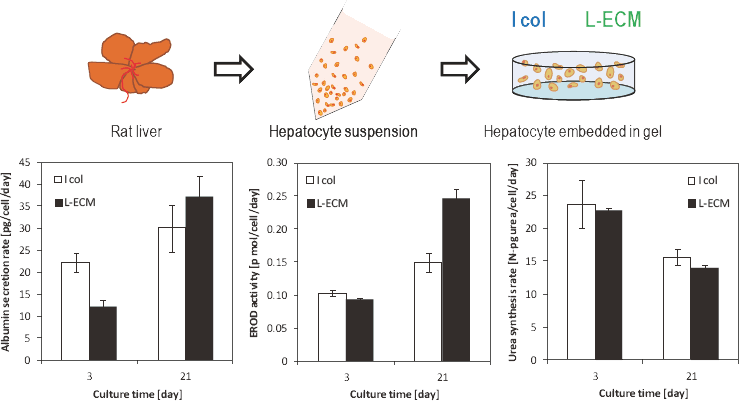
図3 L-ECMゲル内において培養された肝細胞の肝特異的機能
アルブミン合成活性およびEROD活性は維持もしくは向上し、尿素合成活性は低下した。
5. 肝細胞移植用キャリア材料としての応用
肝臓移植に置き換わる技術の一つに肝細胞移植がある。これは肝細胞を肝臓内に移植する同所性、肝臓とは異なる部位、例えば腎臓などに移植する異所性移植に分けられる。同所性移植の場合、移植肝細胞に対して適した環境を提供できるといった利点があるが、門脈血栓症や肺動脈塞栓症を惹起する恐れがある。この問題を解決するために肝細胞をキャリア材料と共に移植する方法が試みられている。例えば、フィブリンゲルをこのキャリア材料として用いることで上記問題を解決出来るだけでなく肝細胞の生着率の向上に対しても効果的であることが報告されている16)。そこで、我々はL-ECMゲルを肝細胞移植用のキャリア材料として用いた場合の効果を検証した。移植に際し、肝臓の約70%を切除する部分肝切除術を施すことで、肝不全患者において生じている肝再生時環境を再現した。in vitro培養検討と同様にI型コラーゲンを比較対象として用い、肝細胞をゲル内に分散したサンプルを作製した。結果としては、部分肝切除を施すことで細胞生存率が増加し、L-ECMゲルを用いることでさらなる細胞生着率の向上を達成している。これは、L-ECMゲルをキャリア材料としたことで肝臓特異的マトリックスによる増殖因子固定化可能なゲル環境を提供できたことに起因すると考えられる。ここで、今回得られた細胞生着率は他者の報告(2-10%程度)17, 18)より高い値(約27%)であった。
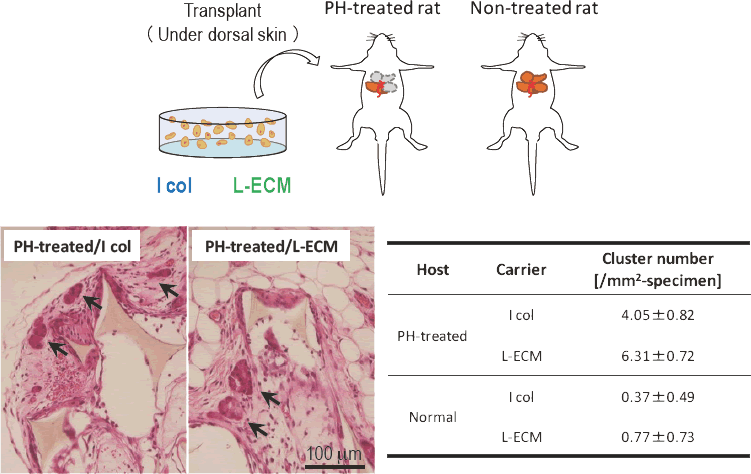
図4 肝細胞移植用のキャリア材料として応用した例
部分肝切除を施されたラットにL-ECMゲルをキャリア材料として用いた場合に最も高い細胞生着率およびより大きな肝組織体の形成を実現できる。PHは部分肝切除を表し、矢印は肝組織を示す。
6. おわりに
我々は、組織工学の一因子である足場に着目し肝臓構築に対してアプローチを行った。足場材料として肝臓特異的マトリックスを用いることで肝細胞に対して適切な微小周囲環境を提供することにより肝組織構築の実現が可能であると仮説を立てた。ブタ肝臓を脱細胞化することでL-ECMを取得した。得られたL-ECMは細胞成分が極めて少ない肝臓特異的マトリックスであると期待された。さらに、増殖因子固定化能を有しゲルを形成することが可能であることを見出した。L-ECMゲル内において分散培養された肝細胞のアルブミン合成活性およびEROD活性は21日間維持され、L-ECMゲルを肝細胞移植用キャリア材料として用いることで肝細胞の生着率向上およびより大きな肝組織体の形成を実現した。したがって、L-ECMは肝組織構築を行う上で有効な足場材料であると考えられる。しかしながら、未だに治療に有効なサイズの肝組織の構築には至っていない。今後は、肝細胞に酸素および栄養素を提供するための血管網、移植に耐えうる力学強度を提供可能な技術とL-ECMを組み合わせることで実用スケールの肝組織構築を試みたい。
最後に、本稿執筆の機会をご提供くださった慶應義塾大の須藤亮先生に感謝申し上げます。
参考文献
- Langer R, Vacanti JP. Tissue Engineering. Science. 260, 5110, 920–926 (1993).
- Brown BN, Barnes CA, Kasick RT, Michel R, Gilbert TW, Beer-Stolz D, Castner DG, Ratner BD, Badylak SF. Surface characterization of extracellular matrix scaffolds. Biomaterials. 31, 3, 428-437 (2010).
- Tabata Y, Nagano A, Ikada Y. Biodegradation of hydrogel carrier incorporating fibroblast growth factor. Tissue eng, 5, 127–138 (1999).
- Crapo PM, Gilbert TW, Badylak SF. An overview of tissue and whole organ decellularization processes. Biomaterials. 32, 12, 3233-3243 (2011).
- Kang YH, Berthiaume F, Nath BD, Yarmush ML. Growth factors and nonparenchymal cell conditioned media induce mitogenic responses in stable long-term adult rat hepatocyte cultures, Exp. Cell Res. 293, 239–247 (2004).
- Ito Y, Hasuda H, Terai H, Kitajima T. Culture of human umbilical vein endothelial cells on immobilized vascular endothelial growth factor. J Biomed Mater Res A. 74A, 659–665 (2005).
- Reuss B, von Bohlen, Halbach O. Fibroblast growth factors and their receptors in the central nervous system. Cell Tissue Res 313, 139–157 (2003).
- Ijima H. Practical and functional culture technologies for primary hepatocytes. Biochem Eng J, 48, 332–336 (2010).
- Ijima H, Kubo T, Hou YT. Primary rat hepatocytes form spheroids on hepatocyte growth factor/heparin-immobilized collagen film and maintain high albumin production. Biochem Eng J, 46, 227–233 (2009).
- Ishii T, Sato M, Sudo K, Suzuki M, Nakai H, Hishida T, Niwa T, Umezu K, Yuasa S. Hepatocyte growthfactor stimulates liver-regeneration and elevates blood protein level in normal and partially hepatectomized rats. J Biochem, 117, 5, 1105–1112 (1995).
- Paralkar VM, Vukicevic S, Reddi AH. Transforming growth factor-beta binds collagen IV of basement membrane matrix: implications for development. Dev Biol, 143, 2, 303–308 (1991).
- DiPersio CM, Jackson DA, Zaret KS. The extracellular matrix coordinately modulates liver transcription factors and hepatocyte morphology. Mol Cell Biol. 11, 9, 4405-4414 (1991).
- Reid LM, Jefferson DM. Culturing hepatocytes and other differentiated cells. Hepatology, 4, 3, 548–559 (1984).
- Dunn JC, Yarmush ML, Koebe HG, Tompkins RG. Hepatocyte function and extracellular matrix geometry: Long-term culture in a sandwich configuration. FASEB J, 3, 174–177, (1989).
- Dunn JC, Tompkins RG, Yarmush ML. Long-term in vitro function of adult hepatocytes in a collagen sandwich configuration. Biotechnol Prog. 7, 3, 237-245 (1991).
- Bruns H, Kneser U, Holzhüter S, Roth B, Kluth J, Kaufmann PM, Kluth D, Fiegel HC. Injectable liver: a novel approach using fibrin gel as a matrix for culture and intrahepatic transplantation of hepatocytes. Tissue Eng, 11, 11–12, 1718–1726 (2005).
- Mooney DJ, Sano K, Kaufmann PM, Majahod K, Schloo B, Vacanti JP, Langer R. Long-term engraftment of hepatocytes transplanted on biodegradable polymer sponges. J Biomed Mater Res, 37, 3, 413–420 (1996).
- Kneser U, Kaufmann PM, Fiegel HC, Pollok JM, Kluth D, Herbst H, Rogiers X. Long-term differentiated function of heterotopically transplanted hepatocytes on three-dimensional polymer matrices. J Biomed Mater Res, 47, 4, 494–503 (1999).










