研究交流
生体内微小環境の模倣を通じた高機能肝組織の構築
小島伸彦
横浜市立大学大学院 生命ナノシステム科学研究科
1. はじめに
多細胞生物では種々の細胞が組織や臓器といった「社会」を構築することで、細胞単独では得られない多様な機能を実現している。では、試験管内においても細胞の配列を制御して細胞社会を再構築できれば、組織や臓器がもつ高い機能を再現できるのではないか?さらには細胞社会の構造を任意に制御することで、人工的な機能や未知の機能を導きだすことも可能なのではないか?我々はこのような仮説に基づいて研究を行っている。
細胞の多くは3次元的な培養を行うことで、より生体内に近い機能や挙動を示すことが知られている。特に「細胞凝集体」は昔から利用されてきた3次元培養法であり、現在でも肝細胞(spheroid)、ES・iPS細胞(embryoid body)、膵β細胞(pseudoisletあるいはislet-like cell cluster)、神経幹細胞(neurosphere)など多方面で使用されている。しかしながら、その作製方法は従来からほとんど変わっておらず、凝集体作製の過程において、内部構造や細胞配列の意図的な制御を行う手法については、ほとんど議論がなされていない。
では、細胞配位を制御するためにはどのような方法があるだろうか。これまで我々は「細胞を一つ一つ配列させる方法」、「細胞の自発的な配列能を利用する方法」、「ハイドロゲルビーズを利用して流路を作製する方法」について報告を行ってきた。本稿ではこれらの技術を改めて紹介したい。
2. 細胞を一つ一つ配列させる方法
我々は一つ一つの細胞を光ピンセットで操作し、マイクロデバイスの中で細胞同士を直接接着させるという方法を考案した。しかし、細胞自身の接着様式に基づいた細胞間接着が形成されるには、少なくとも数分間、細胞と細胞とを接触させておく必要があった。我々は生化学的なアッセイなどで日常的に使われるアビジン-ビオチンによる強力な結合力に着目し、一方の細胞表面をアビジン、他方をビオチン修飾することで、細胞と細胞とを接触させたまま保持する手法を開発した[1]。この方法を用いることで細胞同士はほぼ瞬時に結合し、互いの細胞膜が密着する。その後、細胞自身の接着機構によって細胞接着が形成されるため、アビジン-ビオチンによる細胞結合効果が消失したとしても、細胞間接着は維持される。細胞表面の修飾や強制的な細胞間結合による細胞毒性は低く、アビジン-ビオチン結合で連結した細胞組織をディッシュ上に静置するとディッシュに接着・伸展し、それらの細胞が増殖することも確認した。これまで20個程度の細胞を配列することに成功している(図1)。用いた光ピンセットは細胞をトラップする能力については問題がなかったが、トラップした細胞を移動させる速度が遅かったため、20個の細胞を接着させて繋げるために2時間程度が必要であった。装置の機械的要素を改良・自動化すれば、より多くの細胞からなる組織の構築が可能となるだろう。
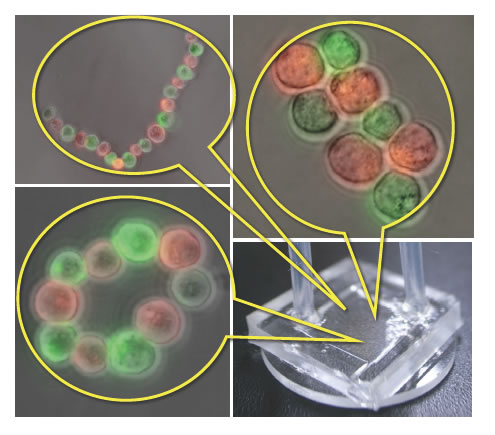
図1 光ピンセット、マイクロデバイス、アビジン-ビオチン結合を用いて細胞を組立てる方法
赤い細胞と緑の細胞(ここでは両方ともHep G2細胞を使用)はそれぞれ表面にアビジンとビオチンが修飾されており、異なる色の細胞を接触させると瞬時に接着することができる。このような細胞をマイクロデバイス内の空間で、光ピンセットによって操作することで、任意の配列をもつ細胞組織を組立てることができた。
3. 細胞の自発的な配列能を利用する方法
上述の細胞を一つずつ並べる方法では、細胞の配列操作に時間を要した。また、高速で細胞を配列できたとしても、配列した細胞が果たしてそのままの状態を保つことができるかどうかは疑問であり、細胞が自発的に再配列する可能性が考えられる。では、この再配列の可能性を逆手にとって、細胞に自発的に配列を作らせることはできないだろうか?そこで、2種類の細胞から凝集体を形成し、細胞が移動していく様子を観測することを計画したが、種類の異なる細胞集団を一緒に凝集させようとしても、同種の細胞が優先的に凝集してしまう。この問題を解決するために、再びアビジン-ビオチンによる強制的な結合を用いることとした。これにより2種類の細胞を完全に混在させた状態で凝集させることが可能となった。面白いことに、アビジン-ビオチンによる細胞間結合は数時間で解除されるとみられた。このため、2種類の細胞が混在しているという、細胞社会にとって非常に不安定な状態は長く続かず、安定な状態の細胞配列へと自発的に変化するシステムを作ることが可能となった。すなわち、肝細胞と血管内皮細胞を混在させた凝集体を作製したところ、凝集体の内部で血管内皮細胞が移動し、ネットワーク様パターンを形成していく様子を観測することに成功した(図2)[2]。細胞配列のパターンは細胞の組み合わせに依存していることも明らかとなり、生体内の組織における細胞と細胞との関係性が試験管内でも維持されている可能性があると考えられた。2種類の細胞によって作り出される自発的な細胞配列パターンの変化は、アクチンの重合阻害剤によって抑制できるが、E-カドヘリンの中和抗体やRho-associated protein kinase (ROCK) 阻害剤は効果がみられなかった。このことから、我々が観測している自発的な細胞配列現象においては、いわゆる細胞接着装置とは異なる分子群が関与している可能性もあり、現在スクリーニングを行っている。さらには細胞配列パターンがどのようなルールによって形成されるのか、細胞の組み合わせによって変化するパターンを予測することができるのか、といった疑問に答えるために、数理モデルの構築とシミュレーション(第20回肝細胞研究会にて発表)にも取り組んでいる。
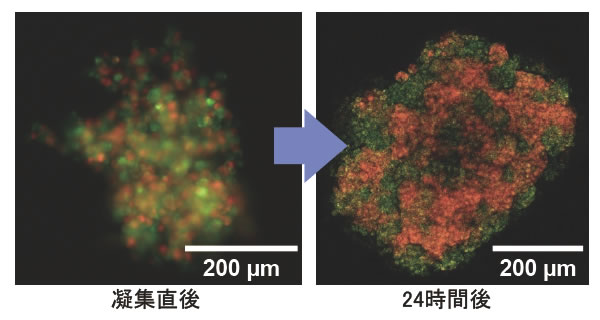
図2 自己組織化現象による細胞配列をリモデリングする方法
血管内皮細胞株であるMS1と肝細胞株であるHep G2細胞の細胞表面を、それぞれアビジンあるいはビオチンで修飾し、赤色と緑色の蛍光で標識した。同数の細胞を入れたシャーレを旋回することで、2種類の細胞が混じり合ったヘテロな凝集体を数分で作製することができた(左側)。これを培養すると自発的な細胞の移動が生じ、細胞の組み合わせに依存したパターンが出現した(右図)。なお、同一種類の細胞の半分をアビジン修飾、残る半分をビオチン修飾するなどの工夫によって、3種類以上の細胞からなるヘテロ凝集体を作製することや、細胞比を変更することも可能である。
4. ハイドロゲルビーズを利用して流路構造を構築する方法
アビジン-ビオチンを利用した細胞の結合は、数時間後にはその効果が消失することもあり、これまでのところ大きな毒性はみられていない。しかしながら、細胞膜を加工することから、予期せぬ問題が生じる可能性がある。そこで我々は、高分子を含有した培養液を利用して細胞を短時間で凝集させ、その状態で培養することで凝集体を作製する方法を開発した[3]。この手法では細胞に加工を施す必要はなく、直径100 nm~100 µmの粒子状の物体を細胞と共に凝集させることも可能であった。この特徴を利用して、細胞と同程度の直径(およそ20 µm)を持つハイドロゲルビーズを用いて、細胞:ビーズ比を1:1の割合とした凝集体の作製を試みた。その結果、内部にビーズが連続的に配列した、あたかも流路のような構造をもつ凝集体を構築できることがわかった(図3)[4]。ハイドロゲルビーズは比較的大きな分画分子量をもつため、酸素や低分子化合物だけでなく、多くのたんぱく質もハイドロゲルビーズ内を移動できると考えられる。これにより凝集体内部における酸素や栄養素などの物質交換が改善されることが予想され、実際にハイドロゲルビーズを含む凝集体において、低酸素状態で誘導される転写因子Hypoxia Inducible Factor (HIF)-1の発現の低下や、アルブミン分泌、アンモニア消費の活性の向上がみられた。また、ハイドロゲルビーズを酵素で除去すると、実際の流路を作ることも可能であり、この流路を経由して直径1ミクロンの蛍光粒子が凝集体内部まで到達することも確認した。肝臓は細胞が無秩序に詰め込まれた組織ではなく、すべての肝細胞が類洞に面した構造をとっている。我々はハイドロゲルビーズによって作り上げられる流路構造を類洞空間に見立てて、実際の肝臓に類似した肝組織の再構築と、その組織を用いたアプリケーションの開発を目指している。
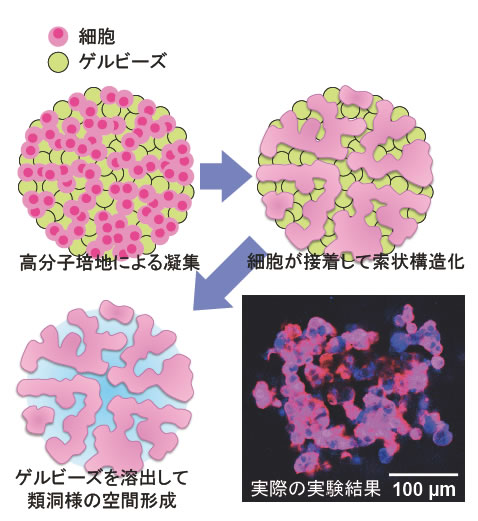
図3 ハイドロゲルビーズを利用して凝集体に流路構造を作る方法
新たに開発した高分子培養液による細胞・粒子凝集技術を用いることで、細胞だけでなくアルギン酸ハイドロゲルビーズを凝集させることが可能となった。同比率で細胞とゲルビーズを凝集させると、それぞれがランダムに並んだ凝集体となり、細胞の間にビーズが入り込んだ形となる。確率論的に、ほとんどのビーズあるいは細胞の隣にはまたビーズが存在するため、ビーズと細胞とは互いに分岐しながら絡み合ったような配列となる(左上)。この凝集体を培養すると細胞同士は接着するため、索状の細胞組織が形成される(右上)。ハイドロゲルビーズは分画分子量が大きいため、この状態でも低分子の栄養素・たんぱく質は凝集体内部に拡散して到達するが、アルギン酸ゲルをアルギン酸リアーゼで消化すると、実際に穴のあいた流路を構築することも可能である(左下)。つまりゲルビーズは、半導体微細加工技術で不可欠な、後工程で除去することを前提とした「犠牲層」に相当する役割を果たしている。実際に作製した流路構造をもつ凝集体(右下)。
5. まとめ
以上のように、いくつかの基本的要素技術を組み合わせることで、興味深い細胞配列が得られ、微小環境の再現に近づくことができている。今後、微小環境をより自在に再構築するために、要素技術を多様化させていきたい。一方で、自発的配列パターン形成の分子的機序や、作製した細胞組織の利用方法の提案など、生物学的、産業的な研究への展開にも注力したいと考えている。肝組織以外にも、膵島様組織[5]や骨髄組織の微小環境の再構築・制御にも取り組んでいる。
6. 謝辞
本稿で紹介した研究は、東大生産技術研究所の酒井康行先生、竹内昌治先生の元、自由な発想の許容と自主性を尊重する環境のなかでこそ進めることができたものです。数理モデルの研究については、理化学研究所 統合生命医科学研究センター 免疫数理モデリング研究(YCIラボ)の中岡慎治先生に多大な支援を頂きました。ここに感謝の意を表します。また原稿執筆の機会を与えて下さった静岡大学の塩尻信義先生に御礼申し上げます。
7. 参考文献
- Kojima, N., Miura, K., Matsuo, T., Nakayama, H., Komori, K., Takeuchi, S. and Sakai, Y. Rapid and direct cell-to-cell attachment using avidin-biotin binding system: Large aggregate formation in suspension culture and small tissue element formation having a precise microstructure using optical tweezers. J. Robot. Mechatron., 22, 619-622 (2010).
- Kojima, N., Takeuchi, S. and Sakai, Y. Establishment of self-organization system in rapidly formed multicellular heterospheroids. Biomaterials, 32, 6059-6067 (2011).
- Kojima, N., Takeuchi, S. and Sakai, Y. Rapid aggregation of heterogeneous cells and multiple-sized microspheres in methylcellulose medium. Biomaterials, 33, 4508-4514 (2012).
- Kojima, N., Takeuchi, S. and Sakai, Y. Fabrication of microchannel networks in multicellular spheroids. Sensor. Actuat. B-Chem., 198, 249-254 (2014).
- Kojima, N., Takeuchi, S. and Sakai, Y. Engineering of Pseudoislets: Effect on Insulin Secretion Activity by Cell Number, Cell Population, and Microchannel Networks. Transplant. Proc., 46, 1161-1165 (2014).










