研究交流
ヒトES/iPS細胞から分化誘導した肝幹前駆細胞の維持・増幅技術
高山和雄1,2,3、水口裕之1,2,3,4
1 大阪大学大学院薬学研究科分子生物学分野
2 大阪大学大学院薬学研究科iPS肝毒性・代謝ユニット
3 独立行政法人医薬基盤研究所肝細胞分化誘導プロジェクト
4 大阪大学臨床医工学融合研究教育センター
1.はじめに
自己複製能と多分化能を有するヒトembryonic stem (ES)/induced pluripotent stem (iPS)細胞から作製される肝細胞(分化誘導肝細胞)は創薬や再生医療などへの応用が期待されている。分化誘導肝細胞を医療応用するためには高品質かつ均質な細胞を大量に供給する必要がある。ヒトES/iPS細胞から肝細胞への分化は、内胚葉、foregut stem cell(前腸幹細胞)、肝幹前駆細胞を介することが知られており、分化誘導に約3週間以上の時間を要することが知られている。肝細胞の前駆細胞(肝幹前駆細胞)を維持・増幅する技術が開発できれば、短期間で均質な分化誘導肝細胞の大量供給が可能になる。本総説では、ヒトES/iPS細胞から肝細胞への分化誘導技術ならびに肝幹前駆細胞の増殖・増幅技術について概説する。
2.ヒトES/iPS細胞から肝細胞への分化誘導
ヒトES/iPS細胞は、肝細胞への分化段階に適した液性因子などを順次作用させることによって、内胚葉、foregut stem cell(前腸幹細胞)、肝幹前駆細胞を経由して肝細胞へ分化する(図1)。しかしながら、液性因子などを用いる従来の分化誘導法は、分化効率が低いことが問題であった。そこで、我々はヒトES/iPS細胞から肝細胞への各分化段階に必須の転写因子を過剰発現させることによって、肝細胞への分化誘導効率を飛躍的に向上させることに成功した[1-4]。さらに、細胞シート工学を用いた三次元培養法[5]やナノピラープレートを用いたスフェロイド培養法[6]を用いることによって、cytochrome P450(CYP)等の薬物代謝酵素の活性を高めることができた。このようにして作製した分化誘導肝細胞に対して肝毒性を誘発する薬物(トログリタゾンなど)を作用させることによって細胞毒性が生じること、また、リファンピシンを作用させることによって、約4倍のCYP3A4の酵素誘導が確認された。したがって、分化誘導肝細胞は薬物の毒性スクリーニングなどに応用できる可能性が示唆された[6]。しかし、高い肝機能を持つ分化誘導肝細胞を作製するために約1か月程度の分化誘導期間を要した。分化誘導肝細胞を創薬などに応用するには、より短期間で安価に分化誘導肝細胞を大量供給するための技術の開発が求められる。そこで、我々は肝幹前駆細胞の維持・増幅技術の開発を試みた。
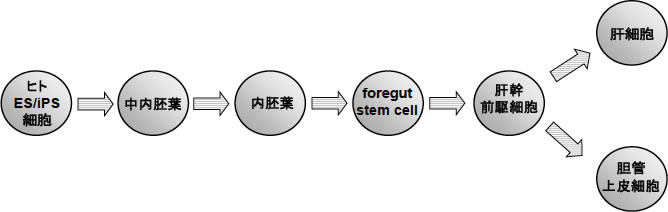
図1.ヒトES/iPS細胞から肝細胞への分化
ヒトES/iPS細胞は中内胚葉、内胚葉、foregut stem cell(前腸幹細胞)、肝幹前駆細胞を介して肝細胞へ分化する。また、肝幹前駆細胞は肝細胞と胆管上皮細胞へ分化する能力を有する。
3.ラミニン111を用いた肝幹前駆細胞の維持・増幅
ヒトES/iPS細胞から肝細胞への分化誘導における中間細胞(内胚葉細胞など)を維持・増幅する技術開発は2008年以降盛んに行われている。Seguinらは内胚葉形成に必須のSOX17遺伝子を恒常的に過剰発現させることによって、長期的に自己複製可能な内胚葉細胞を作製した[7]。また、Chengらはc-Kit/CXCR4共陽性のヒトES/iPS細胞由来内胚葉細胞をセルソーターを用いて分取したのち、マウス繊維芽細胞上でvascular endothelial growth factor、epidermal growth factor(EGF)、fibroblast growth factor(FGF)2、bone morphogenetic protein(BMP)4を含む培地を用いて内胚葉細胞を複製できることを報告した[8]。さらに、HannanらはヒトES/iPS細胞由来のforegut stem cellをゼラチン上でactivin A、bFGF、BMP、hepatocyte growth factor(HGF)、EGFを含む培地で培養することによってforegut stem cellを複製できることを示した[9]。しかしながら、分化誘導肝細胞を大量供給するためには、できる限り肝細胞に近い分化段階の細胞を複製することが最も効率的であると考えられる。
我々はヒトES/iPS細胞由来肝幹前駆細胞の維持・増幅に適した細胞外基質を探索するために、肝幹前駆細胞を種々のラミニン上に播種した[10]。その結果、肝幹前駆細胞はラミニン111に選択的に接着することが明らかになった。なお、肝幹前駆細胞はインテグリンα6β1を介してラミニン111に接着することも確認しており、インテグリンα6β1共陽性でない未分化細胞や内胚葉細胞はラミニン111に接着できなかった。そのため、ラミニン111を用いて肝幹前駆細胞を純化することが可能となった。ラミニン111上で培養された肝幹前駆細胞は、肝幹前駆細胞マーカーであるα-fetoprotein(AFP)、CD133、cytokeratin (CK)8、EpCAMなどの発現を維持した。ラミニン111上でHGF、EGFを含有する培地で培養することによって、1010倍まで肝幹前駆細胞を増幅可能であった。またその間、AFP陽性細胞はほぼ100%であり、核型も安定であった。したがって、ラミニン111は肝幹前駆細胞の複製に適した細胞外基質であることが示唆された。
4.増幅した肝幹前駆細胞の特性評価
肝幹前駆細胞は肝細胞と胆管上皮細胞への分化能を有することが知られているため、ラミニン111上で複製した肝幹前駆細胞の二分化能を評価した[10]。肝幹前駆細胞をマトリゲル上で、HGF、oncostatin M(OsM)、dexamethasoneを含む培地で分化誘導したところ、CYP3A4、α-1 antitrypsin(αAT)、ALBなどを発現した肝細胞が観察され、約80%以上の細胞がasialoglycoprotein receptor 1(成熟肝細胞のマーカー)陽性であった。また、ヒト初代培養肝細胞(播種後48時間)に近いALBや尿素産生能を有していた。一方、肝幹前駆細胞をコラーゲンゲルを用いて、EGF、insulin-like growth factor 2を含む培地で分化誘導したところ、CK19などを発現した胆管上皮細胞に分化した。さらに、四塩化炭素を用いて肝障害を引き起こした免疫不全マウスに肝幹前駆細胞を移植することによって、ホスト肝臓にヒトALB陽性肝細胞が観察された。以上のことから、ラミニン111上で複製された肝幹前駆細胞は二分化能を有しており、マウス肝臓に生着できることが示された[10]。
なお、ヒトES/iPS細胞由来肝幹前駆細胞の維持・増幅に関する報告は複数あり、Zhaoらは、ヒトES細胞由来肝幹前駆細胞をN-cadherinの発現を指標にソートしたのち、STO細胞上でEGFなどの液性因子を用いて肝幹前駆細胞を複製できることを報告した[11]。また、YanagidaらはCD13強陽性・CD133陽性のヒトiPS細胞由来肝幹前駆細胞をソートしたのち、マウス胎児繊維芽細胞上でALK阻害剤(A-83-01)、ROCK阻害剤(Y27632)、HGF、EGFを含む培地で肝幹前駆細胞が維持できることを報告した[12]。しかしながら、いずれの報告においても肝幹前駆細胞の維持・増幅にフィーダー細胞を必要としていた。我々のラミニン111を用いた肝幹前駆細胞の培養法ではフィーダー細胞を用いないため、再生医療への応用も期待される。本稿にて紹介したヒトES/iPS細胞由来肝幹前駆細胞をはじめとするヒトES/iPS細胞から肝細胞への分化における中間細胞とその特性を表1にまとめた。
| 前駆細胞の種類 | 増殖能 | 液性因子など | フィーダーor細胞外基質 | 引用 |
|---|---|---|---|---|
| 内胚葉 | 50継代 | SOX17過剰発現 | [7] | |
| 内胚葉 | 約1016 | VEGF、EGF、FGF2、BMP4 | マウス胎児繊維芽細胞 | [8] |
| 前腸幹細胞 | 約108 | Activin A、bFGF、BMP、HGF、EGF | ゼラチン | [9] |
| 肝幹前駆細胞 | 3ヵ月 | EGF | STO細胞 | [11] |
| 肝幹前駆細胞 | 約107 | HGF、EGF | マウス胎児繊維芽細胞 | [12] |
| 肝幹前駆細胞 | 約1010 | HGF、EGF | ラミニン111 | [10] |
ヒトES/iPS細胞由来の内胚葉、前腸幹細胞、肝幹前駆細胞の維持・増幅技術において使用される液性因子やフィーダー細胞などを記載している。
5.まとめ
ヒトES/iPS細胞由来の肝幹前駆細胞の維持・増幅技術は開発されたが、実際に創薬や再生医療に応用する場合はまだ課題が存在する。創薬に応用する際には、現在の創薬で使用されているヒト初代培養肝細胞に匹敵した肝機能(薬物代謝能など)を有する肝細胞へ分化誘導する技術の開発が急務である。再生医療に応用する際には、GMP基準に準じた培養法で肝幹前駆細胞や肝細胞を分化誘導・維持する必要がある。また、安全性を評価するために未分化細胞の残存率なども正確に評価することが必須である。これらの課題が一つ一つ克服され、ヒトES/iPS細胞由来肝細胞が産業応用されることを期待する。
6.謝辞
本稿で紹介した当研究室の成果は、大阪大学大学院薬学研究科分子生物学分野ならびに医薬基盤研究所幹細胞制御プロジェクト、肝細胞分化誘導プロジェクトの職員・学生の方々の協力によって得られたものであり、ここに感謝の意を表します。また、掲載の機会をご提供くださった静岡大学の塩尻信義先生に御礼申し上げます。
7.参考文献
- Inamura M, Kawabata K, Takayama K, Tashiro K, Sakurai F, Katayama K, Toyoda M, Akutsu H, Miyagawa Y, Okita H et al: Efficient generation of hepatoblasts from human ES cells and iPS cells by transient overexpression of homeobox gene HEX. Mol Ther 2011, 19(2):400-407.
- Takayama K, Inamura M, Kawabata K, Tashiro K, Katayama K, Sakurai F, Hayakawa T, Furue MK, Mizuguchi H: Efficient and directive generation of two distinct endoderm lineages from human ESCs and iPSCs by differentiation stage-specific SOX17 transduction. PLoS One 2011, 6(7):e21780.
- Takayama K, Inamura M, Kawabata K, Katayama K, Higuchi M, Tashiro K, Nonaka A, Sakurai F, Hayakawa T, Kusuda Furue M et al: Efficient Generation of Functional Hepatocytes From Human Embryonic Stem Cells and Induced Pluripotent Stem Cells by HNF4alpha Transduction. Mol Ther 2012, 20(1):127-137.
- Takayama K, Inamura M, Kawabata K, Sugawara M, Kikuchi K, Higuchi M, Nagamoto Y, Watanabe H, Tashiro K, Sakurai F et al: Generation of metabolically functioning hepatocytes from human pluripotent stem cells by FOXA2 and HNF1alpha transduction. J Hepatol 2012, 57(3):628-636.
- Nagamoto Y, Tashiro K, Takayama K, Ohashi K, Kawabata K, Sakurai F, Tachibana M, Hayakawa T, Furue MK, Mizuguchi H: The promotion of hepatic maturation of human pluripotent stem cells in 3D co-culture using type I collagen and Swiss 3T3 cell sheets. Biomaterials 2012, 33(18):4526-4534.
- Takayama K, Kawabata K, Nagamoto Y, Kishimoto K, Tashiro K, Sakurai F, Tachibana M, Kanda K, Hayakawa T, Furue MK et al: 3D spheroid culture of hESC/hiPSC-derived hepatocyte-like cells for drug toxicity testing. Biomaterials 2013, 34(7):1781-1789.
- Seguin CA, Draper JS, Nagy A, Rossant J: Establishment of endoderm progenitors by SOX transcription factor expression in human embryonic stem cells. Cell Stem Cell 2008, 3(2):182-195.
- Cheng X, Ying L, Lu L, Galvao AM, Mills JA, Lin HC, Kotton DN, Shen SS, Nostro MC, Choi JK et al: Self-renewing endodermal progenitor lines generated from human pluripotent stem cells. Cell Stem Cell 2012, 10(4):371-384.
- Hannan NR, Fordham RP, Syed YA, Moignard V, Berry A, Bautista R, Hanley NA, Jensen KB, Vallier L: Generation of Multipotent Foregut Stem Cells from Human Pluripotent Stem Cells. Stem Cell Reports 2013, 1(4):293-306.
- Takayama K, Nagamoto Y, Mimura N, Tashiro K, Sakurai F, Tachibana M, Hayakawa T, Kawabata K, Mizuguchi H: Long-Term Self-Renewal of Human ES/iPS-Derived Hepatoblast-like Cells on Human Laminin 111-Coated Dishes. Stem Cell Reports 2013, 1(4):322-335.
- Zhao D, Chen S, Cai J, Guo Y, Song Z, Che J, Liu C, Wu C, Ding M, Deng H: Derivation and characterization of hepatic progenitor cells from human embryonic stem cells. PLoS One 2009, 4(7):e6468.
- Yanagida A, Ito K, Chikada H, Nakauchi H, Kamiya A: An in vitro expansion system for generation of human iPS cell-derived hepatic progenitor-like cells exhibiting a bipotent differentiation potential. PLoS One 2013, 8(7):e67541.










