研究交流
肝細胞培養における酸素供給の改善
酒井康行
東京大学生産技術研究所 物質・環境系部門 臓器・生体システム工学研究室
1.はじめに―肝細胞培養と酸素供給―
生体内では,全ての細胞が最寄りの毛細血管から約200μm以内の距離に存在すると言われている.これは,血管から離れる方向に酸素が消費されつつ拡散し,ついには酸素濃度がゼロになる距離が最大でおおよそ200μm程度ということであり,この拡散と消費反応を記述する微分方程式に,対象とする組織単位体積当たりの酸素消費量を入れれば解析的に求めることができる(1).ちなみに肝組織では100μm程度となる.さて,このように酸素の拡散と消費によって血管無しの組織の厚みが決まるならば,なぜ,ポリスチレンプレート(Tissue-culture-treated polystyrene; TCPS)を用いた静置培養で細胞が拡散の限界まで一面に重層化せず,せいぜい1-2層の形成や部分的な三次元凝集で止まってしまうのであろうか? これは,実は細胞に至るまでの培養液層中の酸素の拡散律速による.この点は通常プレートでの静置培養系の盲点であると言えよう.
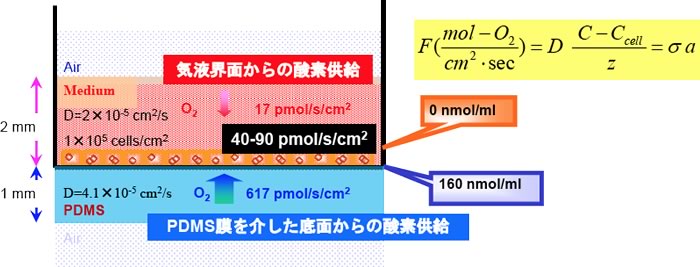
図1.プレート底面で静置培養された肝細胞への酸素供給の例.単位培養面積当たりの酸素のマスバランス考えると,定常状態拡散を記述するフィック第一法則から,供給量Fは酸素濃度勾配((C-Ccell)/z)に酸素の拡散係数Dをかけたものとなる.一方,これが底面で培養された細胞による面積当たりの酸素消費量(細胞面密度×細胞あたりの酸素消費速度)に等しくなる.このマスバランスから実際の細胞層での酸素濃度Ccellが決まる.ラット肝細胞を,通常の組織培養用ポリスチレンプレート(Tissue culture-treated polystyrene; TCPS)にて,飽和密度(1×105 cells/cm2)で培養した場合,細胞層での酸素濃度をゼロとしても,気液界面からの培養液相中の拡散による酸素供給速度(17 pmol/s/cm2)は,酸素消費速度(付着直後で90 pmol/s/cm2,その後40 pmol/s/cm2)を満たすことができない.一方,酸素透過性のポリジメチルシロキサン(poly-dimethylsiloxane; PDMS)膜を底面とするプレート(PDMSプレート)における面積当たりの酸素供給速度(617 pmol/s/cm2)は,消費速度を十分に上回っている.結果として,細胞へ暴露される酸素濃度は,外気に対してほぼヘンリー平衡濃度となる.すなわち,インキュベータ雰囲気の酸素濃度を調整することで,適切な酸素暴露濃度にて,細胞の酸素消費を完全に充足することが可能となる(Sakai et al., in . Liver Stem Cells” etd. by T. Ochiya (2011)).
酸素消費能が極めて高い初代培養ラット肝細胞を組織培養用ポリスチレン表面に飽和密度で培養した場合,生体内と異なり嫌気的環境におかれていることは1960年代から指摘されてきた(2).酸素は培養液上面からの拡散で供給され,気液界面での気相とのヘンリー法則に依存した平衡濃度と底面=細胞層の濃度との差を推進力とする.しかしながら,ここで得られる最大の酸素供給フラックスでも,細胞層の要求を全く満たさず,肝細胞は酸素消費能を抑えて生存している(図1).ラット肝細胞が部分的に重層播種された場合,その部分のみの細胞が死亡して付着できずぽっかりと穴が開いてしまう現象は,みなさんご経験があると思う.ラット初代培養肝細胞の培養の難しさは,採取に加えて,ほぼ飽和密度の単層形成のために高密度播種の必要性と均一性の確保が難しい点にもあると言える.
さて,高酸素透過性の透明なシリコーンゴムであるポリジメチルシロキサン(poly-dimethylsiloxane; PDMS)を底面に用いた場合,同じ厚さ・濃度勾配の培養液層と比較すると約20倍の酸素供給フラックスを得ることができる.このため,細胞への実暴露濃度を外気とほぼヘンリー平衡に保持することも可能となり,in vivoと同様に“生理学的な低酸素暴露濃度で細胞の酸素要求性を確実に満たす”ことができる(3)(図1).実際にラット肝細胞を飽和密度で播種,21%酸素濃度の5%CO2インキュベータ内で培養した直後の細胞層近傍における酸素濃度変化を測定すると,TCPSプレートでは急激な低下が起こり30分以内に約4%で平衡に達するが,PDMSプレートでは全く低下がみられなかった(4).初期付着を乗り越えて定常状態に達すれば,酸素消費は約半分となり,TCPSプレートでも細胞層の濃度は8-10%程度に落ち着くが,一層に培養された肝細胞でさえも,やや嫌気的な条件に置かれることとなる.
2.重層化・呼吸回路スイッチ・酸素濃度依存的組織形成
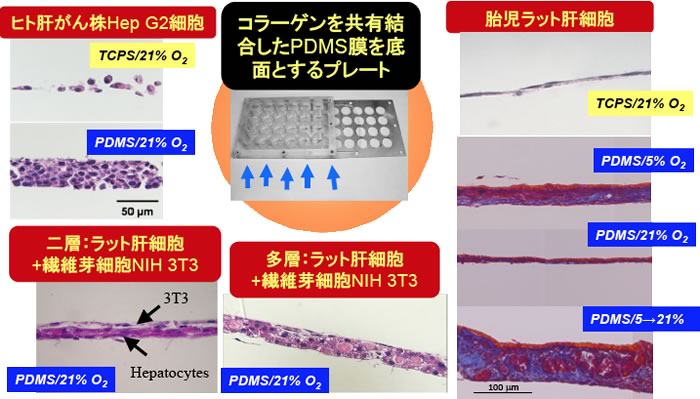
図2.コラーゲンを共有結合したPDMSプレート底面における各種肝由来細胞の培養結果(縦方向のHE染色,アザン染色).増殖性の細胞は自発的に増殖する.増殖しない成熟肝細胞でも多層化培養が容易に可能となる.胎児肝細胞ではインキュベータ内の酸素濃度に応じて最終的に形成される組織像が劇的に異なった.
酸素供給律速を抜本的に取り除いたPDMS膜上培養において,様々な肝由来の細胞を培養した(図2).増殖性のヒト肝がん細胞株Hep G2細胞は自発的に5-6層まで重層化した(5).2種の細胞をTCPSプレートに播種すると,最終的には2種の細胞が共にプレート底面にて同一平面内で棲み分ける形態となり,重層化が見られたとしても一部分に留まる.一方,PDMSプレートを用いると,まず肝細胞を播種して単層を形成させ,その後に例えば線維芽細胞を撒くと,線維芽細胞は肝細胞層の上で増殖して独自の連続単層を形成,結果的にラット肝細胞と繊維芽細胞の完全重層化が可能となった(6).ラット肝細胞は,繊維芽細胞の存在下で飽和の6倍の密度で撒くと,約3層に重層化し安定培養が可能であった(7).さらに,ラット胎児肝細胞ではマトリックスに富んだ間質層と肝細胞層とが発達し,その挙動は酸素濃度に依存的であった(8).このように,従来の組織培養用ディッシュでは観察されなかった高度な自己組織化現象が見られたことから,酸素供給不足がやはり最大の制限要因になっていたと考えられる.また,冒頭に提起した“なぜ酸素の拡散と酸素で決まる限界までポリスチレンプレートで組織が育成しえないか”,という根本的な疑問に対する答えとなる.
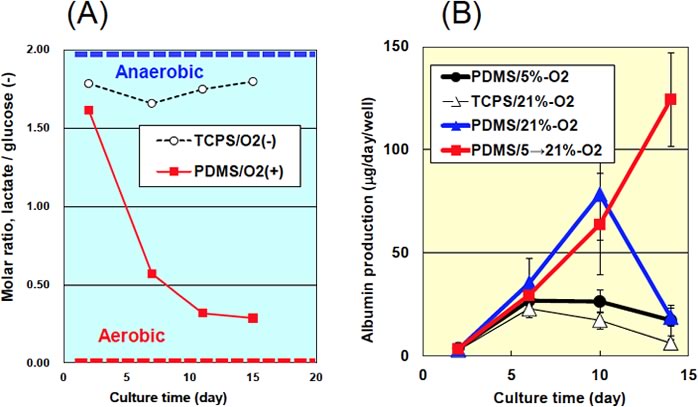
図3.(A),産生乳酸/消費グルコースモル比で見たHep G2細胞の培養における呼吸回路のスイッチ(化学量論比は,完全嫌気呼吸で2,完全好気呼吸で0となる);(B),胎児肝細胞のアルブミン分泌の変化.Hep G2細胞は播種時は専ら嫌気的呼吸であったが,PDMS培養では重層化にもかかわらず(図2),好気呼吸へのスイッチが起こる.胎児肝細胞では,始め5%後で21%にした培養で最も間質の発達がよく,アルブミン合成も順調に伸びた.
興味深かった第一の現象は,Hep G2細胞における呼吸回路のスイッチであり,通常は専ら嫌気的呼吸を行っていたが,PDMS培養ではその高い細胞密度にも関わらず,グルコース一分子基準で19倍のATP分子を生産しえる好気的呼吸回路に徐々にシフトしていった(図3).利用できるエネルギー量が高ければそれだけ大きな自己組織化能の発現が可能となろう.併せて計測した酸化的ストレスマーカーとしてのHypoxia Inducible Factor-1a (HIF-1 a)の発現は,通常のディッシュ培養では見られたが,酸素供給重層化組織では全く見られなかった(5).第二の興味深い現象は胎児ラット肝細胞の重層化で,21%酸素では下層(間質層)が薄く,5%酸素では下層がより厚くなった.5%から21%に培養中期でスイッチした場合に最も下層が厚く機能も高い多層構造が形成され,内部では肝前駆細胞からなる管腔構造の形成も見られた(図3).また,培養液側には,多数の浮遊凝集体が上皮層から次々と培養液中に遊離することも観測された(8).ここでも,好気的な呼吸回路の利用が分化と共に徐々に亢進した.再生医療においては,細胞ソースとして前駆細胞集団を用いる可能性が高く,分化段階に応じた実暴露濃度の精密な制御の必要性を示すものと考えられる.
3.球状凝集体の効率的形成
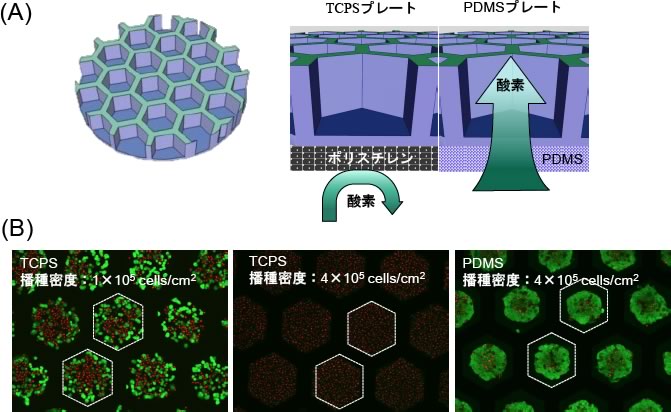
図4.酸素透過性マイクロウェル(内接円の直径326 mm)を用いた凝集体形成.(A)酸素透過性マイクロウェルの構造とポリスチレン・PDMSプレート上での酸素供給の様子.(B)同じ21%酸素雰囲気で播種密度を変えた場合における細胞の生存性(カルセインAM/PI染色).ラット肝細胞の標準播種密度である1×105 cells/cm2 においても,TCPSプレートでは死亡細胞が多く存在し,4倍の播種密度ではほぼ全ての細胞が死亡するが,PDMSプレートでは高い生存率を保っていた.
球状凝集塊(スフェロイド)の形成法には,非付着性ディッシュを用いるもの,旋回培養,ハンギングドロップ法により液滴中で凝集化させるものなど様々な手法があるが,マイクロウェルを用いた形成法は,大きさの分布のない均一な凝集体が簡便に得られる点で優れている.しかしながら,従来のポリスチレンやガラス製のプレート上では,上述したような酸素不足のため,単位面積当たりの形成凝集体数が小さい.これに対して,PDMSでハニカムマイクロウェル基板を作製し,様々な肝由来の細胞を培養したところ,最大で飽和細胞密度の4-8倍の面密度での効率的形成が可能となった(9)(図4).酸素が十分に供給されるため,XY方向だけでなくZ方向の積層細胞数の自由度が格段に増し,スムーズな凝集が可能となり,凝集塊の大量形成法としての利用が期待される.
4.薬効・毒性評価系への適用の試み
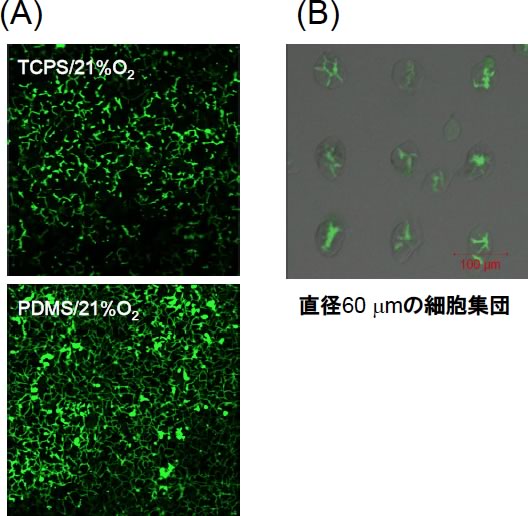
図5.(A),ラット肝細胞のサンドイッチ培養における微小胆管形成;(B),酸素透過膜上にコラーゲンゲルでマイクロパターン構造を付与し,胆汁を中央に集めた例.肝細胞での代謝の結果,蛍光化し,微小胆管に輸送されるCDFDA(5-(and-6)-carboxy-2’,7’-dichloro-fluorescein diacetate)を暴露し,15分後の組織像の蛍光写真である.
薬物動力学的評価や毒性評価のための培養系としては,様々な代謝能に加えて代謝物の極性輸送をも評価できるものが理想である.毒性評価では凝集体培養が好まれるが,胆汁排泄を評価可能な培養系はサンドイッチコラーゲン培養が唯一のものとなる.実はオリジナルサンドイッチも2か月以上に及ぶ培養が可能なのではあるが,下側はTCPSに吸着したコラーゲン,上層としてはマトリゲルを培養液中に耐えず添加するという簡便法が標準法となり,凝集体に比べて不安定である,との認識が広まってしまった.それはさておきこの手法では,上層にマトリゲルを吸着させることで肝細胞間に微小胆管の形成を促進,化学物質暴露後にキレート剤を含む緩衝液を添加し肝細胞間の結合を緩め,微小胆管に溜められた胆汁を回収する(10).しかしながら現実的には,微小胆管の形成の程度に問題がある.そこで,PDMS膜培養上でサンドイッチ培養を行うと,微小胆管形成が促進され胆汁排泄速度も亢進した(図5A)(4).さらに,PDMS膜上に配置したコラーゲンゲルにマイクロウェル構造を付与,直径60 mmのマイクロウェルで数個の細胞集団の中央部に比較的大きな胆汁溜りが形成され,マイクロシリンジを用いて培養系では初めて胆汁の直接回収に成功した(図5B)(11).今後,細胞間の微小胆管に排泄された胆汁成分を連続的に回収することも近い将来可能となると期待している.
5.おわりに
肝細胞培養における簡便かつ抜本的な酸素供給改善方法として,高酸素透過性の膜を培養面とすると,静置培養における一種の盲点である培養液層中の酸素拡散律速の問題を簡便かつ抜本的に解決でき,インキュベータ雰囲気の酸素濃度を調整するのみで,生体内と同じく“生理学的酸素暴露濃度にて細胞の酸素要求量の完全充足が可能”となる.このため,酸化ストレスの少ない状況で細胞に好気的なエネルギー生産を行わせることができ,結果的に肝細胞の自己組織化能を培養条件下でフルに引き出すことができる.増殖性の肝由来細胞で見られた自発的重層化挙動は,なぜ通常のプレートでは,酸素の拡散と消費で決まる厚さまで細胞が縦方向に増殖しえないか,に対する答えとなる.
肝細胞培養に限らず,in vitro-in vivoの乖離は半ば避けがたいことであるとの認識が一般的ではあるが,一方で,違いをひとつひとつ学術的に乗り越えればいつかはin vivoと同様の応答を示す培養モデルが作成可能になるはずである.酸素の問題に限らず,市販の一見完成度が高く見えるポリスチレンプレートと組織ごとに最適化された培養液という便利なツールが,細胞からみて果たして生理学的妥当性のあるものか,について今一度疑ってみることには高い意義があると感じている.
謝辞:本稿で述べた結果は,過去に当研究室および共同研究先の当研究所・藤井輝夫教授の下で研究を行った学生や博士研究員によるものである.また,胎児肝細胞の研究は東京大学分子細胞生物学研究所の宮島篤教授との共同研究に基づくものである.さらに,サンドイッチ培養に関する研究は,当研究所・竹内昌治准教授及び三菱化学メディエンス株式会社との共同研究の成果である.以上,深く感謝する.
References
- Sardonini, C. A., DiBiasio, D.: An investigation of the diffusion-limited growth of animal cells around single hollow fibers. Biotechnol. Bioeng., 40: 1233-1242 (1992).
- Stevens, K. M.: Oxygen requirements for liver cells in vitro. Nature, 206: 199 (1965).
- Sakai, Y., Nishikawa M., Evenou, F., Hamon, M., Huang, H. Y., Montagne, K. P, Kojima, N., Fujii, T., Niino, T.: Engineering of implantable liver tissues, in “Liver Stem Cells” etd. by T. Ochiya, Hamana Press (2011) pp.189-216.
- Matsui, H., Osada, T., Moroshita, Y., Sekijima, M., Fujii, T., Takeuchi, S., Sakai, Y.: Rapid and enhanced repolarization in sandwich-cultured hepatocytes on an oxygen-permeable membrane. Biochem. Eng. J., 52: 255-262 (2010).
- Evenou, F., Fujii, T., Sakai, Y.: Spontaneous formation of highly functional three-dimensional multilayer from human hepatoma Hep G2 cells cultured on an oxygen-permeable polydimethylsiloxane membrane. Tissue Eng. C, 16: 311-318 (2010).
- Nishikawa, M., Kojima, N., Komori, K., Yamamoto, T., Fujii, T., Sakai, Y.: Enhanced maintenance and functions of rat hepatocytes induced by combination of on-site oxygenation and coculture with fibroblasts. J. Biotechnol., 133, 253-260 (2008).
- Evenou, F., Hamon, M., Fujii, T., Takeuchi, S., Sakai, Y.: Gas-permeable membranes and co-culture with fibroblasts enable high-density hepatocyte culture as multilayered liver tissues. Biotechnol. Prog., 27: 1146-1153 (2011).
- Hamon, M., Hanada, S., Fujii, T., Sakai, Y.: Direct oxygen supply with polydimethylsiloxane (PDMS) membranes induces a spontaneous organization of thick heterogeneous liver tissues from rat fetal liver cells in vitro. Cell Transplant., 21, 401-410 (2012).
- Bi, Y., Kazolias, D., Duignan, D. B.: Use of cryopreserved human hepatocytes in sandwich culture to measure hepatobiliary transport. Drug Metab. Disposit., 34: 1658–1665 (2006).
- Shinohara, M., Kimura, H., Montagne, K. P., Komori, K., Fujii, T., Sakai, Y.: Combination of microwell structures and direct oxygenation enables efficient and size-regulated aggregate formation of an insulin-secreting pancreatic β-cell line. Biotechnol. Prog., under revision.
- Matsui, H., Takeuchi, S., Osada, T., Fujii, T., Sakai, Y.: Enhanced bile canaliculi formation enabling direct recovery of biliary metabolites of hepatocytes in 3D collagen gel microcavities. Lab Chip, 12: 1857-1864 (2012).










