研究交流
肝細胞研究におけるES細胞、iPS細胞の利用
山添太士1,2)、白木伸明2)、佐々木裕1)、粂昭苑2)
1) 熊本大学大学院生命科学研究部消化器内科学
2) 熊本大学発生医学研究所多能性幹細胞分野
はじめに
1981年にEvansらはマウス受精卵の内部細胞塊とよばれる将来の個体となる部位から、胚性幹(embryonic stem, ES)細胞と呼ばれる多能性の細胞株を樹立した(1)。それから約20年後の1998年にThomsonらがヒトから同様の細胞株を樹立した(2)。
ES細胞は(i)自己複製能、(ii)無限増殖能、(iii)多分化能を有する細胞で、再生医療における魅力的な細胞ソースであり、機能不全に陥った臓器の代わりにES細胞から分化させた細胞を移植するという夢の治療への展開が期待されてきた。しかしながら、生命の萌芽であるヒト胚の破壊を伴うこれらES細胞の樹立や利用には、倫理的な問題が伴っている。このような状況において、2006、2007年に山中・高橋らがマウス、ヒトの人工多能性幹(induced pluripotent stem, iPS)細胞を樹立し、このような問題を回避できるようになった(3, 4)。これを機にES細胞に加えて、iPS細胞から分化した細胞が研究目的に使われるようになった。従来ヒト由来検体を使用する生理・病理学的研究にはドナー不足という障壁がつきまとうが、無限増殖能を持つES/iPS細胞はこの問題を克服しうる。
肝細胞に限れば、肝臓は薬物代謝の中心的な臓器であるが故に、肝細胞機能を有する細胞がヒトES/iPS細胞から作製されれば、薬物動態試験・毒性試験などに供することで効率的な創薬研究が可能となる。また、ウイルス性肝疾患や遺伝性、代謝性肝疾患の機序解明に、患者由来iPS細胞を用いた研究も広く行われることが期待される。
このような医学・薬学的な利用のほかにも、ES/iPS細胞は受精卵が三胚葉に分化する前の、胚盤胞期の内部細胞塊由来の細胞から樹立されたもの、あるいはその性質を有するものであるため、分化誘導過程においても正常の胚発生を模倣しながら成熟細胞へと分化し得ると考えられており、我々はこれらの研究から、発生学の新たな知見を得ようと試みている(5, 6)。
分化誘導法の歴史
ES/iPS細胞から、目的の機能をもった成熟細胞への分化誘導が可能になっている標的臓器は限られている。例えば、外胚葉由来の神経系や、中胚葉由来の心筋・血球系の細胞への分化は多く報告されているものの、内胚葉由来の肝細胞や膵β細胞などへの分化については、前2者に比べ遅れをとっているのが現状である。
ヒトES細胞から肝細胞の分化誘導は2003年にジェロン社の研究グループにより報告された(7)。彼らは酪酸ナトリウムとhepatocyte growth factor (HGF)を使用し、大部分の細胞が死滅するなかで、生存しえた細胞の多くがアルブミン陽性を示すことを見出した。このような細胞の選択的な誘導法では得られる細胞数に限界があるため、より効率的な方法が求められている。
その一つの方法として胚様体(embryoid body)を介した誘導方法が挙げられる。胚様体形成法(あるいはhanging-drop法)では、ES/iPS細胞をスフェロイド培養することでマウス初期発生に見られる円筒胚に類似した形態が生じ、自発的に分化し、三胚葉(内胚葉、中胚葉、外胚葉)が形成されることを利用している。しかしながら、得られた細胞は雑多な細胞群であり、三次元的な構造を取っており、解析が煩雑であった。
M15細胞による共培養系
そこで我々は、胚体内胚葉の分化には中胚葉からのシグナルが重要であることに着目し、マウス胎仔中腎由来細胞株であるM15細胞をES細胞と共培養することにより、効率よく肝細胞への分化誘導が可能であることを報告した(8, 9)。
具体的には、M15細胞のES細胞への働きかけを調べるために二つの実験を行った。まず、同じ培養液で異なる細胞群を個別に培養可能なトランスウェルを用いた共培養系を用い、M15細胞の液性因子の影響を調べたところ、初期の内胚葉誘導においては液性因子が重要であるが、その後の臓器特異的分化には強い影響が認められなかった。一方、パラホルムアルデヒドで固定したM15細胞を用いた共培養でも、その分化誘導効果は有意に高かった。以上の結果から、M15細胞とES細胞とのcell-cellあるいはcell-matrix相互作用が重要であると考えた。
次に、マイクロアレイ解析にて細胞外マトリックス遺伝子の発現量を調べたところ、M15細胞は他の支持細胞であるPA6やOP9細胞と比べて、コラーゲンタイプIVとラミニンα5(Lama5)の発現が高いことが明らかになった(10)。これらは基底膜の主成分であるが、なかでもラミニンは3つのサブユニットから構成されており、α鎖、β鎖、γ鎖をそれぞれ一つずつ持つヘテロ三量体である。国立環境研の持立克身博士らとの共同研究により、ラミニン511(ラミニンα5、β1、γ1)を強制発現した細胞株を用いて作られる擬似基底膜sBM (synthesized basement membrane)を利用すると、M15細胞の代用としてES細胞を肝細胞や膵β細胞へと分化誘導することが可能であった(10, 11)。そこで、ラミニンの細胞接着因子であるインテグリンβ1をノックダウンしたES細胞では、肝細胞への分化誘導効率が有意に減弱し、細胞外マトリックス成分の重要性が示唆された。
合成基材による分化誘導促進
再生医療にES/iPS細胞を応用するにあたり、培養系には未知の成分、とりわけ異種動物由来成分は可及的に排除されることが望まれる。そこで次に注目したのは、完全な人工合成基材を用いる方法である。
なかでもポリアミドをエレクトロスピニング法によってランダム配向したナノファイバーは、マウスES細胞の増殖促進や初代ラット肝細胞機能維持に適していると報告されていることから(12, 13)、この基材をES/iPS細胞の分化に使用しうるか否かを検討した。その結果、ゼラチン、コラーゲンタイプ I、 ファイブロネクチン、マトリゲル(ラミニン111)をコートした通常のプレートと比較して、ナノファイバーは効率よく内胚葉マーカーであるSox17の発現を増強し、ES/iPS細胞をアルブミン分泌能やICG取り込み能が良好な細胞に誘導した。凹凸のあるナノファイバーの培養皿表面では、細胞はドーム状に丸く存在しin vivoと良く似た形態を示しており、我々は細胞骨格の制御に関わるRhoファミリーに属するRac1が、未分化状態のES細胞のみならず分化過程においてもナノファイバー上で活性化されている事を見出した(図1参照)。さらに分化のどの段階がRac1活性に依存しているかを調べるために、Rac1活性化阻害剤であるNSC23766を分化過程のES細胞に作用させた。その結果、通常のプレートではアルブミン発現量に阻害剤の投与による影響はないものの、ナノファイバー上で分化誘導したES細胞ではもともと高いアルブミンの発現量が、阻害剤により通常のプレート培養と同程度まで減弱した(14)。このことからRac1の活性化は内胚葉誘導のみならず、肝特異的な誘導においても重要な因子であることが示唆された(図2参照)。
先に述べた胚様体やM15細胞との共培養などでも、細胞がコンパクトになることでRac1が活性化し、そのことが分化誘導促進に働いているかもしれない。
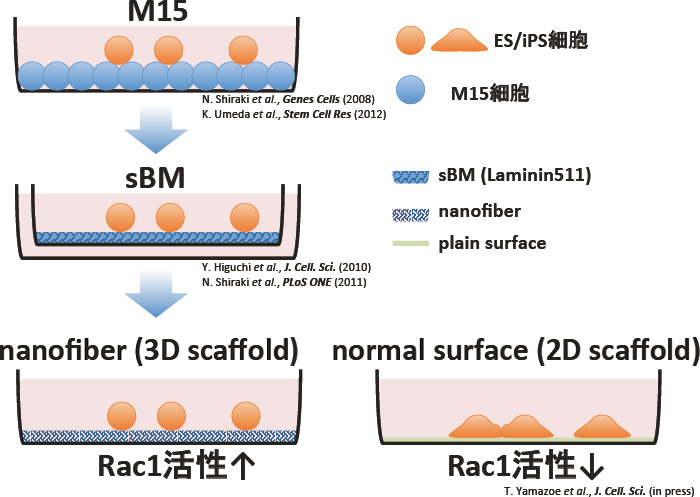
図1) ES/iPS細胞の肝細胞分化誘導方法の時代的変遷
M15細胞との共培養系にはじまり、M15細胞が産生分泌するラミニンを多く含んだ擬似基底膜sBMを用いる方法、さらに完全人工合成基材であるナノファイバーを用いる方法へと時代的に推移している。ナノファイバー上では通常用いられるプレートに比べて、ES/iPS細胞はドーム状に丸くなり、Rac1が活性化されている。
sBM; synthesized basement membrane.
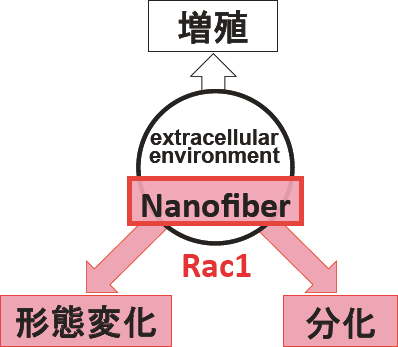
図2) ナノファイバーをはじめとした足場環境の役割
Rac1は細胞骨格の制御因子であり、細胞移動や形態変化に重要な働きをする一方で、分化にも密接に関わっている。従って、足場環境、細胞外環境がRac1を介して分化促進に働いている可能性が示唆される。
今後の展望、おわりに
2012年のノーベル医学・生理学賞が山中教授に授与され、このiPS細胞から分化誘導した色素上皮細胞を滲出性網膜色素変性症への臨床研究が2013年に認可されるに至り、多くの人が期待するstem cell therapyはES/iPS細胞研究の最終的な目標となった。一方、ES/iPS細胞を解析ツールとした基礎医学的な研究も盛んに行われるようになっている。これら臨床研究と基礎研究が両輪となり、新しい知見が得られることに期待したい。
最後に、掲載の機会を頂いた静岡大学塩尻信義教授に厚く御礼申し上げます。
文献
- M. Evans, M. Kaufman, Establishment in culture of pluripotential cells from mouse embryos, Nature 292, 154–6 (1981).
- J. A . Thomson, Embryonic Stem Cell Lines Derived from Human Blastocysts, Science 282, 1145–1147 (1998).
- K. Takahashi et al., Induction of pluripotent stem cells from adult human fibroblasts by defined factors., Cell 131, 861–72 (2007).
- K. Takahashi, S. Yamanaka, Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors., Cell 126, 663–76 (2006).
- S. Ogaki, S. Harada, N. Shiraki, K. Kume, S. Kume, An expression profile analysis of ES cell-derived definitive endodermal cells and Pdx1-expressing cells., BMC Dev. Biol. 11, 13 (2011).
- N. Shiraki, S. Harada, S. Ogaki, K. Kume, S. Kume, Identification of DAF1/CD55, a novel definitive endoderm marker., Cell Struct. Funct. 35, 73–80 (2010).
- L. Rambhatla, C. Chiu, P. Kundu, Generation of hepatocyte-like cells from human embryonic stem cells, Cell Transplant 12, 1–11 (2003).
- K. Umeda et al., Albumin gene targeting in human embryonic stem cells and induced pluripotent stem cells with helper-dependent adenoviral vector to monitor hepatic differentiation., Stem Cell Res 10, 179–194 (2012).
- N. Shiraki et al., Differentiation of mouse and human embryonic stem cells into hepatic lineages., Genes Cells 13, 731–46 (2008).
- Y. Higuchi et al., Synthesized basement membranes direct the differentiation of mouse embryonic stem cells into pancreatic lineages., J. Cell. Sci. 123, 2733–42 (2010).
- N. Shiraki et al., Efficient differentiation of embryonic stem cells into hepatic cells in vitro using a feeder-free basement membrane substratum., PLoS ONE 6, e24228 (2011).
- A. Nur-E-Kamal, I. Ahmed, J. Kamal, M. Schindler, S. Meiners, Three-dimensional nanofibrillar surfaces promote self-renewal in mouse embryonic stem cells., Stem Cells 24, 426–33 (2006).
- K.-N. Chua et al., Stable immobilization of rat hepatocyte spheroids on galactosylated nanofiber scaffold., Biomaterials 26, 2537–47 (2005).
- T. Yamazoe et al., A synthetic nanofibrillar matrix promotes in vitro hepatic differentiation of embryonic stem cells and induced pluripotent stem cells., J. Cell. Sci. (in press)










