研究交流
肝臓におけるアポトーシスとオートファジー:癌におけるそれぞれの二面性
竹原徹郎
大阪大学大学院医学系研究科 消化器内科学
はじめに
アポトーシスとオートファジーは細胞死に関連した細胞応答であり、それぞれ線虫、酵母をモデルとした遺伝学的研究が展開したことにより、哺乳細胞における意義についても爆発的に研究が進んだ領域である。アポトーシスは不必要な細胞を除去するシステムとして、またオートファジーは飢餓時の生存システムとして、ともに臓器や個体の恒常性の維持に必須の生命現象である。アポトーシスとオートファジーは肝癌の発生と進展という過程の中で、極めて重要な意義を持っており、また治療的な視点からは諸刃の剣としての二面性を有していることが明らかになりつつある。
アポトーシスと肝癌
Hanahanら1)は癌を特徴づける形質として6つの生物学的事象を挙げているが、そのなかで細胞死に対する抵抗性は癌が進展する上で必須であると述べている。古典的には癌の主要な原因は癌遺伝子の過剰発現であり、これらの多くは細胞周期に関連するあるいはこれを促進する遺伝子であり、細胞に無秩序な増殖能を付与する。しかし、このような無秩序な増殖は一般に細胞死を引き起こし、このことが重要な癌抑制機構になっている。癌抑制遺伝子のいくつかは細胞死を誘導する遺伝子であることが知られており、例えば最も有名な癌抑制遺伝子であるp53の異常はひとつの帰結として細胞死誘導を阻害し、結果として腫瘍細胞の増殖を許容している。反対に遺伝子の過剰発現により細胞死抑制を起こす例として最もよく知られているものはB細胞リンパ腫におけるbcl-2遺伝子の再構成である。Bcl-2はミトコンドリア経路のアポトーシスを制御するBcl-2ファミリーのプロトタイプであるが、Bcl-2の発見はこのような癌研究からはじまったといえる。
私たちは肝癌ではアポトーシス抑制性Bcl-2関連分子であるBcl-xLが高発現しており、p53が誘導する細胞死を強力に抑制していることを報告してきた2)。Bcl-xLは転写レベルでの発現増強以外に、マイクロRNAによる転写後修飾3)や脱アミド化による翻訳後修飾4)などの種々のメカニズムで機能増強がみられる。Bcl-xLの発現が増強している肝癌は悪性度が高く、肝切除後の生命予後が不良であることも報告されている5)。また、Bcl-xLと構造及び機能が類似した分子としてMcl-1があるが、肝癌ではMcl-1も高発現していることが知られている6)。このようなアポトーシス抑制性Bcl-2関連分子の発現増強が固形腫瘍の増大を引き起こすことがヌードマウスにおける誘導発現的xenograftモデルで証明されている7)。以上のことから、Bcl-xLやMcl-1の発現増強は肝癌細胞の生存にとって重要であり、癌の進展に直結した分子イベントであるといえる。
最近、このようなBcl-2ファミリー分子を標的とした薬剤が多く開発されている。アポトーシス抑制性Bcl-2ファミリーはBH3 grooveという共通の構造を有しており、アポトーシスを促進するBcl-2ファミリーであるBakやBaxあるいはBH3-onlyタンパクのBH3ドメインと結合することによりアポトーシスを抑制している。BH3 mimeticと呼ばれる一群の薬剤はこのBH3 grooveに結合する小分子であり、アポトーシス促進性分子群を解放することによりアポトーシスを誘導する。このクラスの薬剤の中で最も詳細に検討されているのがABT-737であり、その経口投与可能な誘導体であるABT-263は血液腫瘍や肺癌を対象に臨床開発段階に入っている。ABT-737はその構造的な特性からBcl-2だけでなくBcl-xL、Bcl-wに対しても阻害活性があるが、Mcl-1、Bfl-1に対しては抑制活性がない。ABT-737を肝癌細胞株に作用させると、ストレス存在下では細胞死が誘導されるが、生理的な状態では細胞死が誘導されない。これは肝癌細胞株がBcl-xLだけではなくMcl-1も高発現しているからである。近年、肝癌に対して承認されているソラフェニブはMcl-1の発現を低下させる活性を持っている。私たちはソラフェニブとABT-737の併用は多くの肝癌細胞でアポトーシスを強力に誘導し、これにより肝癌の増殖が抑制されることを示した7)。このように、Bcl-2阻害薬は癌の細胞死抵抗性を解除し、抗癌剤として期待できる薬剤であるが、多くの癌は複数のアポトーシス抑制性Bcl-2ファミリーを高発現している可能性があり、腫瘍に応じて適切な薬剤の組み合わせを検討することが必要である。
肝細胞アポトーシスと肝発癌
癌の発症という視点で考えると、肝癌はウイルス肝炎や脂肪肝炎など臓器の炎症を基盤として発症することが特徴である。このような前癌病変を特徴づける第一義的な異常は上皮細胞の死であり、肝炎の存在の臨床的な指標は肝細胞からの逸脱酵素である血清ALT値の上昇である。慢性肝疾患における肝細胞死については、ピースミールネクローシスやブリッジングネクローシスなどの病理学的な名称から漠然とネクローシスであると考えられてきたが、私たちはウイルス肝炎における細胞死はアポトーシスが主体であることを報告してきた8)。実際に、C型肝炎や非アルコール性脂肪肝炎の患者の肝臓ではFasレセプターの発現やTUNEL陽性の肝細胞が観察され、肝細胞のアポトーシスの程度と病態に密接な関連があることが示されている9)。近年、臨床使用可能なカスパーゼ阻害薬が複数開発されており、ウイルス肝炎や脂肪肝炎患者に対する臨床試験が行われている。それによるとカスパーゼ阻害薬の服用により血清ALT値の有意な低下がみられており、これらの慢性肝疾患における血清ALT値の上昇がカスパーゼ依存的な現象であることが証明されている10,11)。
私たちは肝臓におけるBcl-xLおよびMcl-1の機能を解析するために、肝細胞特異的なBcl-xL12)、Mcl-113)の欠損マウスを作成した。これらの遺伝子の全身でのノックアウトは胎生致死であることが知られていたが、肝細胞特異的なノックアウトマウスはともにメンデルの法則に従って出生し、個体レベルでは明らかな異常は呈さなかった。しかし、肝臓では生後早期より、肝細胞アポトーシス像が散在性に観察され、血清ALT高値を終生持続した。このことは、これらのマウスが持続的な肝細胞アポトーシスが臓器に与える影響を解析する上で優れたモデルになることを示している。これらのマウスでは3か月齢以降において肝臓の線維化が観察された。肝臓ではアポトーシス小体が肝細胞やクッパー細胞に活発に貪食されており,この際にTGFβが産生されていた12)。また,1年齢以降になると高率に肝腫瘍を形成した(図参照)14)。腫瘍は組織学的にはヒトの高分化型肝細胞癌に酷似しており,生化学的にもAFPやGlypican3を産生していた。また,Bcl-xL欠損マウスの腫瘍ではMcl-1が,Mcl-1欠損マウスの腫瘍ではBcl-xLが高発現しており,このようなsurvival advantageの獲得が最終的な腫瘍の形成に重要であることが示唆された。Mcl-1欠損マウスにみられる肝腫瘍の形成は,BakあるいはBidを欠損させ,肝細胞アポトーシスを抑制し血清ALT値を低下させることによりその発生率を低下させることが可能であった。アポトーシスをおこしている肝臓では炎症性サイトカインの産生や酸化ストレスの上昇がみられ,N-acetyl cysteine (NAC)の投与により酸化ストレスを軽減させると肝腫瘍の発生率は抑制された。
ウイルス肝炎からの肝臓の病態形成には肝炎ウイルスそのものの影響があり,また非アルコール性脂肪肝炎では蓄積した脂肪酸の組成が疾患の進行に影響することが報告されている。一方、今回の結果は両者の共通の病態である肝細胞アポトーシスの持続そのものが疾患進行の少なくとも十分条件になっていることを示している。ウイルス肝炎や脂肪肝炎からの疾患進行の抑制には,ウイルス排除や脂肪蓄積の軽減とともに,アポトーシスそのものの抑制が重要な標的になると考えられる。
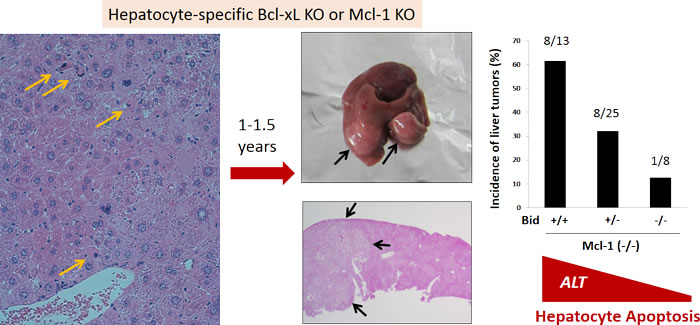
図:肝細胞アポトーシスの持続は肝発癌を誘導する
肝細胞特異的にBcl-xLあるいはMcl-1をノックアウトしたマウスは生後早期より肝細胞アポトーシス(黄色↑)を自然発症し,血清ALT値の上昇が生涯持続する。同マウスは軽度の線維化の進行とともに1年齢以降において高率に肝細胞癌(黒↑)を発症する。Mcl-1ノックアウトマウスにおいてBH3-onlyタンパクのひとつであるBidを欠損させると,肝細胞のアポトーシスと血清ALT値の上昇は遺伝子量依存的に軽減し、同時に発癌率は著明に低下する。
パラドックス:アポトーシスとオートファジーの肝癌における意義
アポトーシスが肝癌発症を促進させ、アポトーシスの抑制が肝癌を増大させるということは一見パラドックスであるかのようにみえる。しかし、肝細胞のアポトーシスが臓器の恒常性を破綻させ発癌につながり、また一旦トランスフォームした細胞にとってはアポトーシス耐性がその生存に重要であるということは生物学的には極めて妥当なことである。しかし、臓器レベルで肝癌の発症予防、進展抑制ということを考えると、アポトーシスの抑制はまさに諸刃の剣であり、このような事実を臨床的に認識することは極めて重要である。このような二面性は、最近注目されているオートファジーにおいても同様であることが明らかになってきている。肝癌細胞にとってオートファジーはストレス応答であり、その生存にとって有利に働く。私たちは進行肝細胞癌治療において最近認可された分子標的薬剤ソラフェニブが肝癌にオートファジーを誘導し、アポトーシス耐性を付与していることを明らかにした15)。一方、オートファジーを抑制された肝細胞からは、肝癌が高頻度に発生することが報告されている16)。オートファジーの抑制が発癌を誘導し、また逆にオートファジーが肝癌の抗癌剤感受性を減弱させるという事象も、臓器の恒常性維持、および腫瘍細胞の生存という視点で考えると理解しやすい。
文献
- Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 144(5):646-74. (2011)
- Takehara T, Liu X, et al. Expression and role of Bcl-xL in human hepatocellular carcinomas. Hepatology. 34(1):55-61. (2001)
- Shimizu S, Takehara T, et al. The let-7 family of microRNAs inhibits Bcl-xL expression and potentiates sorafenib-induced apoptosis in human hepatocellular carcinoma. J Hepatol. 52(5):698-704. (2010)
- Takehara T, Takahashi H. Suppression of Bcl-xL deamidation in human hepatocellular carcinomas. Cancer Res. 63(12):3054-7. (2003)
- Watanabe J, Kushihata F, et al. Prognostic significance of Bcl-xL in human hepatocellular carcinoma. Surgery. 135(6):604-12. (2004)
- Sieghart W, Losert D, et al. Mcl-1 overexpression in hepatocellular carcinoma: a potential target for antisense therapy. J Hepatol. 44(1):151-7. (2006)
- Hikita H, Takehara T, et al. The Bcl-xL inhibitor, ABT-737, efficiently induces apoptosis and suppresses growth of hepatoma cells in combination with sorafenib. Hepatology. 52(4):1310-21. (2010)
- Mita E, Hayashi N, et al. Role of Fas ligand in apoptosis induced by hepatitis C virus infection. Biochem Biophys Res Commun. 204(2):468-74. (1994)
- Feldstein AE, Canbay A, et al. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 125(2):437-43. (2003)
- Pockros PJ, Schiff ER, et al. Oral IDN-6556, an antiapoptotic caspase inhibitor, may lower aminotransferase activity in patients with chronic hepatitis C. Hepatology. 46(2):324-9. (2007)
- Ratziu V, Sheikh MY, et al. A phase 2, randomized, double-blind, placebo-controlled study of GS-9450 in subjects with nonalcoholic steatohepatitis. Hepatology. 55(2):419-28. (2012)
- Takehara T, Tatsumi T, et al. Hepatocyte-specific disruption of Bcl-xL leads to continuous hepatocyte apoptosis and liver fibrotic responses. Gastroenterology. 127(4):1189-97. (2004)
- Hikita H, Takehara T, et al. Mcl-1 and Bcl-xL cooperatively maintain integrity of hepatocytes in developing and adult murine liver. Hepatology. 50(4):1217-26. (2009)
- Hikita H, Kodama T, et al. Bak deficiency inhibits liver carcinogenesis: a causal link between apoptosis and carcinogenesis. J Hepatol. 57(1):92-100. (2012)
- Shimizu S, Takehara T, et al. Inhibition of autophagy potentiates the antitumor effect of the multikinase inhibitor sorafenib in hepatocellular carcinoma. Int J Cancer. 131(3):548-57. (2012)
- Takamura A, Komatsu M, et al. Autophagy-deficient mice develop multiple liver tumors. Genes Dev. 25(8):795-800. (2011)










