研究交流
肝臓構築の組織工学的アプローチ
須藤 亮
慶應義塾大学理工学部システムデザイン工学科
1. はじめに
私はこれまでに工学の立場から生体外における肝臓再生を目指して研究に取り組んできた。特に、多数の要素をどのようにして組み立てていくと有機的に統合されたシステムが構築しうるのかというメカニズムを追及することが大きなモチベーションの1つになってきた。すなわち、ばらばらの細胞が集まって3次元の構造体を形成し、全体として新しい機能を発現する生命システムの特徴に興味を抱き、ラットの肝臓から分離した細胞をどのようにして組み立てると肝組織を再構築できるかという視点から研究を進めてきた。研究を始めた当初は肝細胞の三次元培養に取り組んだ。次に、肝組織を再構築するためには肝細胞を扱うだけでなく、血管や胆管組織の再生も必要となることを認識するに至り、これらの肝細胞以外の細胞からなる組織の再生にも取り組んだ。そして、最近は肝組織、血管、胆管を融合した複合組織を再生させることを目標として研究を進めている。培養手法も細胞の自己組織性を生かした二次元培養から始め、組織再生をより積極的にコントロールしたいという考えから多孔性薄膜を用いた三次元積層培養へ展開した。さらに、微細加工技術を応用したマイクロ流体デバイスを用いて新たな三次元培養に取り組んでいる。本稿では、これまでに取り組んできたこれらの研究内容について簡単に紹介する。
2. 小型肝細胞による毛細胆管の再生
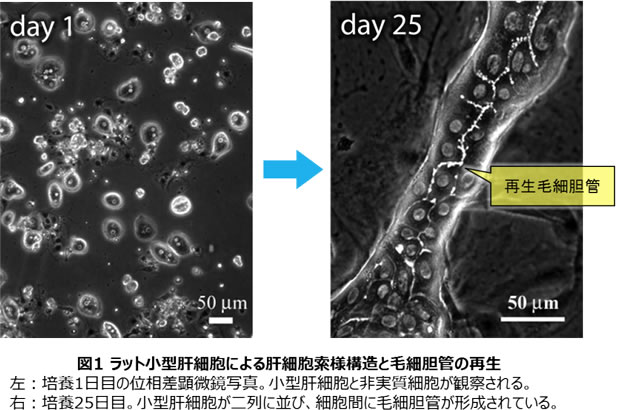
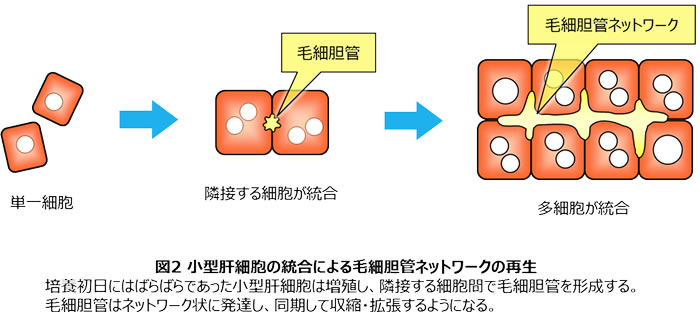
肝臓の最小機能単位構造は肝小葉であるが、肝小葉では肝細胞、類洞内皮細胞、星細胞、クッパー細胞など複数の細胞が有機的に集まることによって組織を形成している。生体外で肝組織を再構築するためには肝小葉を再現する必要があるが、とても複雑な構造であるため現在も生体外でその再生に成功した例はない。私の研究では、肝小葉の中でも肝臓の主要な機能を司る肝細胞に焦点を当て、まずは肝細胞索の再構築に取り組むことから始めた。肝臓は再生する臓器として知られているが、肝細胞をいったん生体外に分離してしまうと途端にその機能を失ってしまい、生体外において機能的な肝細胞を長期間維持することは難しい。そこで、肝前駆細胞である小型肝細胞を分離し、非実質細胞と共培養することで毛細胆管が再生される現象に着目し、その生理的な機能を実験によって立証した(1)。小型肝細胞を培養すると肝細胞索に類似した構造を形成し、細胞間に毛細胆管が形成される(図1)。その後の研究で、小型肝細胞の再生した毛細胆管が収縮・拡張運動していることが分かり、定量的な解析によって収縮運動は同期しており、毛細胆管を形成している多数の小型肝細胞が協調して運動していることが分かった(2)。これらの研究から、ラットの肝臓から分離したばらばらの細胞が増殖し、互いに接着することで細胞間に毛細胆管を再生し、多細胞組織として成長することが分かってきた(図2)。
3. 多孔性薄膜を用いた三次元積層培養
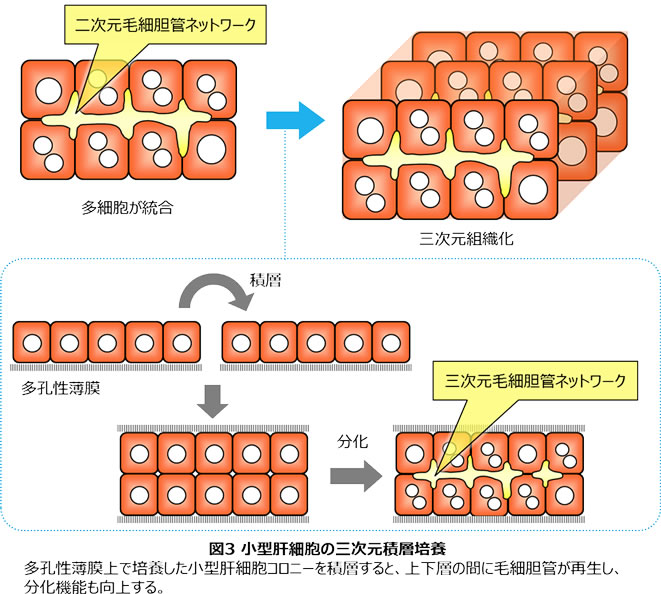
小型肝細胞の培養によって肝細胞索様の構造を再構築することが可能になったが、肝小葉は三次元の複雑な構造をしている。そこで、次のステップとして毛細胆管ネットワークを三次元培養に拡張することを考えた。生体内の構造を見ると、肝細胞索は2枚の肝細胞プレートが貼り合わさるような構造になっている。そこで、小型肝細胞の三次元培養として、小型肝細胞のプレート(コロニー)を2枚用意して、それを貼り合わせることを考えた(三次元積層培養法)。実際、この方法によって小型肝細胞を培養し、2枚の小型肝細胞のプレートを貼り合わせると、プレート間に毛細胆管が再生され、肝細胞の機能も向上することを見出した(図3)(3)。この方法は小型肝細胞だけでなく成熟肝細胞にも有効である(4)。さらに、この培養に使用する多孔性薄膜の素材を生分解性のPLGA(poly lactic-co-glycolic acid)に変えることで、最終的に膜が分解され、細胞のみから構成される肝組織を再生することが可能になった(5)。多孔性薄膜を用いた培養法は肝細胞、血管内皮細胞、星細胞の相互作用を調べるためにも有効な培養系であり、特に共培養における星細胞の役割を調べることにも役立った(6–8)。
4. 胆管、血管への展開
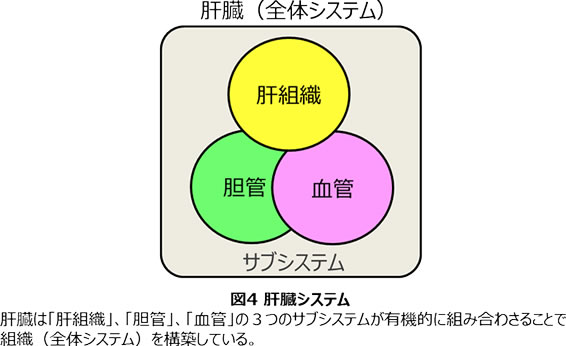
三次元積層培養を行うことで肝細胞の三次元構造を構築することが可能になり、出来上がった組織において肝細胞の機能も向上したが、肝小葉の構造と比較してみると大きな違いがある。それは、肝小葉では肝組織、胆管、血管の3つの組織が有機的に組み合わさることで複合的な三次元構造が実現されていることである。つまり、肝臓というシステムは肝組織、胆管、血管の3つのサブシステムから構成されている(図4)。そこで、次のステップとして肝細胞の培養に加えて、胆管と血管の再生にも取り組んだ。胆管に関してはラットの初代培養胆管上皮細胞を用いてコラーゲンゲルサンドイッチ法とDMSOの添加を順番に行い、段階的に組織化を誘導することでばらばらの細胞から内腔が連続し、分岐したネットワーク構造をもつ胆管を再生させることに成功した(9)。一方、血管の再生に関しては、古くから生体外血管新生モデルが報告されている。私たちもこのモデルを利用して毛細血管様ネットワークの再構築を行い、コラーゲンゲルの硬さをコントロールすることで血管ネットワークの太さや深さを調節しうることを見出した(10)。また、同様の血管新生モデルに血管内皮前駆細胞を加えて培養することで血管形成が促進されることを報告した(11)。これらの研究の蓄積によって組織工学の観点から、肝組織、胆管、血管を取り扱うことが可能になってきた。
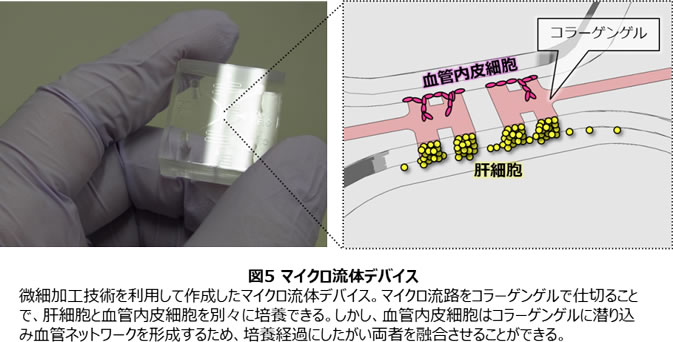
5. マイクロ流体デバイスを用いた三次元組織の融合
肝小葉を構成する3つのサブシステムである肝組織、胆管、血管を再生させることが可能となり、次のステップとしては、いよいよこれらを融合して複合組織を構築することが必要となる。これまでに行ってきた三次元培養を単純に拡張するだけではこれらの組織を融合させることは難しく、さらに細胞培養を“engineering”する必要性を感じていた。そのような時期に私は米国MITに留学し、新しい細胞培養ツールであるマイクロ流体デバイスに出会った(図5)。もともと半導体基板の加工などに使われていた微細加工技術を応用した新しい培養手法で、当時私の参加したMITのラボでも細胞培養に用いるマイクロ流体デバイスの開発が始まったばかりであり、私はこのデバイスでの細胞培養法を1から検討した。このデバイスを用いると細胞の配置や細胞周囲の微小環境をより精緻にコントロールすることができる。実験条件を色々と検討し、まず始めにマイクロ流体デバイスにおいて生体外血管新生モデルを再現し、デバイス内で血管を再生させることが可能になった(12–13)。次に、血管と肝組織を融合させる共培養モデルを構築することに取り組んだ。様々な培養条件の組み合わせを試し、最終的に肝細胞の三次元組織と血管内皮細胞を近傍に配置して培養すると血管形成が促進されることを見出した(14)。この実験ではまだ血管と肝組織を融合するには至っていないが、単なる共培養を行ったのではなく、三次元の肝組織と毛細血管網を組み合わせることに成功した初めての例だと考えている。このマイクロ流体デバイスはその後、様々な細胞培養に応用され、培養技術も確立されつつある(15–17)。今後はさらに培養手法に改良を加え、肝小葉を構成する3つのサブシステムの融合に取り組んでいきたいと考えている。
6. おわりに
私が肝細胞を用いた研究を始めた2000年頃にはいかにして肝細胞の三次元培養を行うかという点に焦点を当てた研究が行われていたが、あれから10年以上が経過し、肝臓の組織工学研究も大きな発展を遂げている。今もなお肝小葉を再生することには成功していないが、単一種類の細胞を用いた三次元培養だけでなく、共培養によって複合組織の再生を目指す研究が試みられるようになった。特に、三次元組織に血管を導入する“vascularization”の技術は肝臓だけでなく、再生医療が対象とする様々な三次元臓器の再生に重要であり、国内外で活発に研究が進められている。培養技術も徐々に複雑化しており、生物・医学の研究者だけでなく私のようなバイオエンジニアが貢献できることも増えてきたように感じている。今後も、工学の立場から肝臓再生の研究に取り組み、将来の再生医療へ貢献できるよう努力していきたい。
最後に、ここで紹介した研究成果は、慶應義塾大学 谷下一夫 名誉教授、札幌医科大学 三高俊広教授、米国MIT Prof. Roger Kamm、そして各研究室のメンバー、および慶應義塾大学の当研究室のメンバーの協力によって得られたものであり、ここに感謝の意を表する。
参考文献
- Sudo R, Mitaka T, Ikeda S, Sugimoto S, Harada K, Hirata K, Tanishita K, Mochizuki Y. Bile canalicular formation in hepatic organoid reconstructed by rat small hepatocytes and hepatic nonparenchymal cells. J Cell Physiol, 199, 252–261 (2004)
- Sudo R, Kohara H, Mitaka T, Ikeda M, Tanishita K. Coordination of bile canalicular contraction in hepatic organoid reconstructed by rat small hepatocytes and nonparenchymal cells. Ann Biomed Eng, 33, 696–708 (2005)
- Sudo R, Mitaka T, Ikeda M, Tanishita K. Reconstruction of 3D stacked-up structures by rat small hepatocytes on microporous membranes. FASEB J, 19, 1695–1697 (2005)
- Sudo R, Mitaka T, Ikeda M, Tanishita K. Maintenance of cell morphology and function by vertical cell-cell adhesion in three-dimensional stacked-up culture of rat hepatocytes. J Biomech Sci Eng, 3, 235–248 (2008)
- Kasuya J, Sudo R, Tamogami R, Masuda G, Mitaka T, Ikeda M, Tanishita K. Reconstruction of 3D stacked hepatocyte tissues using degradable, microporous poly(d,l-lactide-co-glycolide) membranes. Biomaterials, 33, 2693–2700 (2012)
- Kasuya J, Sudo R, Mitaka T, Ikeda M, Tanishita K. Hepatic stellate cell-mediated three-dimensional hepatocyte and endothelial cell tri-culture model. Tissue Eng Part A, 17, 361–370 (2011)
- Kasuya J, Sudo R, Mitaka T, Ikeda M, Tanishita K. Spatio-temporal control of hepatic stellate cell-endothelial cell interactions for reconstruction of liver sinusoids in vitro. Tissue Eng Part A, 18, 1045–1056 (2012)
- Kasuya J, Sudo R, Masuda G, Mitaka T, Ikeda M, Tanishita K. Reconstruction of hepatic stellate cell-incorporated liver capillary structures in small hepatocyte tri-culture using microporous membranes J Tissue Eng Regen Med (in press)
- Hashimoto W, Sudo R, Fukasawa K, Ikeda M, Mitaka T, Tanishita K. Ductular network formation by rat biliary epithelial cells in the dynamical culture with collagen gel and dimethylsulfoxide stimulation. Am J Pathol, 173, 494–506 (2008)
- Yamamura N, Sudo R, Ikeda M, Tanishita K. Effects of the mechanical properties of collagen gel on the in vitro formation of microvessel networks by endothelial cells. Tissue Eng, 13, 1443–1453 (2007)
- Koga M, Sudo R, Yamamoto K, Ando J, Ikeda M, Tanishita K. Contribution of rat endothelial progenitor cells on three-dimensional network formation in vitro. Tissue Eng Part A, 15, 2727–2739 (2009)
- Chung S, Sudo R, Mack PJ, Wan C, Vickerman V, Kamm RD. A new microfluidic platform to study cell migration. Lab Chip, 9, 269–275 (2009)
- Chung S, Sudo R, Zervantonakis IK, Rimchala T, Kamm RD. Surface treatment induced three dimensional capillary morphogenesis in a microfluidic platform. Adv Mater, 21, 4863–4867 (2009)
- Sudo R, Chung S, Zervantonalis IK, Vickerman V, Toshimitsu Y, Griffith LG, Kamm RD. Transport-mediated angiogenesis in 3D epithelial co-culture. FASEB J, 23, 2155–2564 (2009)
- Chung S, Sudo R, Vickerman V, Zervantonakis IK, Kamm RD. Microfluidic platforms for studies of angiogenesis, cellmigration, and cell-cel interactions. Ann Biomed Eng, 38, 1164–1177 (2010)
- Zervantonakis IK, Kothapalli CR, Chung S, Sudo R, Kamm RD. Microfluidic devices for studying heterotypic cell-cellinteractions and tissue specimen cultures under controlled microenvironments. Biomicrofluidics, 5, 13406 (2011)
- Shin Y, Han S, Jeon JS, Yamamoto K, Zervantonakis IK, Sudo R, Kamm RD, Chung S. Microfluidic assay for simultaneous culture of multiple cell types on surfaces or within hydrogels. Nat Protoc, 7, 1247–1259 (2012)










