研究交流
肝発生過程における胆管上皮細胞の分化能の変化
谷水 直樹
札幌医科大学医学部 附属フロンティア医学研究所 組織再生学部門
はじめに
肝臓を構成する上皮細胞である肝細胞と胆管上皮細胞は、胎生中期に肝芽細胞から分化する。一方、成熟した肝臓では、①肝細胞あるいは胆管上皮細胞がそれぞれ増殖する、あるいは②肝幹・前駆細胞が肝細胞あるいは胆管上皮細胞に分化することによって、必要に応じて肝細胞と胆管上皮細胞が供給されていると考えられる。さらに、③肝細胞→胆管上皮細胞あるいは胆管上皮細胞→肝細胞への分化(分化転換)が起こることによっても、肝細胞および胆管上皮細胞を供給することが可能である。これまでに、肝細胞でNotch シグナルが活性化した場合などに、肝細胞が胆管上皮細胞へ分化することが報告されている[1, 2]。胆管には、肝幹・前駆細胞の表面抗原として同定されたEpCAMやCD133などが発現している [3, 4]ことから、胆管組織内に幹・前駆細胞が存在している可能性が指摘されている。一方で、胆管の主要な構成細胞である胆管上皮細胞の分化能については不明な点が多い。胆管上皮細胞は胎生後期に始まる形態形成のプロセスを経て胆管構造を完成させる(図1)が、その過程で細胞の分化能は変化しないのだろうか? 我々は、胎生後期から成体までの発生過程の肝臓から、胆管上皮細胞を分離して分化能を検討してきた。その結果をもとに、胆管上皮細胞の分化能の変化と分化能を制御する分子機構について述べるとともに、胆管上皮細胞と肝幹・前駆細胞の関係について考察する。
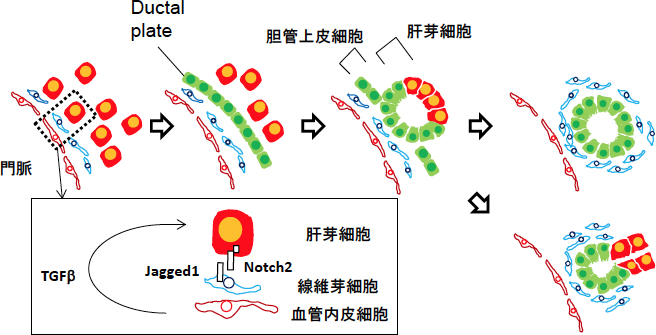
図1.肝芽細胞から胆管上皮細胞の分化と胆管の形態形成
門脈近傍ではNotchシグナルを介した線維芽細胞と肝芽細胞の相互作用や血管内皮細胞・線維芽細胞が分泌するTGFβの作用によって、肝芽細胞が胆管上皮細胞に分化する。Ductal plateは、胆管上皮細胞と肝芽細胞が形成する非対称な構造を経て、胆管構造を形成する。AntoniouらやZongらのモデルでは、非対称構造を形成している肝芽細胞が胆管上皮細胞へ分化し、胆管構造が形成される。なお、非対称構造を形成している胆管上皮細胞が形態変化することで胆管を形成し、肝芽細胞は肝細胞へ分化する可能性も考えられる。
「肝胆膵」第65巻1号(2012年7月号) p. 73-82から引用。
胆管の発生と肝芽細胞から成体型肝幹・前駆細胞への変遷
胆管の発生は、胎生中期に肝芽細胞の一部が胆管上皮細胞に運命決定されることで始まる。門脈近傍の肝芽細胞では、Jagged-1陽性の線維芽細胞との接触によりNotchシグナルが活性化される [5]。さらに、血管内皮細胞および線維芽細胞が分泌するTGFβの刺激も受けて、胆管上皮細胞へと分化する [6]。運命決定直後の胆管上皮細胞は、Ductal plateと呼ばれる細胞層を形成するが、Ductal plateはその後の発生過程で樹枝状構造の胆管へと再構成される(図1)[7]。
肝幹・前駆細胞は、in vitroでclonalに増殖してコロニーを形成する能力を持ち、in vivoおよびin vitroで肝細胞(および胆管上皮細胞)に分化する細胞として解析が行われてきた。これまでの研究で、胎仔期には実質領域にある肝芽細胞画分に、生後には胆管上皮細胞画分に幹・前駆細胞が含まれていることが示されている[8]。
我々は、コラゲナーゼ灌流法を工夫することで、生後1週目の肝臓から胆管上皮細胞画分と肝細胞画分の細胞を分離することを可能にした(図2-A)。その結果、生後1週目の胆管上皮細胞は、胎生17日や生後2週目以降の細胞と比較しても、高頻度にアルブミン陽性細胞を含むコロニーを形成したことから、多くの細胞が肝細胞への分化能を有していることが予想された(図2-B)。そこで、新生仔期と成体の胆管上皮細胞の肝細胞分化能をより詳細に比較検討することで、胆管上皮細胞の分化能を制御するメカニズムを明らかにしようと考えた。
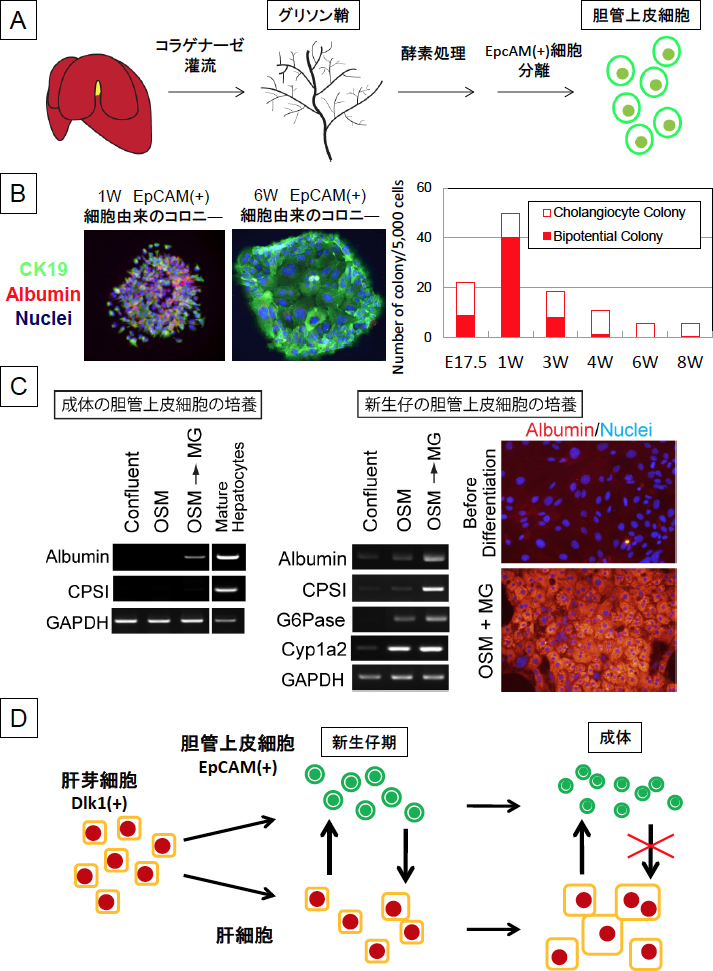
図2.胆管上皮細胞の分化能の変化
| A. | 胆管上皮細胞の分離方法。肝臓をコラゲナーゼ灌流すると、胆管を含むグリソン鞘は未消化物として残る。未消化組織を、さらにコラゲナーゼ/ヒアルロニダーゼで処理して得られた細胞画分からMACSまたはFACSを用いてEpCAM陽性の胆管上皮細胞を分離した。 |
| B. | 胆管の分化能の検討。胎生17.5日(E17.5)から生後8週目(8W)の肝臓からEpCAM陽性細胞を分離し、その分化能をコロニーアッセイを用いて評価した。生後2週目までは、多くのアルブミン陽性細胞を含むコロニーが形成されるが、6週目以降のコロニーは、サイトケラチン19陽性細胞のみで形成されるコロニーが大部分であった。 |
| C. | 新生仔の胆管上皮細胞からの肝細胞への分化誘導。胆管上皮細胞をコラーゲンゲル上で増幅した後、ゼラチンコートしたプレートで培養した。10ng/mlのオンコスタチンM(OSM)を加えて4日間培養した後、0.5%のマトリゲル(MG)を重層して肝細胞分化を誘導した。新生仔胆管上皮細胞の培養では、代謝酵素やCypのmRNAレベルでの発現が誘導され、アルブミンの発現はタンパク質レベルでも検出できた。 |
| D. | 肝臓上皮の細胞系譜。胆管上皮細胞は新生仔期には肝細胞へ分化能を持っているが、発生の過程でその能力を失うと考えられる。肝細胞は、Notchシグナルの活性化などによって成体でも胆管上皮細胞様の細胞に分化(転換)することが示されている。 |
発生過程での胆管上皮細胞の肝細胞分化能の変化
我々は、新生仔期(生後1週目)および成体(生後6~8週目)の肝臓からEpCAM陽性の胆管上皮細胞を分離し、コラーゲンゲル上で増幅した後、オンコスタチンMの添加とマトリゲルの重層を行って肝細胞への分化を誘導した。新生仔期のEpCAM陽性の胆管上皮細胞は、代謝酵素やCytochrome P450 (Cyp) のmRNAを発現するようになり、アンモニア代謝能を獲得し、毛細胆管様構造を形成するなど、成熟肝細胞様の細胞に分化した(図2-C)。一方、成体の胆管上皮細胞の培養では、遺伝子レベルでわずかにアルブミンの発現が上昇したものの、代謝酵素の発現は誘導されなかった。以上の結果から、胆管上皮細胞は、新生仔期には肝細胞への分化能を持つが、成体に至るとその能力を失うと考えられた(図2-D)。
胆管上皮細胞の上皮細胞としての成熟化と肝細胞への分化抑制
新生仔の細胞では、肝細胞への分化誘導の過程で転写因子HNF4αやC/EBPαの発現が誘導されるのに対して、成体の細胞では、これらの転写因子は誘導されなかった(図3-A)。したがって、これらの転写因子の発現誘導の有無が、肝細胞への分化能を決めているのではないかと予想した。しかしながら、成体の胆管上皮細胞にHNF4αやC/EBPaを導入しても、アルブミンやカルバモイルリン酸合成酵素(CPSI)の遺伝子発現がわずかに誘導されただけで、肝細胞への分化・成熟は誘導できなかった
そこで、成体の胆管上皮細胞には肝細胞への分化を抑制する機構が存在しているのではないかと考えた。興味深いことに、新生仔と成体の胆管上皮細胞は、上皮細胞としての成熟度に違いがあることが示唆された。EpCAM陽性細胞を培養してmonolayerを形成させると、成体の細胞の方が高い上皮バリア機能を示した。また、3次元培養を行うと、より大きな管腔を持つシストを形成した。これらの結果は、新生仔期の細胞は成体の細胞と比較して上皮細胞としての成熟度が低いことを示していた。我々が胆管上皮細胞の密着結合の形成を促進する因子として同定した転写因子Grainyhead-like 2 (Grhl2)は、胆管構造を形成する胆管上皮細胞に発現しおり(図3-B)、肝前駆細胞に遺伝子導入することで管腔の形成を促進する(図3-C) [9]。ところが、新生仔の胆管での発現レベルは、成体よりも低いことがわかった。また、肝細胞分化誘導の過程で、新生仔胆管上皮細胞のGrhl2の発現はさらに低下していた(図3-D)。以上の結果から、Grhl2は、胆管上皮細胞の上皮細胞としての成熟化を促進する役割に加えて、肝細胞への分化を抑制する機能も担っている可能性が考えられた。
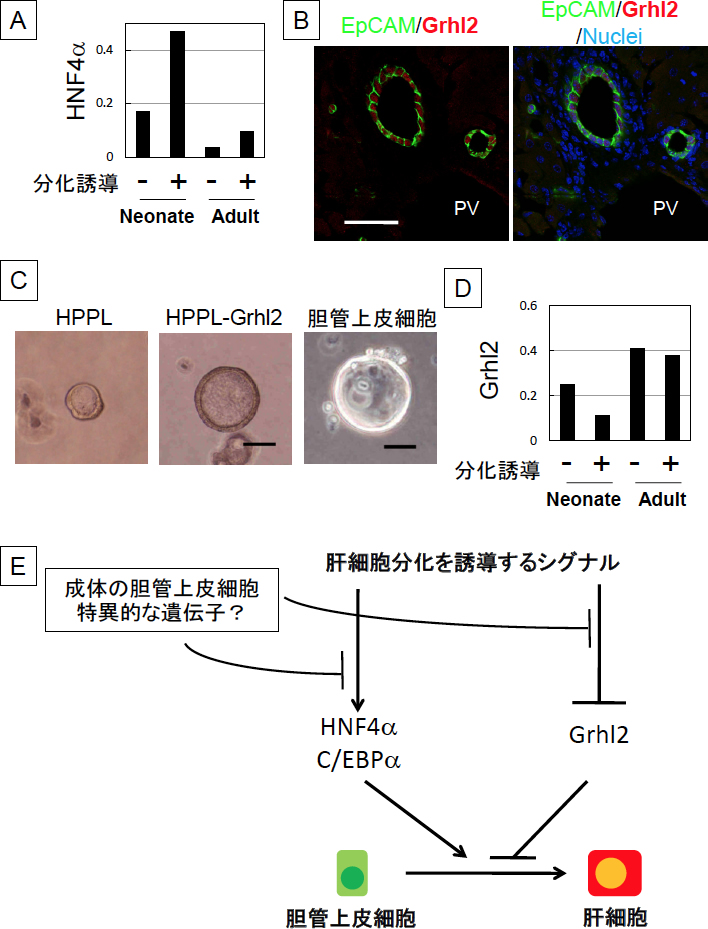
図3.胆管上皮細胞の肝細胞分化能を制御するメカニズム
| A. | 新生仔胆管上皮細胞の培養では、OSMとマトリゲルによる分化誘導によって、HNF4α、C/EBPα、HNF1αなど肝細胞分化に必要な転写因子の発現が誘導される(ここでは代表的なものとして、HNF4αの発現変化を示した)。 |
| B. | Grhl2は、管状構造を形成する胆管上皮細胞に特異的に発現している。ここでは、生後1週間目の肝臓切片の染色像を示している。 |
| C. | 肝前駆細胞株HPPLにGrhl2を導入して3次元培養を行うと、管腔が大きく発達したCystを形成する。成体肝臓由来の胆管上皮細胞も、3次元培養において管腔構造が発達したCystを形成する。Grhl2は、Claudinの発現上昇と密着結合への局在の促進によって、上皮細胞としての成熟化を促していることが解っている。Scale bars; 50 mm |
| D. | 新生仔胆管上皮細胞の培養では、OSMとマトリゲルによる分化誘導によって、Grhl2の発現は抑制されていた。 |
| E. | 肝細胞分化誘導シグナル(培養系ではOSM とマトリゲル)によって肝細胞分化に必要な転写因子が誘導され、胆管上皮細胞の成熟を促進する転写因子が抑制される。成体の胆管上皮細胞には、これらの効果を抑制するメカニズムが備わっていると考えられる。 |
Panel B~Dは、「肝胆膵」第65巻1号(2012年7月号) p. 73-82から引用。
まとめ
我々は、新生仔期の胆管上皮細胞が肝細胞へ分化能を持っていることを見出した。一方で、成体の胆管上皮細胞は肝細胞へは分化しなかった。その理由として、①肝細胞への分化シグナルに応答して肝細胞分化に必要なHNF4αやC/EBPαが誘導されない、②肝細胞分化を抑制するGrhl2などの発現が高い状態で維持されていることが考えられた(図3-E)。現在、Grhl2など胆管特異的な因子が、肝前駆細胞や新生仔胆管上皮細胞の肝細胞分化を抑制する作用があるのかについて検討しているところである。
我々は、マウスおよびヒトの胆管上皮細胞がex vivoで非常に高い増殖能を持っており、数カ月にわったって継代して維持することが可能であることを見出している。これらの細胞から肝細胞を誘導することは困難であったが、培養期間中、胆管上皮細胞としての性質を維持していた。わずかに得られる肝組織片あるいは胆嚢細胞から胆管上皮細胞を分離して増幅できると考えられるので、多嚢胞症やそれに伴う肝線維化など胆管上皮細胞の異常に伴う疾患に対する薬剤スクリーニングなどに使用可能な系を確立できるかもしれない。
胆幹・前駆細胞は、胆管と肝細胞索の境界組織構造であるヘリング管近傍、あるいは腺膀構造近傍であるとの説がある[10] が、それらの組織構造を胆管と区別して認識する抗体が存在しないため、肝幹・前駆細胞の組織内での局在は未だ不明である。最近、Lineage tracingの手法を用いて、CDE障害肝(choline-deficient/ethionine supplemented dietを与えて障害を誘導)でOsteopontin陽性のLPC(liver progenitor cell)から肝細胞が誘導されることが報告された[11]。また、DDC障害肝(3,5-diethoxycarbonyl-1,4-dihydrocollidineを含む餌を与えて障害を誘導)で出現するFoxl1陽性細胞 [12] や四塩化炭素障害肝で出現するLgr5陽性細胞 [13] からも肝細胞が誘導されることが示されている。しかしながら、Osteopontinは胎仔期から成体に至るまで胆管上皮細胞に発現している。一方、Foxl1陽性細胞とLgr5陽性細胞は正常肝には存在せず障害時のみ胆管近傍に出現するので、これらの細胞の起源は不明である。したがって、肝幹・前駆細胞を組織内で同定するまでには至っていない。今後は、新生仔と成体期の胆管上皮細胞の分化能の違いを規定する分子メカニズムの詳細を究明するとともに、両細胞を比較することで、新たに肝幹・前駆細胞と胆管上皮細胞を区別することを可能にする分子の同定にも取り組みたいと考えている。
謝辞
本稿では、University of California San FranciscoのProf. K. E. Mostovの研究室、東京大学の宮島篤教授の研究室で得られた研究成果をもとに、札幌医科大学の三高俊広教授の研究室で行った実験結果を中心に書かせていただきました。3人の先生方とそれぞれの研究室の皆様に感謝いたします。
References
- Nishikawa, Y., Doi, Y., Watanabe, H., Tokairin, T., Omori, Y., Su, M., Yoshioka, T., Enomoto, K. (2005) Am J Pathol, 166,1077-1088.
- Zong, Y., Panikkar, A., Xu, J., Antoniou, A., Raynaud, P., Lemaigre, F., Stanger, B.Z. (2009) Development, 136,1727-1739.
- Okabe, M., Tsukahara, Y., Tanaka, M., Suzuki, K., Saito, S., Kamiya, Y., Tsujimura, T., Nakamura, K., Miyajima, A. (2009) Development, 136,1951-1960.
- Suzuki, A., Sekiya, S., Onishi, M., Oshima, N., Kiyonari, H., Nakauchi, H., Taniguchi, H. (2008) Hepatology, 48,1964-1978.
- Tanimizu, N., Miyajima, A. (2004) J Cell Sci, 117,3165-3174.
- Clotman, F., Jacquemin, P., Plumb-Rudewiez, N., Pierreux, C.E., Van der Smissen, P., Dietz, H.C., Courtoy, P.J., Rousseau, G.G., Lemaigre, F.P. (2005) Genes Dev, 19,1849-1854.
- Antoniou, A., Raynaud, P., Cordi, S., Zong, Y., Tronche, F., Stanger, B.Z., Jacquemin, P., Pierreux, C.E., Clotman, F., Lemaigre, F.P. (2009) Gastroenterology, 136,2325-2333.
- Kamiya, A., Kakinuma, S., Yamazaki, Y., Nakauchi, H. (2009) Gastroenterology, 137,1114-1126, 1126 e1111-1114.
- Senga, K., Mostov, K.E., Mitaka, T., Miyajima, A., Tanimizu, N. (2012) Mol Biol Cell, 23,2845-2855.
- Cardinale, V., Wang, Y., Carpino, G., Cui, C.B., Gatto, M., Rossi, M., Berloco, P.B., Cantafora, A., Wauthier, E., Furth, M.E., Inverardi, L., Dominguez-Bendala, J., Ricordi, C., Gerber, D., Gaudio, E., Alvaro, D., Reid, L. (2011) Hepatology, 54,2159-2172.
- Espanol-Suner, R., Carpentier, R., Van Hul, N., Legry, V., Achouri, Y., Cordi, S., Jacquemin, P., Lemaigre, F., Leclercq, I.A. (2012) Gastroenterology, 143,1564-1575 e1567.
- Shin, S., Walton, G., Aoki, R., Brondell, K., Schug, J., Fox, A., Smirnova, O., Dorrell, C., Erker, L., Chu, A.S., Wells, R.G., Grompe, M., Greenbaum, L.E., Kaestner, K.H. (2011) Genes Dev, 25,1185-1192.
- Huch, M., Dorrell, C., Boj, S.F., van Es, J.H., Li, V.S., van de Wetering, M., Sato, T., Hamer, K., Sasaki, N., Finegold, M.J., Haft, A., Vries, R.G., Grompe, M., Clevers, H. (2013) Nature, 494,247-250.










