研究交流
肝再生と線溶系
関 泰一郎
日本大学大学院 生物資源科学研究科 応用生命科学専攻
要約
線溶は、血管内に形成されたフィブリン塊を分解除去する機構で血流の維持に重要である。一方、線溶酵素が細胞表面に局在し、その周囲にプロテアーゼ活性を提供する細胞線溶という機能が存在する。細胞線溶は、細胞運動や細胞外マトリックスの分解と組織再構築、血管新生など生体内の様々な現象に関与する。本稿では、肝再生における線溶の役割について紹介する。
はじめに
血管内での血液の流動性は、凝固系と線溶系のバランスにより巧妙に維持されている。血管の損傷は、血小板と各種血液凝固因子を活性化し、最終的に架橋fibrinを形成して止血する。凝固系の開始とほぼ同時に線溶系も活性化され、不要な止血栓(fibrin)は可溶性のペプチド断片へと分解され血流が確保される。
線溶系は、fibrinを分解する線溶酵素plasminに加え、plasminの不活性前駆体plasminogenを活性化するtissue-type plasminogen activator(tPA), urokinase-type plasminogen activator(uPA)から構成される。PlasminやtPA, uPAは、α2-plasmin inhibitor (α2-PI), plasminogen activator inhibitor-1 (PAI-1)により活性調節を受ける。PlasminogenとtPAは、plasminによる限定加水分解によりfibrin分子上に露呈されるC末端lysine残基に結合することで、PAI-1や α2-PIによる阻害を受けにくくなり、効率よくfibrinを分解する。近年fibrin分子上へのplasminの結合を阻害する因子としてthrombin-activatable fibrinolysis inhibitor (TAFI)が同定された。TAFIはthrombinにより活性化される血漿カルボキシペプチダーゼの一種であり、活性型TAFI (TAFIa) はfibrin分子上のlysine残基を除去することによりplasmin(ogen)やtPAのfibrinへの結合を妨げて線溶を阻害する(図1)。
上述のような血管内での血栓の分解除去に加えて、細胞表面に限局した線溶活性を提供し、細胞遊走や組織構築に関与する細胞線溶と呼称される機能がある(図2)。肝臓は代謝の中枢を担う生体最大の臓器であり、多くの血液凝固・線溶系因子の合成・分泌やそのクリアランスを担う臓器としても知られている。また肝臓は強い再生能を有し、そのメカニズムに関しても本会で活発な議論が展開されてきた。本稿では、肝再生における線溶系の機能について概説する。
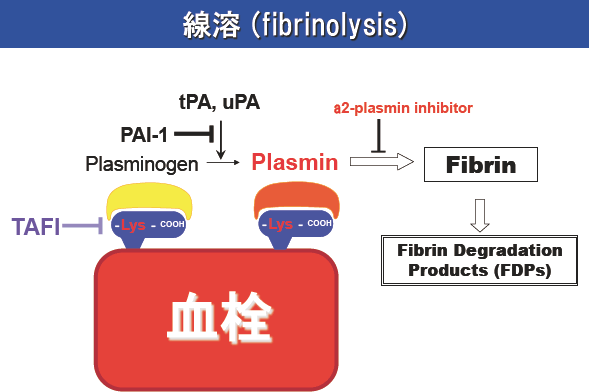
図1.線溶系の概略
線溶酵素plasminは通常plasminogenとして血液中に存在し、血栓の形成に伴って主にtPAにより活性化され、fibrinを可溶性のペプチド断片へと分解する。Plasminogen はfibrin分子上に露呈されたC末端lysine残基とplasminogen分子内に存在するlysine結合部位を介して強固に結合し、α2-plasmin inhibitor などの阻害を受けにくい状態で効率よくfibrinを分解する。TAFIはfibrin分子上のC末端lysine残基を切断するカルボキシラーゼの一種で、基質(fibrin)へのplasminの結合を抑制して線溶を阻害する。
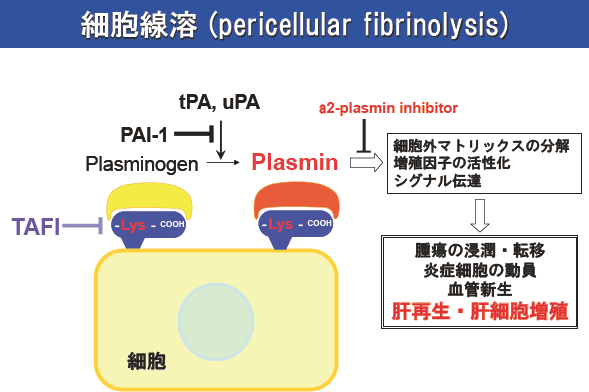
図2.細胞線溶の概略
Plasminogen は細胞表面に存在するlysine残基にも結合し、細胞周囲に限局した線溶活性を発現する。これらは細胞線溶と呼称され、細胞外マトリックス分解、増殖因子の活性化、細胞内シグナルを惹起して、細胞遊走、炎症、血管新生などに関与することが知られている。
1.肝再生と線溶系因子
肝再生と線溶系因子に関するはじめての報告は、ラット部分肝切除後のPAI-1の発現である1)。正常肝臓はPAI-1を発現していないが、部分肝切除後に発現が誘導される前初期応答遺伝子 (immediate early response gene)であることが報告された2)。tPAは肝細胞で合成され胆汁中にも存在する3)。初代培養肝細胞を用いた検討では、tPAは後初期応答遺伝子 (delayed early response gene) に分類される4)。CCl4投与による急性肝障害において、肝臓のtPA遺伝子発現はCCl4投与2日目まで増加し、4日目には定常レベルまで減少する。一方、uPAの遺伝子発現は部分肝切除により変化しないが、uPA受容体uPARは、肝切除後わずか1分からそのタンパク質量が増加し、1時間後に最大になる。対照的に肝組織のuPA活性はuPARと並行して増加し、uPAは遺伝子発現レベルではなく、活性レベルで調節されている5)。また著者らは、uPAは部分肝切除後変化しないこと、uPARは部分肝切除後2時間で一過性に増加し、tPA, uPAともに細胞膜画分に局在することを明らかにした。
Plasminogenは正常肝臓で合成・分泌される。部分肝切除後のplasminogenの発現やplasmin活性について検討したところ、plasmin活性は肝切除24~48時間後の細胞膜画分に特異的に存在すること、plasminogenの遺伝子発現は肝切除24~48時間で一過性に減少することが明らかになった6)。血中のplasminogen存在量が比較的多いことから、plasminogenは部分肝切除後肝細胞周囲に局在することで効率よくplasminへと活性化され機能することが考えられた。著者らは、plasminogenの局在を調節する因子として正常肝臓で合成・分泌されるTAFIに着目した。TAFIは肝切除後1-2日目に遺伝子発現と血漿中のタンパク質レベルが減少し、これらは肝再生の終結とともに回復した。初代培養肝細胞を用いてTAFIの発現調節因子について検討したところ、上皮増殖因子、I型コラーゲン、低細胞密度など、肝細胞に対する増殖刺激によって発現は抑制された6)。
2.線溶系因子遺伝子欠損マウスにおける肝再生
各種線溶系因子の遺伝子欠損マウスは1995年前後に相次いで作製され、これらのマウスの肝再生に関しても解析されている7)。PlasminogenやPAのような線溶を促進する因子は肝再生を促進し、PAI-1やα2-PI, TAFIなどの線溶阻害因子は肝再生を抑制する(表)8-14)。一方、uPAやplasminogenの機能は、部分肝切除モデルと急性肝障害モデルでは異なっている。炎症を伴う肝組織再構築においては、uPAやplasminogenは障害領域の壊死細胞の除去やマトリックス分解に関与し10, 11)、炎症を伴わないモデルでは肝細胞増殖促進機能を有する8, 12 ,13)。
表 線溶系因子欠損マウスにおける肝再生

3.線溶系因子によるHGFの活性化
肝再生における線溶系因子の役割の一つに、肝細胞増殖因子 (HGF) の活性化がある。HGFは、肝再生初期に肝非実質細胞において一本鎖の前駆体として産生され、肝細胞のHGF受容体c-metを介して肝細胞増殖を促進する15)。さらにHGFシグナル下流のp53を介したシグナル伝達系は、transforming growth factor alpha (TGF-α)を誘導することにより肝細胞増殖を強力に促進する16)。HGFはクリングル構造を有するなど、plasminogenと構造が類似しており、さらin vitroでuPAにより活性化されることから、肝再生における線溶の重要性が考えられてきた。実際にuPAやplasminogen欠損マウスでは、肝再生におけるHGFの活性化が抑制され、逆にPAI-1欠損マウスではHGFの活性化が促進される13)。Shanmukhappaらは肝再生におけるHGFの活性化因子としてplasminの重要性を指摘した 10)。Plasminogen欠損マウスでは、HGFの活性化やc-metシグナル、肝細胞の遊走が減少した。一方、野生型マウス由来の初代培養肝細胞にproHGFを加えると、肝細胞により産生されるplasminogenによりHGFが活性化されること、plasminogen欠損マウス由来の初代培養肝細胞にproHGFとplasminを加えることでHGF/c-metシグナルが活性化された。これらの結果からplasminによるHGFの活性化が肝再生における肝細胞増殖や肝組織の正常な再構築に重要であることが明らかになった。
4.肝細胞に結合したplasminogenの機能
肝再生においては、HGFなどの液性因子に加え、細胞外マトリックスの再構築や非実質細胞の関与など、肝組織内の微小環境と肝細胞との協調が重要である。上述のように肝再生において線溶系因子の肝細胞表面への局在、すなわち細胞線溶の重要性が明らかになってきた。PlasminはBim (bcl-2-interacting mediator of cell death) ELのレベルを減少させ、抗アポトーシス作用を示すこと17)、細胞周囲のuPA活性を調節することが明らかにされている18)。肝細胞におけるplasminogen局在制御因子として著者らはTAFIの関与を考えている。初代培養肝細胞のTAFI発現をsiRNAによりノックダウンすると、肝細胞表面でのplasmin活性の増加と細胞増殖が促進された(図3)6)。一方、肝細胞に発現するplasminogen結合タンパク質にも注目しなければならない。現在までに肝細胞のplasminogen結合タンパク質としてcytokeratin 8が報告されているが、その機能については不明な点が多い。肝再生における肝細胞へのplasminogenの局在メカニズムについて今後さらなる研究が必要である。
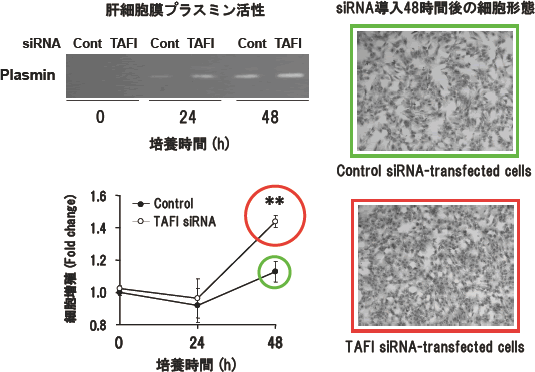
図3.TAFI siRNAによるTAFIのノックダウンが初代培養肝細胞の増殖に及ぼす影響
TAFI siRNAを初代培養肝細胞に導入してTAFIをノックダウンした。これらの細胞の細胞膜画分のplasmin活性をzymographyにより測定した(左上)。TAFIのノックダウンにより細胞膜画分のplasmin活性は増加し、肝細胞の増殖が促進された(左下図、右写真)。(文献6)より一部改変)
おわりに
肝再生における線溶系因子の役割は、細胞外マトリックス分解や増殖因子の活性化、線溶系因子自身によるシグナル伝達など、多岐にわたることが考えられる(図4)。肝再生をはじめとした組織再生における線溶系機能の解明は、線溶に関する新しい概念を構築するとともに、線溶系が関与する疾患の予防や治療に新たな可能性を示す基礎的な知見になることが期待される。
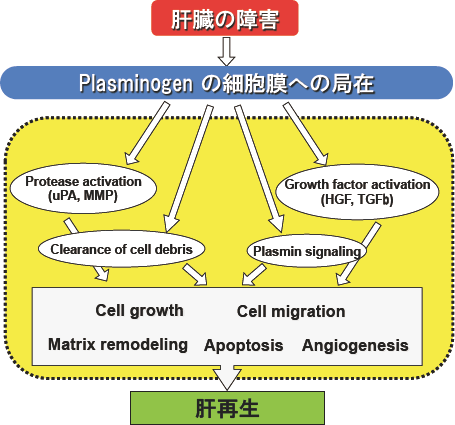
図4.肝再生における線溶系因子の機能
肝障害によりplasminogenをはじめとした線溶系因子は肝細胞膜上に局在し、様々な作用を介して肝再生を終結させる。
文献
- Schneiderman J, Sawdey M, Craig H, Thinnes T, Bordin G, Loskutoff DJ. Type 1 plasminogen activator inhibitor gene expression following partial hepatectomy. Am. J. Pathol. 143 : 753-762, 1993
- Thornton AJ, Bruzdzinski CJ, Raper SE, Gelehrter TD. Plasminogen activator inhibitor-1 is an immediate early response gene in regenerating rat liver. Cancer. Res. 54 : 1337-1343, 1994
- Seki T, Ariga T, Saitoh K, Sugawara T, Oshiba S. Hormonal regulation of plasminogen activator production by rat hepatocytes in primary culture. Thromb. Res. : 58, 543-554, 1990
- Uno S, Nakamura M, Seki T, Ariga T. Induction of tissue-type plasminogen activator (tPA) and type-1 plasminogen activator inhibitor (PAI-1) as early growth responses in rat hepatocytes in primary culture. Biochem. Biophys. Res. Commun. 239 : 123-128, 1997
- Mars WM, Liu ML, Kitson RP, Goldfarb RH, Gabauer MK, Michalopoulos GK. Immediate early detection of urokinase receptor after partial hepatectomy and its implications for initiation of liver regeneration. Hepatology 21 : 1695-1701, 1995
- Okumura N, Koh T, Hasebe Y, Seki T, Ariga T. A novel function of thrombin-activatable fibrinolysis inhibitor during rat liver regeneration and in growth-promoted hepatocytes in primary culture. J. Biol. Chem. 284 : 16553-16561, 2009
- Ploplis VA, Castellino FJ. Gene targeting of components of the fibrinolytic system. Thromb. Haemost. 87 : 22-31, 2002
- Drixler TA, Vogten JM, Gebbink MF, Carmeliet P, Voest EE, Borel Rinkes IH. Plasminogen mediates liver regeneration and angiogenesis after experimental partial hepatectomy. Br. J. Surg. 90 : 1384-1390, 2003
- Pohl JF, Melin-Aldana H, Sabla G, Degen JL, Bezerra JA. Plasminogen deficiency leads to impaired lobular reorganization and matrix accumulation after chronic liver injury. Am. J. Pathol. 159 :2179-86, 2001
- Shanmukhappa K, Matte U, Degen JL, Bezerra JA. Plasmin-mediated proteolysis is required for hepatocyte growth factor activation during liver repair. J. Biol. Chem. 284 : 12917-12923, 2009
- Bezerra JA, Currier AR, Melin-Aldana H, Sabla G, Bugge TH, Kombrinck KW, Degen JL. Plasminogen activators direct reorganization of the liver lobule after acute injury. Am. J. Pathol. 158, 921-929, 2001
- Roselli HT, Su M, Washington K, Kerins DM, Vaughan DE, Russell WE. Liver regeneration is transiently impaired in urokinase-deficient mice. Am. J. Physiol. 275 : G1472-G1479, 1998
- Shimizu M, Hara A, Okuno M, Matsuno H, Okada K, Ueshima S, Matsuo O, Niwa M, Akita K, Yamada Y, Yoshimi N, Uematsu T, Kojima S, Friedman SL, Moriwaki H, Mori H. Mechanism of retarded liver regeneration in plasminogen activator-deficient mice: impaired activation of hepatocyte growth factor after Fas-mediated massive hepatic apoptosis. Hepatology 33 : 569-576, 2001
- Okada K, Ueshima S, Imano M, Kataoka K, Matsuo O. The regulation of liver regeneration by the plasmin/alpha 2-antiplasmin system. J. Hepatol. 40 : 110-116, 2004
- Michalopoulos GK, DeFrances MC. Liver regeneration. Science 276 : 60-66, 1997
- Inoue Y, Tomiya T, Yanase M, Arai M, Ikeda H, Tejima K, Ogata I, Kimura S, Omata M, Fujiwara K. p53 May positively regulate hepatocyte proliferation in rats. Hepatology. 36 : 336-344, 2002
- Kawao N, Okada K, Kawata S, Okamoto C, Tsuritani M, Ueshima S, Matsuo O. Plasmin decreases the BH3-only protein BimEL via the ERK1/2 signaling pathway in hepatocytes. Biochim. Biophys. Acta. 1773 : 718-727, 2007
- Okumura N, Seki T, Ariga T. Cell surface-bound plasminogen regulates hepatocyte proliferation through a uPA-dependent mechanism. Biosci. Biotechnol. Biochem. 71 : 1542-1549, 2007










