研究交流
肝重量の恒常性維持機構
小島 至
群馬大学生体調節研究所
肝臓は生命を維持するために必須の臓器で、その臓器重量はきわめて狭い範囲に維持されている。部分肝切除や、劇症肝炎などの重篤な肝障害により有効な肝重量が激減した場合には、肝再生がスタートする。その後、有効肝重量がほぼ元のレベルに回復した時点で再生は停止するとともに組織が再構築される。一方、何らかの事情で肝重量が増加した場合、例えば大きな肝臓を移植した場合などには、肝細胞にアポトーシスが起こりやがて肝重量は本来のレベルまで減少する。このような肝重量の恒常性維持機構は種の枠を超えても作動するようである。1990年代前半、アメリカでは一時期ヒヒの肝臓をヒトに移植する異種肝移植が行われた。この際、移植されたヒヒの肝臓は、レシピエントの体に見合うサイズで増殖を停止したのである。
この肝重量の恒常性維持に重要な因子はTGF (transforming growth factor)-βスーパーファミリーに属する因子であり、中でもアクチビンAがもっとも重要な役割を果たしている。正常肝において、アクチビンAは中等度の発現がみられるが、部分肝切除を行うと、直後に発現が激減する。やがて再生が進むにつれて発現は著明に増加し、肝重量が元のレベルに回復する頃に発現のピークを迎える1)。その後発現は減少し、やがて数時間後に正常肝のレベルに復帰する。アクチビンAやTGF-βは増殖抑制因子で、肝再生を負に調節していると考えられている。例えば、部分肝切除を行う際にアクチビンAの作用を抑制するフォリスタチンを投与すると、肝再生が加速される2, 3)。さらに肝再生の後期にフォリスタチンを投与すると、再生は本来の肝重量に戻っても停止せず、結果として肝重量は正常より増大してしまう。この場合、やがてTGF-βの発現が著増し、肝細胞にアポトーシスが惹起されてやがて肝重量は正常近くにもどる。これらの結果は、アクチビンAが肝再生のブレーキをかける主要な因子であり、それが作動しない場合には代わってTGF-βがブレーキ役を果たしていることを示している。
アクチビンAはさらに、正常肝重量の維持に重要な役割を果たしている。正常肝において発現しているアクチビンAは、肝細胞の増殖を常に抑制して定常状態を保っているようで、この抑制作用により肝臓はあるべき重量に維持されていると考えられる。実際、正常ラットの肝臓にフォリスタチンを投与してアクチビン作用をキャンセルすると、なんら増殖刺激がないにも関わらず、ただちに肝細胞に増殖が誘導される(図1)。一部の肝細胞(約10%)はフォリスタチン投与のわずか3時間後にS期に入りDNA複製を開始する。残りの肝細胞もその約50%がやがて24-48時間以内にDNA 複製を開始し、その結果肝重量も増加する4)。この結果は意外であるが、正常肝の一部(約10%)の肝細胞はG1/S期の周辺でアクチビンAの作用により増殖を停止していることを示唆している。フォリスタチン投与と同様に、アクチビンAのノックダウン、変異アクチビン受容体の導入などを行った場合にも、増殖刺激がないにもかかわらず肝細胞の増殖が誘導される5)。アクチビンAの抑制作用がなければ肝細胞は常に増殖を開始する状態にあると考えられる。つまり正常肝における肝細胞は、増殖促進作用と抑制作用の微妙なバランスにより辛うじて増殖を停止している状態にある。
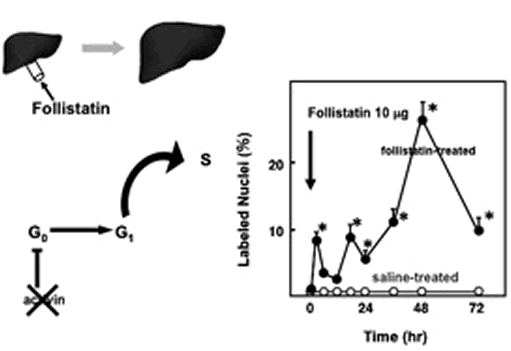
図1 フォリスタチンにより誘導される肝細胞のDNA合成
ラット門脈内に10μgフォリスタチン(●)あるいは生理的食塩水(○)を投与し、その後の肝細胞BrdUラベリングを測定した。*:p<0.01 vs 生理的食塩水群。
一般的に、正常肝における肝細胞は細胞周期から外れた安定的な定常状態つまり静止期(G0期)にあり、分化機能を発揮していると理解されている。増殖という視点からはきわめて安定的な状態であると考えられている。ところが、肝臓はダイナミックな代謝を行う臓器で、栄養状態の変化により肝細胞のグリコゲン含量は大きく変化し、肝重量もそれに伴って変動している。実は肝細胞の増殖状態は、この糖代謝に伴う肝重量の変化とも連動して変化するようである。例えば、飽食状態のラットに絶食をさせると、やがてグリコゲン量は減少し始め、24-48時間後には肝重量が20%以上減少する。この時、アクチビンAの発現は時間とともに減少し、絶食24時間以降には消失してしまう(未発表データ)。おそらくこのアクチビンAの消失によって、絶食48時間後には無傷の肝臓であるにもかかわらず一部の肝細胞がS期に入りDNA複製を開始する。同じような肝重量変化は日内変動として観察され、飽食状態と空腹状態では肝重量は10-15%も異なる。これに対応してアクチビンAの発現も変動し、したがって肝細胞の増殖状態も変動していると予想される。
つまり正常肝における肝細胞は決して安定的な定常状態にあるのではなく、代謝の影響を受けて肝重量は変動し、それに対応したアクチビンA発現の変化により増殖抑制シグナルも変動する。肝細胞はこうした増殖促進と増殖抑制のダイナミックなバランスの上にあり、肝重量の恒常性もこのような動的なものとして理解する必要がある。
フォリスタチン投与により正常肝の肝細胞は増殖を開始する。投与3時間後に見られるDNA複製の開始はアクチビンによる抑制作用が解除されたことによる。一方、24-48時間後に見られるDNA合成には、フォリスタチンによりGDF (growth/differentiation factor)15とFGF (fibroblast growth factor)21という二つの因子の発現が誘導されることによる6)。正常肝において、アクチビンAは増殖抑制作用を発揮して一部の肝細胞の増殖を抑制するとともに、上記の二因子の発現抑制を介して増殖を停止させているものと考えられる(図2)。
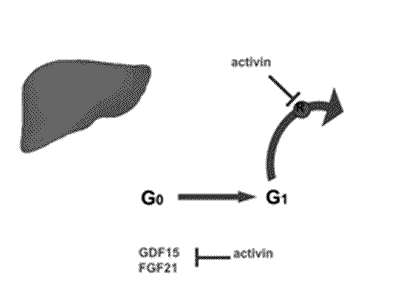
図2 正常肝におけるアクチビンAの作用点
アクチビンAはG1/S境界付近で増殖を抑制するとともに、GDF15, FGF21 の発現を抑制して肝細胞の増殖を抑制している。
文献
- Yasuda H, Mine T, Shibata H, Eto Y, Hasegawa Y, Takeuchi T, Asano S, Kojima I Activin A: an autocrine inhibitor of initiation of DNA synthesis in rat hepatocytes. J Clin Invest 92:1491-1496,1993.
- Kogure K, Omata W, Kanzaki M, Zhang YQ, Yasuda H, Mine T, Kojima I A single intraportal administration of follistatin accelerates liver regeneration in partially hepatectpmized rats. Gastroenterology 108:1136-1142,1995.
- Kogure K, Zhang YQ, Shibata H, Kojima I Immediate onset of DNA synthesis in remnant rat liver after 90% hepatectomy by an administration of follistatin. J Hepatol 29:977-984,1998.
- Kogure K, Zhang YQ, Maeshima A, Suzuki K, Kuwano H, Kojima I The role of activins and transforming growth factor-b in the regulation of organ mass of the liver. Hepatology 31:916-921,2000.
- Ichikawa T, Zhang YQ, Kogure K, Hasegawa Y, Takagi H, Mori M, Kojima I Transforming growth factor-β and activin tonically inhibit DNA synthesis in the liver. Hepatology 34: 918-925,2001.
- Medina J, Yamada S, Kojima I Identification of differentially expressed genes induced during the proliferative response of the liver induced by follistatin. Endocrine J 56:1067-1077,2009.










