研究交流
間葉系幹細胞を用いた肝疾患に対する細胞治療の可能性
落谷孝広
独立行政法人国立がん研究センター研究所分子細胞治療研究分野
要旨
慢性期にある肝、膵疾患患者に対する新しい治療法として幹細胞の応用が期待され、ES細胞やiPS細胞を用いる研究が盛んに行なわれている(1)。こうした動きに加えて、近年、成体に存在する幹細胞のなかで皮下脂肪組織中に存在する間葉系幹細胞(AT-MSC)に注目が集まっている。この幹細胞の特色は、1)単位容積あたりの幹細胞数が多い、2)拒絶反応を回避可能な患者自身の自家幹細胞を培養することなく用いることが出来る、3)疾患部位に集積(homing)する、4)過剰な免疫反応を抑制する、5)疾患治癒に寄与する様々な増殖因子やサイトカインを産生する、6)血管新生効果がある、7)抗アポトーシス作用がある、8)細胞間相互作用を介した未知の組織修復機能を有する可能性、などの点である。既に我々は、がん患者をドナーとするAT-MSCが様々な肝臓特異的機能を発揮する肝細胞様細胞に分化する可塑性があることや、未分化な状態のAT-MSCを肝疾患モデル動物の肝臓に移植することで肝機能の著明な改善が可能なことを見出してきたし、他の多くのグループも同様である。こうした未分化なAT-MSCの持つ肝疾患治癒能力は、細胞が産生する様々な種類のサイトカイン、ケモカイン等の因子による肝臓保護作用や抗炎症作用である可能性が、プロテインアレイ等の解析により示唆された。本稿では間葉系幹細胞(MSC)の肝、膵疾患治療への応用へ向けての取り組みの現状と将来展望を紹介する。
様々な幹細胞による肝・膵細胞移植治療の現状
近年、様々な臓器障害の修復に幹細胞を用いた再生医療の応用への期待が高まっている。こうした期待は、全能性を有する万能細胞であるES細胞やiPS細胞の登場とともに高まり、ES細胞やiPS細胞から分化させた心筋や神経細胞を心筋梗塞、脊椎損傷、アルツハイマー病などの患者に移植して治療する細胞移植治療の実現が近いとされている。肝臓、膵臓を例にとると、複数の液性因子の組み合わせによるin vitro分化誘導技術を用いた場合のES細胞の肝細胞、膵臓のβ細胞への分化誘導効率は低く、特に肝臓のような大型の臓器を対象とした再生医療を構築する上では、この低い分化誘導効率に起因する細胞数の不足が大きな問題である(1, 2)。膵臓の細胞移植治療に関しても同様の現状である。我が国ではインシュリン治療が浸透しているが、小児期に発症する確率が高い1型糖尿病では膵臓の移植治療に大きな期待が寄せられている。しかし、ドナー不足等の問題から膵臓提供ドナーに頼らない膵臓β細胞を用いた細胞移植治療に、大きな期待が寄せられている。さらに日本でも、膵臓提供ドナーから得た膵臓β細胞を注入する膵島移植が開始された。しかしこの方法では、1人の糖尿病患者を救うために複数の膵臓提供ドナーが必要であり、15000人と推定される重症糖尿病を患う多くの患者さんはこの治療の恩恵が受けられない。ES細胞からも膵臓のβ細胞が分化誘導できるとの報告が相次いだものの、やはり肝細胞分化の場合と同じく、相当量の細胞数を得ることが困難であり、膵臓細胞移植治療の早期実現には至っていない。
肝・膵疾患における種々のヒト幹細胞研究への期待
最近注目されているヒトiPS細胞については、いまだ肝臓の機能を持った細胞への分化誘導の報告が無いが、もし高い効率で肝細胞分化が成功すれば、幹細胞から肝細胞の大量作製に大きな進展が期待できる。しかし、世界中がES細胞で取り組んできた肝細胞への分化誘導効率は決して満足できる結果に至っていない事から、単にiPS細胞だからといって、ES細胞を上回る肝細胞分化能力が有るとは考えられないし、またそれが現実である。しかし、iPS細胞への期待は、どのような起源の細胞からでも人工幹細胞が作製可能な点である。つまり、肝細胞あるいは肝幹細胞をソースにiPS化を誘導した場合、肝細胞への高い分化能力を持った細胞が人工的に作製できるかもしれないという期待である。既に北京大学のグループは肝細胞からiPS細胞を作製し、その高い肝細胞への分化誘導を示していることから(3)、このラインの仕事には大きな期待が寄せられている。さらに、我が国でも大阪大学の水口教授らは独自に開発した遺伝子導入技術(改良型アデノウイルスベクター)を駆使して、細胞分化に必要な遺伝子を分化ステージに応じて順次導入していくことで、iPS 細胞から肝細胞への効率の良い分化誘導法の開発に成功した(4)。膵臓に関してはマウスiPS細胞からマウスの体内で膵臓を作製することに、東京大医科学研究所の中内啓光教授らが成功したと報じられている(5)。ヒトES、iPS細胞から試験管内で大量に膵臓β細胞の作製成功例はまだ無いが、ヒトの皮膚の繊維芽細胞から誘導したiPS細胞がインシュリン産生細胞に分化することは事実のようである(6)。さらに2011年に入ってこの分野では大きな進展があった。iPS細胞から、血糖値を下げるインスリンを分泌する膵島を作ることに、東京大の宮島篤教授らのチームがマウスで成功したと報じられた(日本再生医療学会総会、2011)。これまでインスリンを分泌する細胞自体はできていたが、ほかの細胞とともに実際の組織構築を模倣した立体構造になった膵島づくりに成功した例ははじめてであろう。
このような万能細胞とは別に注目を集めるのが生体の様々な組織に存在する間葉系幹細胞(MSC)である。MSCとES細胞との決定的な違いは、MSCは性別、年齢を問わず存在し、ES細胞のようにヒトの胚を破壊すること無く入手可能である点である。またiPS細胞のように、遺伝子や薬物等を使って誘導する手間ひまもかからない。このMSCは本来、中胚葉系の細胞であるため、培養条件を変えることで、骨、軟骨そして脂肪の3種類の細胞系譜へと分化する。このような可塑性を有するMSCを用いた自家移植の方法はES細胞等に比較して,倫理的な問題や拒絶反応の危険性を回避出来るという利点がある。我々をはじめとして世界中の複数の研究室がMSCから肝細胞を誘導出来ることを報告している(7-8)。また、薬物で人工的に肝機能不全に陥らせたマウスに対する治療効果も確認されている(10)。膵臓のβ細胞に関してもラットMSC(11)やヒト骨髄MSC (12)からβ細胞を誘導することが出来ると報告されている。ただ、MSCから完全な機能を有する肝臓・膵臓細胞を作製する技術の完成度はまだ不十分であり、またその製造過程に要するサイトカインなどの種類や分化誘導に要する日数やGMPレベルでの製造の必要性を考えると、莫大な費用を要することから、解決しなければならない問題点は数多い。
脂肪組織中のMSCには様々な特徴がある
間葉系幹細胞は様々な組織中に存在する。最も良く研究されている骨髄をはじめとして、脂肪、羊膜、羊水、臍帯、各実質臓器などに広く存在するが、このなかでヒト皮下脂肪組織由来の間葉系幹細胞(AT-MSC) の能力には注目すべき点がある(13,14)。それは組織当たりの幹細胞の含有率が、100細胞中に1個というように非常に高い事である。またAT-MCSも可塑性を持っており、軟骨、骨、脂肪細胞へ高頻度に分化する。また、細胞培養は比較的簡単であり、複数回の継代により大量の細胞数の確保も可能である。しかし、継代を重ねると、その可塑性や形態も徐々に失われるが、我々はその可塑性の喪失に伴って減少するCD105という表面マーカーを同定した(10)。このCD105はエンドグリンとも呼ばれ、TGFβのシグナルを細胞内に伝える働きがある。継代数の超過した細胞であっても、CD105陽性の細胞を分画することで、分化能の高い細胞を回収することが可能である。さらに注目すべきはAT-MSCの持つ様々な生物学的特徴である。こうしたAT-MSCの細胞移植治療における特徴と可能性を図1にまとめた。AT-MSCに予想される能力としては、免疫反応の抑制、栄養因子の供給、細胞分化能、血管新生作用、アポトーシス阻止能力、組織修復能力、等様々である。

図1 脂肪組織に由来する間葉系幹細胞(AT-MSC)の能力と疾患治療メカニズム
MSCは細胞治療のソースとして有用か
こうした未分化なMSCの有する様々な組織再生効果が明らかになるにつれ、図1に掲げたような様々な疾患への応用が動物疾患モデルを用いて検証されつつある。特にAT-MSCは乳がんの温存手術後の乳房再建では既に臨床に応用され始めている。この場合、AT-MSCと患者の自家脂肪組織とを混合したかたちで移植する工夫がなされており、脂肪組織単独の施術よりも組織修復の速度が早いのに加えて、時間を経過した後の保存状態も良好のようである。また慢性心疾患や急性心筋梗塞、脳梗塞等への臨床応用研究も始まっている。最近の国内の話題としては、世界初となった放射線潰瘍に患者自身のAT-MSCを移植する治療が長崎大学医学部で実施され、仙骨の潰瘍部位に幹細胞を直接接種する治療が行われた。これは被爆医療に対する新しい組織再生治療法として期待が集まっている。もちろん、MSCはそもそも中胚葉系に分化した細胞である事から、その可塑性、つまり、同じ中胚葉系の細胞系譜である骨、軟骨、脂肪への分化に加えて、胚葉を超えて例えば、肝細胞様に分化する能力もこの細胞の魅力のひとつとなっており、その可塑性に関連する分子群も明らかになりつつある(図2)。
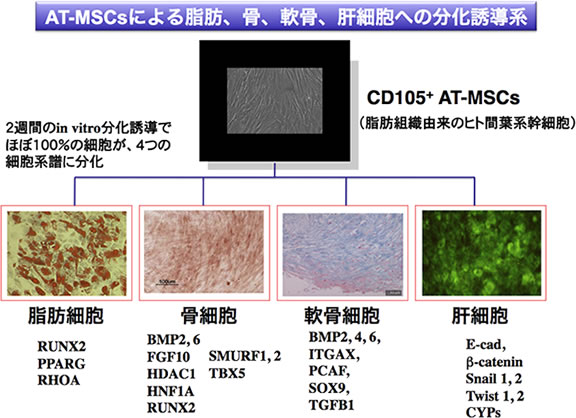
図2 AT-MSCの可塑性
MSCの際立ったホーミング能力
MSCの細胞移植治療を実現するためには、疾患部位への特異的集積能力の解明が必要である。まず、正常な免疫不全動物にヒト由来のMSCを尾静脈から全身性に投与した場合、MSCは脾臓、肝臓、肺、腎臓、脳、心臓といった広い臓器に極めてわずかな細胞数が到達する。これに対し、もし肝臓に障害を与えたマウスに同数のMSCを全身性に投与した場合、多くの細胞は、障害された肝臓を中心に集積する像が得られる(図3)。集積する細胞数は投与された細胞全体の8から10%にも上る。膵臓に対する特異的障害の場合でも同様である(15)。この現象については、例えば全身に放射線を照射されたマウスの場合でも同様で、健康なマウスに比べて何倍もの細胞が障害部位に到達する。例えばこのAT-MSCのホーミングを制御する分子としてCXCR4とそのリガンドであるSDF-1が知られているが(16, 17)、その詳細な分子メカニズムについては、不明な点が多い。もし、脂肪という皮下組織に存在するAT-MSCのような幹細胞が宿主の非常事態に備えたリザーバーの役割を果たしているなら、本来の生理的状態でも、種々のストレスから常にわずかでも障害と再生を繰り返す我々の体内で、AT-MSCが利用されていると考えてもおかしくはない。
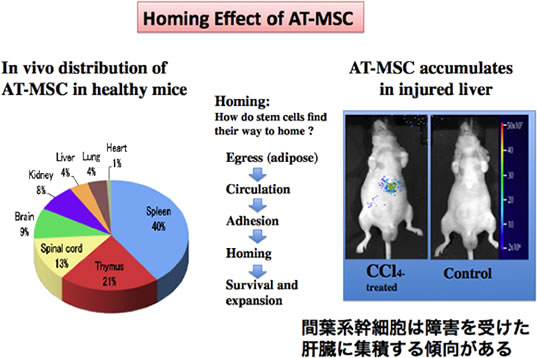
図3 AT-MSCの障害部位集積性
肝・膵臓障害モデル動物へのMSCの移植とその治療効果
未分化なAT-MSCは、in vitroでは何ら肝臓特異的な機能を示さないが、この細胞には顕著に肝障害を回復させる能力があることが明らかとなった(18)。その血清学的な回復度や病理組織学的な障害の抑制度は、分化した肝機能を持つ細胞の移植群に比較して、劣ることは無かった。未発表データであるが、100%致死の肝障害のマウスに、未分化AT-MSCを投与したマウスでは、その生存率は75%に回復したのに対し、分化誘導し、肝機能を持つようになった細胞の移植では25%にとどまった。こうした未分化なAT-MSCの持つ肝疾患治癒能力は、細胞が産生する様々な種類のサイトカイン、ケモカイン等の因子によるtrophic effectであると考えられている。特に肝細胞の増殖に働くVEGF、HGF、FGFなどの因子をはじめ、IL-1RアンタゴニストやIL-10など抗炎症性サイトカイン類の産生も豊富であることから、炎症細胞の集積を抑制する機序と肝障害回復の作用が働いているようだ。さらに最近、このMSCの培養上澄を全身性に投与するだけで、重篤な肝障害モデル動物の延命効果が得られるとの報告がなされるなど(19, 20)、MSCの放出する液性因子が肝不全治療に役立つ可能性も示唆されている。こうした未分化MSCの細胞移植による治療効果は、糖尿病のモデル動物においても示されている(21)。つまりハンガリーのグループは、骨髄細胞とMSCとを同時移植することで、疾患部位の膵臓のβ細胞の再生を促す機構が有ることをSTZ(ストレプトゾトシン)で誘発させたI型糖尿病モデルマウスで示している。
今後の展開
将来の肝疾患に対する再生医療実現に向けて、分化誘導した肝細胞はもちろん、ヒトMSCそのものに肝疾患治癒能力を見出した点は、今後の応用研究に重要な知見である。以上の研究成果は、成人では肝炎ウイルスなどによる重篤な肝不全や、小児の場合の胆道閉鎖症などに対する画期的な新規治療法の確立への道を開くものと期待される。膵臓疾患の代表である重症糖尿病への細胞治療にも大きな朗報となる。世界的にもこの脂肪組織中のAT-MSCは注目され、自家移植ではなく、いわゆるアロジェニックなスタンダードなMSCを用意し、これをあらゆる疾患、患者への細胞移植治療に用いようとする企業も現れた。しかし、まだまだ我々は幹細胞の性状や未分化能の機構を十分に理解したといえる段階には無く、ヒトiPS細胞をモデルとした幹細胞のニッチの解明を含めて様々な角度からの探求が必要である。投与したMSCは、どのくらいの期間生存し、組織再生に働くのか、細胞の分裂や分化はどのように移植された部位で制御されるのか、あるいは移植した細胞そのものががん化する恐れは無いのか、さらには、もしがん細胞が存在した場合、MSCの持つ特徴であるtrophic effectが逆にその転移・浸潤能力を促進するような負の効果を発揮しないかどうか等々、様々な角度からの安全性、有効性の検証をすべきである。
おわりに
こうした未分化なMSCの有する様々な組織再生効果が明らかになるにつれ、様々な疾患への応用が検証されつつある。特にAT-MSCは乳がんの温存手術後の乳房再建では既に臨床に応用され始めている。また慢性心疾患や急性心筋梗塞、脳梗塞等の様々な疾患や、被爆医療等への臨床応用研究も始まっている。こうした臨床応用への取り組みは、幹細胞指針等の国の定める法に準拠する必要が有るが、最近の話題では、幹細胞ビジネスの加熱が、思わぬ問題を引き起こそうとしている。2010 年11 月25 日号 Vol. 468 でNature newsが報じた内容は、幹細胞治療を行なっている一部の企業には、他国の法律の抜け道を利用して、世界各地で自由診療を基本とした事業を展開している事への警鐘を鳴らした (22)。また過去の幹細胞治療には、2010年6月、タイの研究チームが腎臓病の幹細胞治療後に死亡した患者1 人に「奇妙な病巣」が見つかったことを報告 (23)、同年8月には、生後18ヶ月のルーマニア人男児が、脳に幹細胞を注入された後に死亡するなど、安全性の面にもまだまだ問題がある。担がん患者への細胞治療が及ぼす影響についても大型動物等を用いた検証が必要である。幹細胞研究の健全な発展と、何よりも安全性が高く有効な治療法開発のためにも研究者と政府及びクリニックが協力して問題解決にあたるべき時である。
(文献)
- Banas A, Yamamoto Y, Teratani T, Ochiya T. Stem cell plasticity: learning from hepatogenic differentiation strategies. Dev Dyn. 2007; 236: 3228-3241.
- Banas A, Quinn G, Yamamoto Y, Teratani T, Ochiya T. "Stem cells into liver"--basic research and potential clinical applications. Adv Exp Med Biol. 2006; 585: 3-17.
- Cai J, Zhao Y, Liu Y, Ye F, Song Z, Qin H, Meng S, Chen Y, Zhou R, Song X, Guo Y, Ding M, Deng H. Directed differentiation of human embryonic stem cells into functional hepatic cells. Hepatology. 2007; 45: 1229-1239.
- 4. Inamura M, Kawabata K, Takayama K, Tashiro K, Sakurai F, Katayama K, Toyoda M, Akutsu H, Miyagawa Y, Okita H, Kiyokawa N, Umezawa A, Hayakawa T, Furue MK, Mizuguchi H. Efficient generation of hepatoblasts from human ES cells and iPS cells by transient overexpression of homeobox gene HEX. Molecular Therapy 2011; 19: 400-407.
- Kobayashi T, Yamaguchi T, Hamanaka S, Kato-Itoh M, Yamazaki Y, Ibata M, Sato H, Lee YS, Usui J, Knisely AS, Hirabayashi M, Nakauchi H. Generation of rat pancreas in mouse by interspecific blastocyst injection of pluripotent stem cells. Cell. 2010; 142: 787-799.
- Tateishi K, He J, Taranova O, Liang G, D'Alessio AC, Zhang Y. Generation of insulin-secreting islet-like clusters from human skin fibroblasts. J Biol Chem. 2008; 283: 31601-31607.
- Teratani T, Yamamoto H, Aoyagi K, Sasaki H, Asari A, Quinn G, Sasaki H, Terada M, Ochiya T. Direct hepatic fate specification from mouse embryonic stem cells. Hepatology. 2005; 41: 836-846.
- Yamamoto Y, Teratani T, Yamamoto H, Quinn G, Murata S, Ikeda R, Kinoshita K, Matsubara K, Kato T, Ochiya T. Recapitulation of in vivo gene expression during hepatic differentiation from murine embryonic stem cells. Hepatology. 2005; 42: 558-567.
- Ishii K, Yoshida Y, Akechi Y, Sakabe T, Nishio R, Ikeda R, Terabayashi K, Matsumi Y, Gonda K, Okamoto H, Takubo K, Tajima F, Tsuchiya H, Hoshikawa Y, Kurimasa A, Umezawa A, Shiota G. Hepatic differentiation of human bone marrow-derived mesenchymal stem cells by tetracycline-regulated hepatocyte nuclear factor 3beta. Hepatology. 2008; 48: 597-606.
- Banas A, Teratani T, Yamamoto Y, Tokuhara M, Takeshita F, Quinn G, Okochi H, Ochiya T. Adipose tissue-derived mesenchymal stem cells as a source of human hepatocytes. Hepatology. 2007; 46: 219-228.
- Chen LB, Jiang XB, Yang L. Differentiation of rat marrow mesenchymal stem cells into pancreatic islet beta-cells. World J Gastroenterol. 2004; 10: 3016-3020.
- Karnieli O, Izhar-Prato Y, Bulvik S, Efrat S. Generation of insulin-producing cells from human bone marrow mesenchymal stem cells by genetic manipulation. Stem Cells. 2007; 25: 2837-2844.
- Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR. Multilineage potential of adult human mesenchymal stem cells. Science. 1999; 284: 143-147.
- Lee RH, Kim B, Choi I, Kim H, Choi HS, Suh K, Bae YC, Jung JS. Characterization and expression analysis of mesenchymal stem cells from human bone marrow and adipose tissue. Cell Physiol Biochem. 2004; 14: 311-324.
- Takeshita F, Kodama M, Yamamoto H, Ikarashi Y, Ueda S, Teratani T, Yamamoto Y, Tamatani T, Kanegasaki S, Ochiya T, Quinn G. Streptozotocin-induced partial beta cell depletion in nude mice without hyperglycaemia induces pancreatic morphogenesis in transplanted embryonic stem cells. Diabetologia. 2006; 49: 2948-2958.
- Sengenès C, Miranville A, Maumus M, de Barros S, Busse R, Bouloumié A. Chemotaxis and differentiation of human adipose tissue CD34+/CD31- progenitor cells: role of stromal derived factor-1 released by adipose tissue capillary endothelial cells. Stem Cells. 2007; 25: 2269-2276.
- Cho HH, Kyoung KM, Seo MJ, Kim YJ, Bae YC, Jung JS. Overexpression of CXCR4 increases migration and proliferation of human adipose tissue stromal cells. Stem Cells Dev. 2006; 15: 853-864.
- Banas A, Teratani T, Yamamoto Y, Tokuhara M, Takeshita F, Kato T, Okochi H, Ochiya T. In vivo therapeutic potential of human Adipose Tissue Mesenchymal Stem Cells (AT-MSCs) after transplantation into mice with liver injury. Stem Cells. 2008; 26: 2705-2712.
- Parekkadan B, van Poll D, Suganuma K, Carter EA, Berthiaume F, Tilles AW, Yarmush ML. Mesenchymal stem cell-derived molecules reverse fulminant hepatic failure. PLoS ONE. 2007; 2: e94.
- van Poll D, Parekkadan B, Cho CH, Berthiaume F, Nahmias Y, Tilles AW, Yarmush ML. Mesenchymal stem cell-derived molecules directly modulate hepatocellular death and regeneration in vitro and in vivo. Hepatology. 2008; 47: 1634-1643.
- Urbán VS, Kiss J, Kovács J, Gócza E, Vas V, Monostori E, Uher F. Mesenchymal stem cells cooperate with bone marrow cells in therapy of diabetes. Stem Cells. 2008; 26: 244-253.
- Cyranoski D. Korean deaths spark inquiry. Nature. 2010; 468: 485.
- Thirabanjasak D, Tantiwongse K, Thorner PS. Angiomyeloproliferative lesions following autologous stem cell therapy. J Am Soc Nephrol. 2010; 21: 1218-1222.










