研究交流
肝細胞とラミニン研究の接点
吉川大和
東京薬科大学・薬学部・病態生化学教室
【はじめに】
ラミニンは、細胞の分化を制御する分子のひとつとしてよく知られ、肝細胞の培養にも用いられる。しかしながら、ラミニンに多様なアイソフォームがあること、それぞれに特異的な機能があることなどは余り知られていない。本稿では、ラミニン研究の背景を説明しながら、ラミニン研究をどのように肝細胞の機能解明に結びつけるか、そして肝細胞の培養方法などに応用していくか、肝細胞との接点を求めている我々の研究を中心に紹介する。
【ラミニン研究の背景】
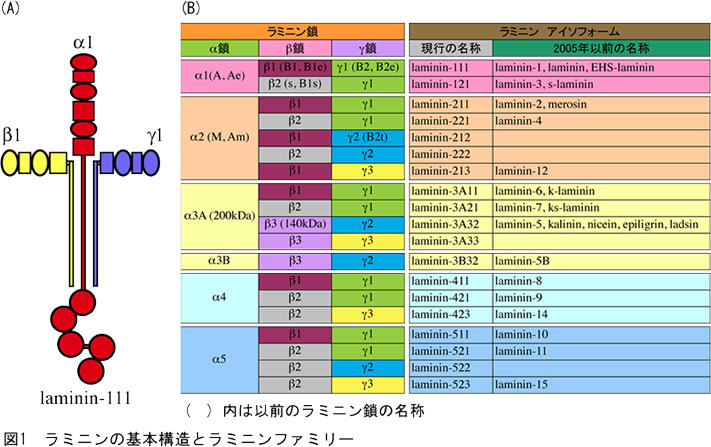
ラミニンは、IV型コラーゲン、ニドゲン、パールカンとともに基底膜を形成し、細胞接着において中心的な役割を果たしている。ラミニンを構成する 3 本の鎖 (図1A) には、それぞれα鎖が 5 種類、β鎖が 3 種類、γ鎖が 3 種類あり、その組み合せによって 19 種類のアイソフォームが存在する (図1B) (1)。3本の鎖のうちα鎖が細胞の接着に関与し、ラミニンの主要な機能を担っている。ラミニンの名称は、命名法が 1994 年と 2005年に訂正され、その前後で異なっている (2,3)。アイソフォームのなかで、ラミニン-111 が最初に精製され最も研究されている。このため過去の論文でラミニンと表記された場合はラミニン-111 をさすことが多い。その後、ラミニン各鎖の遺伝子およびアイソフォームが報告されてきたが、性質の異なるアイソフォームをそのままラミニンとして使用する論文も存在してきた。例えば、市販されていたヒト胎盤由来のラミニンはラミニン-511を含んでおり、ラミニン-111 は含まれていなかった (4)。このため、ラミニン-111 とヒトの胎盤由来のラミニンで結果が異なる状況が生じていた。また、現在でもラミニン-111 に対するポリクローナル抗体が免疫組織染色によく使用されている。この抗体は基底膜やラミニンの存在を示すことはできるが、ラミニン鎖を特定することはできない。現在、各鎖に対する抗体も利用可能になっているが、かつてヒトラミニンα5 鎖に対するモノクローナル抗体がα1鎖に対する抗体として市販されていたため、遺伝子と蛋白質の発現に食い違いが生じて混乱していた(5)。現在では、市販されている抗体も整理・訂正がなされている。各ラミニン鎖の機能については、参考文献1の総説を参照されたい。
【肝臓、肝再生および肝細胞癌におけるラミニン発現の再評価】
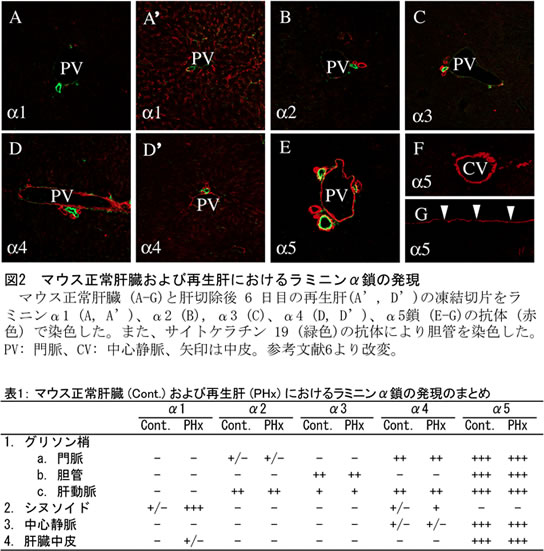
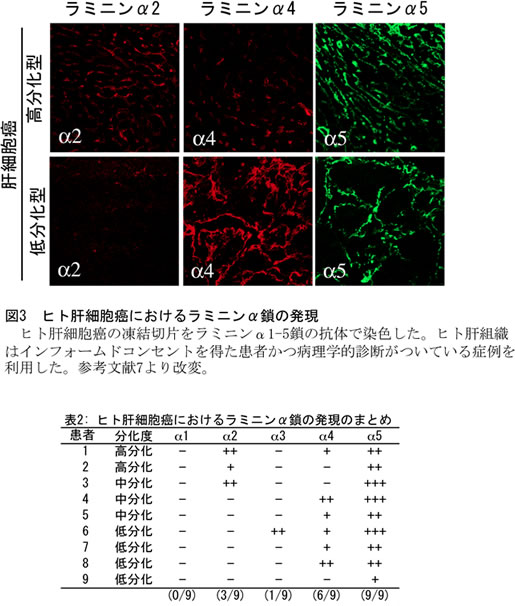
肝臓の門脈や肝動脈、中心静脈、胆管の基底膜におけるラミニンは、ヒトとげっ歯類で多少違うが、ラミニンα5 鎖を含むラミニン-511 が主要なアイソフォームである (図2、表1) (6,7)。一方、ディッセ腔は上皮細胞と内皮細胞の間にあるにもかかわらず、基底膜が存在せずラミニンも認められない。しかしながら肝再生および肝細胞癌において、機能の中心であるα鎖は不明であるが、ラミニンの存在は示唆されてきた (8,9)。各α鎖に特異的な抗体を用いてマウスの肝再生を再評価したところ、肝切除後 6 日目においてラミニンα1鎖を含むラミニンを発現していた (6)。ヒトの肝細胞癌についても、同様に特異的な抗体を用いて再評価を行った (7)。その結果、α2 およびα4 鎖を含むラミニンが観察されたが (図3、表2)、高分化から低分化型を通して、ラミニンα5 鎖を含むラミニン-511 が主要なアイソフォームであることが明らかになった。これらのラミニンの役割について十分な解明がまだできていないが、各α鎖に結合する受容体も発現するようになることから、積極的な相互作用が示唆されている。
【ラミニンα1 鎖由来の合成ペプチドによる肝細胞の培養】
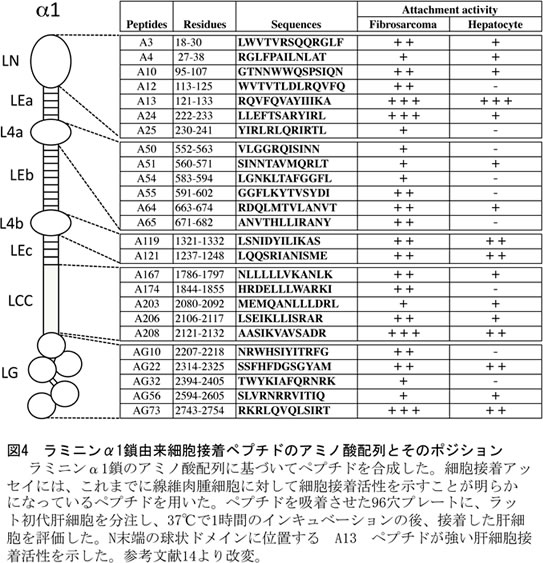
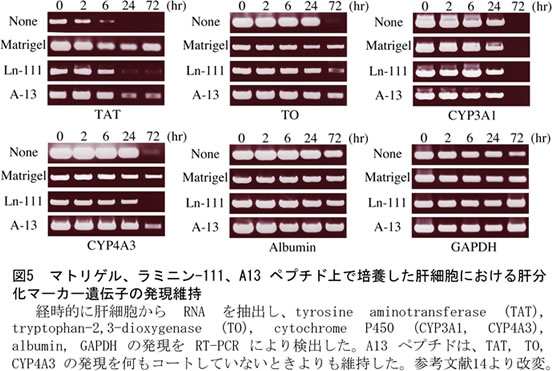
肝細胞の代謝機能は、さまざまなサイトカインや細胞外マトリックスによる複雑な細胞外環境によって制御されているため、肝臓から単離されると急速に低下する。これまでに多くの研究者が、サイトカインだけでなく、細胞外マトリックスを含む培養条件の検討を行ってきた。なかでも、マトリゲルを塗布した培養ディッシュで肝細胞を培養した場合、通常の培養ディッシュに比べて、肝細胞の代謝機能が長く維持されることが知られている (10-12)。マトリゲルは、マウス EHS 肉腫由来のゲルで基底膜の主要な分子である IV型コラーゲン、ニドゲン、パールカン、ラミニン-111 を含んでいる。ラミニン-111 は、マトリゲルのなかで主に細胞の接着に関わることから、肝細胞の機能維持に積極的に関与している。ラミニン-111 は分子量80万の巨大な蛋白質であり、多くの機能部位が存在している。我々の研究室では、ラミニン-111のα1鎖全アミノ酸配列を網羅する321種類のペプチドを合成し、ヒト線維肉腫細胞HT-1080を用いて25種類の細胞接着ペプチドを同定してきた(13)。ラット初代肝細胞を用いて、この細胞接着ペプチドの接着活性を検討したところ、16種類のペプチドに肝細胞接着活性がみられ、A13(RQVFQVAYIIIKA)が強い活性を示した (図4)(14)。さらに、肝細胞をA13でコートしたプレート上で培養し、代謝遺伝子の発現をRT-PCR法にて解析したところ、通常の培養プレート上ではTyrosine aminotransferase(TAT)、Tryptophan-2,3-dioxygenase(TO)、Cytochrome P450(CYP)といった代謝遺伝子の発現が経時的に消失していくが、A13をコートしたプレート上ではマトリゲルと同様に72時間後においてもTAT、TO、CYP4A3の発現が維持された(図5)。 A13 ペプチドは肝細胞の培養に有効であるだけでなく、そのアミノ酸配列がバイオマテリアルのデザインに役立つのではないかと考えている。
【おわりに】
ラミニン発現の再評価は、肝臓の基底膜や肝細胞癌でα5 鎖を含むラミニンが、肝再生ではα1 鎖を含むラミニンが主要なアイソフォームとなっていることを明らかにした。今後は、肝細胞に対するラミニンの役割を明らかにするだけでなく、類洞内皮細胞などに対する役割も検討していきたいと考えている。一方、肝細胞接着ペプチド A13 だけでは、肝細胞の機能維持に不十分であり、さらなる機能性ペプチドを探索する必要がある。我々の研究室では、機能性ペプチドによるバイオマテリアルの創製に取り組んできており、肝細胞接着ペプチドを利用した人工的なマトリゲルをひとつのゴールとして目指している。筆者は、大学院生のときに精製した癌細胞由来の細胞分散因子が、ラミニン-5(現在のラミニン-332)であったことがきっかけとなって、ラミニンの研究を続けている。ラミニンを肝細胞研究会のキーワードとして気にかけてもらえれば、研究交流が共同研究へ進展するのではないかと期待している。
最後に本稿を書く機会を与えていただきました塩尻信義先生に厚くお礼申しあげます。ここで紹介した研究成果は、札幌医科大学の三高俊広教授、平田公一教授、水口徹准教授、東京薬科大学の野水基義教授、そして各研究室のメンバーの協力で得られたものです。
参考文献
- Durbeej, M. (2009) Cell Tissue Res 339, 259-268
- Aumailley, M., Bruckner-Tuderman, L., Carter, W. G., Deutzmann, R., Edgar, D., Ekblom, P., Engel, J., et al. (2005) Matrix Biol 24, 326-332
- Burgeson, R. E., Chiquet, M., Deutzmann, R., Ekblom, P., Engel, J., Kleinman, H., Martin, G. R., et al. (1994) Matrix Biol 14, 209-211
- Ferletta, M., and Ekblom, P. (1999) J Cell Sci 112, 1-10
- Kikkawa, Y., Sanzen, N., and Sekiguchi, K. (1998) J Biol Chem 273, 15854-15859
- Kikkawa, Y., Mochizuki, Y., Miner, J. H., and Mitaka, T. (2005) Exp Cell Res 305, 99-109
- Kikkawa, Y., Sudo, R., Kon, J., Mizuguchi, T., Nomizu, M., Hirata, K., and Mitaka, T. (2008) Exp Cell Res 314, 2579-2590
- Martinez-Hernandez, A., Delgado, F. M., and Amenta, P. S. (1991) Lab Invest 64, 157-166
- Hahn, E., Wick, G., Pencev, D., and Timpl, R. (1980) Gut 21, 63-71
- Nagaki, M., Shidoji, Y., Yamada, Y., Sugiyama, A., Tanaka, M., Akaike, T., Ohnishi, H., et al. (1995) Biochem Biophys Res Commun 210, 38-43
- Oda, H., Nozawa, K., Hitomi, Y., and Kakinuma, A. (1995) Biochem Biophys Res Commun 212, 800-805
- Sawada, N., Tomomura, A., Sattler, C. A., Sattler, G. L., Kleinman, H. K., and Pitot, H. C. (1987) In Vitro Cell Dev Biol 23, 267-273
- Suzuki, N., Yokoyama, F., and Nomizu, M. (2005) Connect Tissue Res 46, 142-152
- Kikkawa, Y., Takahashi, N., Matsuda, Y., Miwa, T., Akizuki, T., Kataoka, A., and Nomizu, M. (2009) Biomaterials 30, 6888-6895