研究交流
タイト結合蛋白claudinと肝疾患の接点
澤田典均
札幌医科大学医学部病理学第二講座
肝細胞の細胞膜は,毛細胆管の辺縁に存在する細胞間接着装置タイト結合(図1)によって,肝細胞の表面積のわずか13%の毛細胆管膜と,それ以外の細胞膜(37% は Disse 腔に面し, 50%は隣接する肝細胞に面する)に区別されている.この毛細胆管膜とDisse 腔に面する細胞膜(類洞膜)は,それぞれ胆汁を排泄するという外分泌的機能と,血中へ種々の物質を放出するという内分泌的機能のフロントをなしている.類洞膜には,アルブミン,アシアロ糖蛋白,LDL 等に対するレセプターを持ち,肝細胞は血中から選択的に蛋白やリポ蛋白を取り込み,ライソゾームに運んで分解している.分解物の一部は毛細胆管に排泄され,レセプターは再び類洞膜へとリサイクルされる.このような細胞膜の極性は,毛細胆管周囲に存在するタイト結合のフェンス機能によって維持される.
一方,いったん毛細胆管に排泄された胆汁は,漏れ出すことはない.これはタイト結合のバリア機能による.肝炎,肝障害,肝癌など様々な肝疾患では,肝細胞の細胞間接着装置に著しい変化が認められる.とくに感染症や消化管手術後に続発し患者の予後を左右する黄疸の発生の原因に,肝細胞のタイト結合の機能低下が関与している.
一般的にタイト結合は,上皮細胞の管腔面近くに存在し,細胞の全周をベルトのように取り巻き,膜貫通性蛋白claudinにより,細胞膜と細胞膜を密着させている.そのためタイト結合は,細胞間隙(パラセルラー経路,図1Aの矢印)を通過する物質の透過性を制御するバリア機能を持つ.凍結割断法による細胞膜の膜内粒子の観察によって,タイト結合が,数珠状に配列した膜内蛋白の網目構造からなり,この網目の密度や断裂がバリア機能の強さに良く相関する(図1).タイト結合の最も重要な蛋白であるclaudin は分子量約23kDaで,膜貫通ドメインを4個もち,二つの細胞外ループを有している.Claudin は,C末端のPDZドメインを介して前述のZO-1だけでなくZO-2,-3,PATJ, MUPP1などの蛋白と結合している.さらにclaudinの一つ目の細胞外ドメインは,イオンの選択的透過性に関与し,二つ目の細胞外ループは,細菌毒素およびウイルス(HCV)のレセプターとしての役割も考えられている(図2A).Claudinは,少なくとも24種の遺伝子ファミリーを形成しており,各々単独でストランドを形成することができる.1個の細胞には,複数種のclaudinが発現しており,細胞や臓器の特異性に関与していると考えられている(図2B) .さらにストランドを構成するclaudinの組み合わせ(ヘテロポリマー)により物質を透過しやすくなるポアを形成すると考えられている(図2C).文献的に肝臓には,claudin-1,-2,-3,-5,-7,-8,-14の発現が報告されている.図3Aには,我々がヒト肝組織を用いて行ったRT-PCR の結果を示した.PCRのサイクル数などのテクニカルな点或いは種差のためか,報告とは若干の違いはあるが,そのうち肝細胞の毛細胆管周囲には,claudin-1,-2の明らかな発現が認められる(図3B).特にclaudin-2においては,ヒト,ラット,マウスのいずれの種においても小葉中心性に強く発現が見られている.また“hepatic stem cell”ではclaudin-3が,“adult hepatic progenitor cell”では,claudin-4, EpCAM と結合するとされているclaudin-7 が発現していると報告されている.Claudinのほか,膜貫通蛋白occludin, JAM, tricellulin, MarvelD3が発見されている.Occludin, tricellulin, MarvelD3は,MARVEL(MAL and related proteins for vesicle trafficking and membrane domain)のsubfamilyである(2).Occludinはタイト結合のもっとも信頼できるマーカーであり,tricellulinは3細胞接着点に特異的に局在する.しかしこれらの蛋白の機能はほとんど不明であり,これから明らかにされよう.細胞質蛋白としてZO-1,ZO-2,ZO-3やcingulinなど多くのタイト結合裏打ち蛋白が見出され,タイト結合の研究は分子の時代に入った.ヒト遺伝性疾患では,低マグネシウム血症の原因遺伝子(claudin-16, -19),感音性難聴(claudin-14, tricellulin), 魚鱗癬と胆管炎の合併症 (claudin-1)が報告されている.レオウイルスがJAM-A,コクサッキーウイルスとアデノウイルスがCARをレセプターとしている.コレラ菌,腸管病原性大腸菌,クロストリジウムディフィシル,ヘリコバクターピロリが,タイト結合機能を低下させる.最近,C 型肝炎ウイルスがヒト肝細胞に感染する際に,CD81とともに,occludin, claudin-1がco-recepter として必須であることが明らかになった.
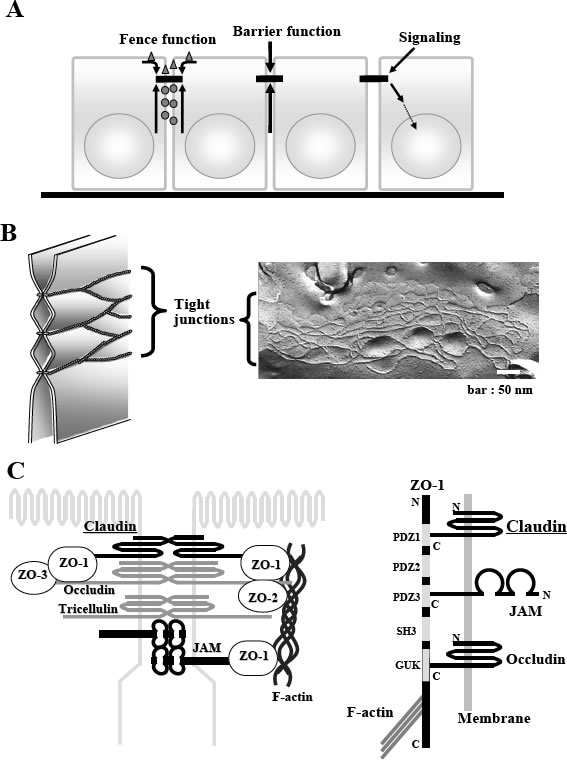
図1タイト結合の機能,構造,蛋白
A: タイト結合機能の模式図.
B: タイト結合の構造模式図と凍結割断法によるタイト結合ストランドのレプリカ像.
C: 主なタイト結合関連蛋白の構成図.
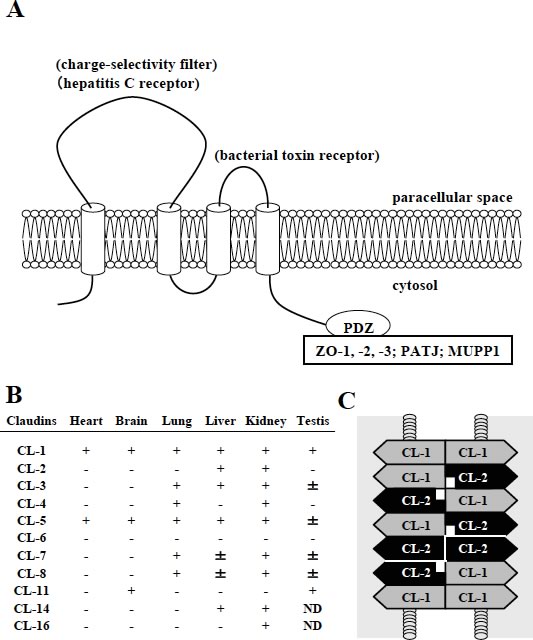
図2 claudinの構造,機能,発現分布
A:
claudinの分子構造図.
B: claudinの臓器別発現分布.
C: claudin-1,-2によるポア形成モデル図.
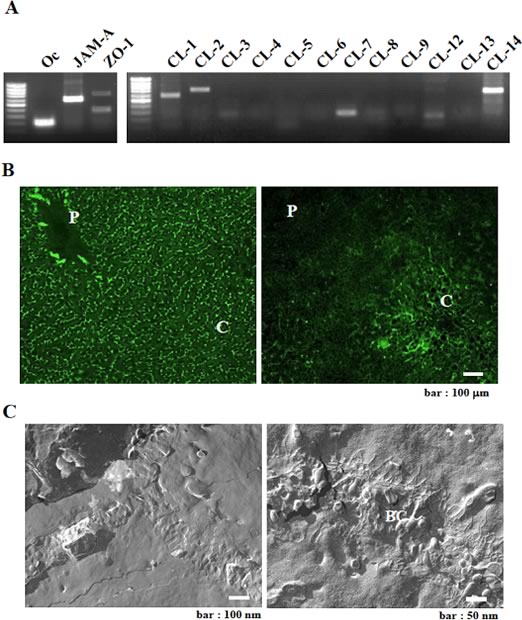
図3 正常ヒト肝組織におけるタイト結合蛋白の発現とclaudin-1,-2の局在
A: ヒト肝組織におけるタイト結合分子のmRNAの発現(RT-PCR),Oc:occludin.
B: ヒト肝小葉内におけるclaudin-1(左),-2(右)の発現分布(免疫染色,C:小葉中心,P:小葉辺縁).
C: ヒト肝細胞のタイト結合ストランドのレプリカ像(凍結割断), BC:bile canaliculi.
肝疾患における重要な症候,黄疸発生におけるclaudinの変化についての詳細な報告は未だない.参考のために図4に,ラットにthioacetamideを投与した時の変化を示した.我々は,初代培養ラット肝細胞を用いて,黄疸発生に関与が考えられるサイトカイン(IL-1beta, TNF-alpha, IL-6)および増殖因子(EGF, HGF, TGF-beta)処置によるclaudin-1,-2の発現変化を検索した.結果,IL-1beta, EGF, HGFおよびTGF-beta処置によりclaudin-2の著しい増加が認められた(図5).そしてそれらの変化は,様々なシグナル伝達経路を介して調節されていることが分かった.しかしより複雑な個体の病態でおこるcytokine stormで,肝細胞のタイト結合機能がどのように変化しているのかについては想像の域を出ない.
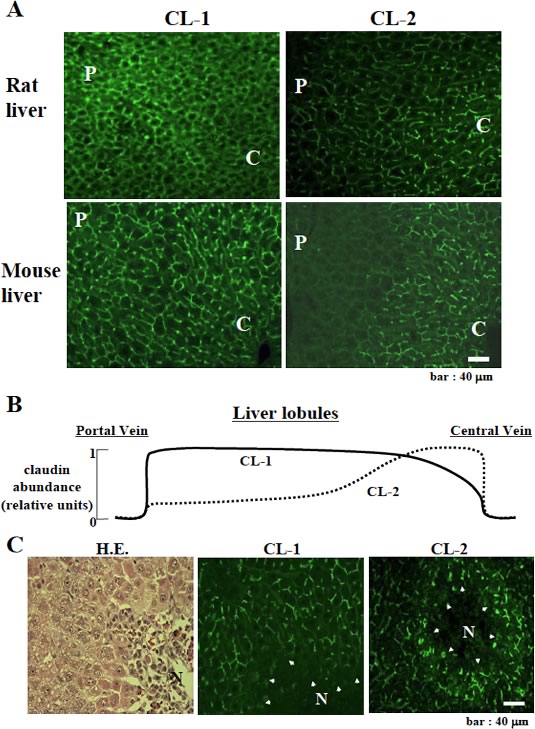
図4 claudin-1,-2の肝小葉内局在と壊死後の変化
A: 肝小葉内におけるclaudin-1,-2の発現分布(免疫染色,C:小葉中心,P:小葉辺縁).
B: claudin-1,-2の肝小葉内局在の模式図.
C: 小葉中心性壊死後のclaudin-1,-2の発現変化(H&E), N:necrotic lesion.
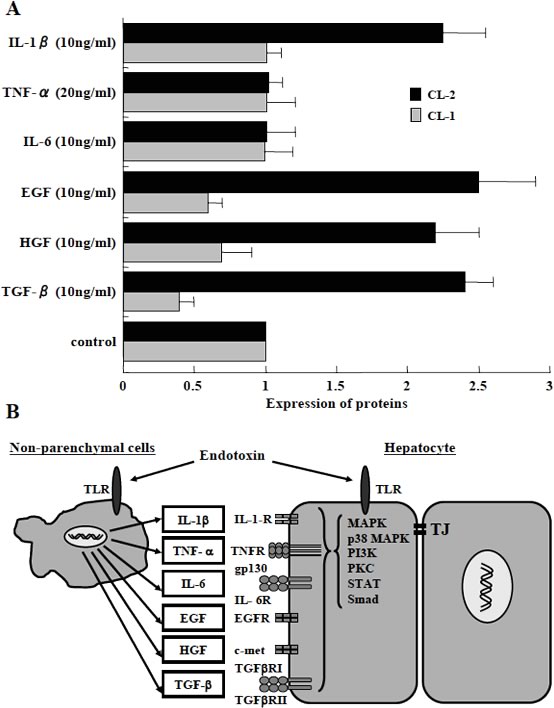
図5 初代ラット培養肝細胞を用いたサイトカインおよび増殖因子によるclaudin-1,-2の発現変化
A: サイトカインおよび増殖因子によるclaudin-1,-2蛋白の発現変化.
B: 非実質細胞産生サイトカインおよび増殖因子に対する肝細胞におけるレセプターとシグナル伝達機構.
Apc 遺伝子が肝小葉内のzonation を制御していることが明らかにされていた.中心静脈周囲では,beta-catenin/Wnt signal が活性化されている(3).またAMP-activated protein kinase とLKB1 が毛細胆管網の形成を促すことが明らかにされた(4).LKB1 は,PAR-1 を介してタイト結合形成に関与していると考えられている.つい最近の報告では,肝特異的beta-catenin ノックアウトマウスで,毛細胆管に異常が起こり肝内胆汁鬱滞が起こることが示された.このマウスでは,claudin-2の発現がほとんどなかったが,タイト結合は形成されていたと報告されている(4).つまりclaudin-2 はWntシグナルにも強く制御を受けていることが示唆される.一方,我々も,肝細胞極性を良く保持しているWIF-B1 細胞にclaudin-2のsiRNA を導入すると,毛細胆管様のcyst 形成が抑制されることを報告している(5).さらに我々は,ヒト閉塞性黄疸でclaudin-1とともにclaudin-2 も発現が上昇していること(6)を観察している(図6).先にも述べたが, Claudin-2 は,正常の肝小葉中心静脈周囲に高発現していること,肝細胞のclaudin-2が選択的にイオン,具体的にはNaイオン,を通過させる機能をもち,最近water-channel として考えられるようになったこと(7)を考えると,claudin-2 は,タイト結合の一部に組み込まれて存在し,その浸透圧調節により毛細胆管内の胆汁量の調節をし,胆汁を速やかに小葉中心から辺縁に流すのに積極的に働いているのではないかと考えられる.
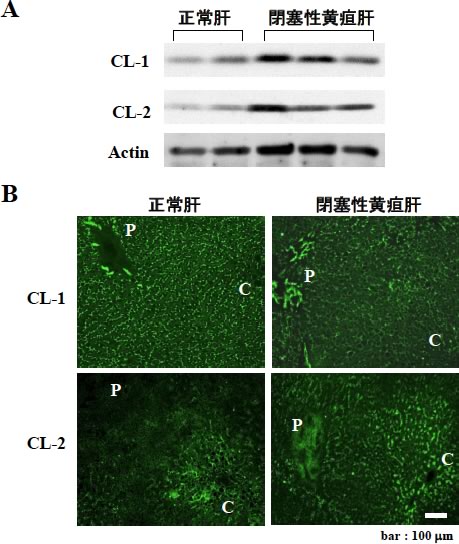
図6 ヒト閉塞性黄疸肝におけるclaudin-1,-2の発現と局在変化
A: ヒト閉塞性黄疸肝におけるclaudin-1,-2蛋白の発現変化(Western blot).
B: ヒト閉塞性黄疸肝におけるclaudin-1,-2の局在の変化(免疫染色,C:小葉中心,P:小葉辺縁).
肝疾患とタイト結合蛋白claudinとの関係の研究は始まったばかりであり,羅列的な文章になったことをお許し願いたい.ギャップ結合やマイクロフィラメントによるタイト結合の機能調節もあり,また,肝細胞の極性が極めて特殊であるため,培養系での肝細胞タイト結合の解析も難しいが,より多くの方に,肝細胞のタイト結合の研究に参加していただきたいと願っている.
参考文献
- Kojima T, Murata M, Yamamoto T, Lan M, Imamura M, Son S, Takano K, Yamaguchi H, Ito T, Tanaka S, Chiba H, Hirata K, Sawada N. Tight junction proteins and signal transduction pathways in hepatocytes. Histol Histopathol, 24: 1463-1472, 2009.(特に指定がないかぎりは,この総説を参照されたい)
- Raleigh DR, Marchiando AM, Zhang Y, Shen L, Sasaki H, Wang Y, Long M, Turner JR. Tight junction-associated MARVEL proteins MarvelD3, Tricellulin, and occluding have distinct but overlapping functions. Mol Biol cell, 21:1200-1213, 2010.
- Benhamouche S, Decaens T, Godard C, Chambrey R, Rickman DS, Moinard C, Vasseur-Cognet M, Kuo CJ, Kahn A, Perret C, Colnot S. Apc tumor suppressor gene is the “zonation-keeper” of the mouse liver. Dev Cell,10: 759-770, 2006.
- Fu D, Wakabayashi Y, Lippincott-Schwartz J, Arias IM. Regulation of bile canalicular network formation and maintenance by AMP-activated protein kinase and LKB1. J Cell Sci, 123:3294-3302,2010
- Son S, Kojima T, Decaens C, Yamaguchi H, Ito T, Imamura M, Murata M, Tanaka S, Chiba H, Hirata K, Sawada N. Knockdown of tight junction protein claudin-2 prevents bile canalicular formation in WIF-B9 cells. Histochem Cell Biol, 131: 411-424, 2009.
- 小島隆,村田雅樹,澤田典均. 肝細胞タイト結合,claudin と肝小葉. 肝胆膵,55:45-54, 2007.
- Rosenthal R, Milatz S, Krug SM, Oelrich B, Schulzke JD, Amasheh S, Günzel D, Fromm M. Claudin-2, a component of the tight junction, forms a paracellular water channel. J Cell Sci, 123:1913-1921, 2010.










